扩展功能
文章信息
- 崔妍, 王若男, 吴九如, 魏淑, 林圣娟, 王中男
- CUI Yan, WANG Ruonan, WU Jiuru, WEI Shu, LIN Shengjuan, WANG Zhongnan
- 酸枣仁和合欢花水提取物对焦虑性抑郁症模型大鼠HPA轴及炎症因子的影响
- Effect of water extract of spina date seed and albizzia julibrissin flower on hpa axis and inflammatory cytokines in anxious depression model rats
- 吉林大学学报(医学版), 2019, 45(03): 539-545
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 539-545
- 10.13481/j.1671-587x.20190312
-
文章历史
- 收稿日期: 2019-01-06
2. 长春中医药大学针灸推拿学院推拿教研室, 吉林 长春 130117
2. Manipulation Teaching and Research Section, College of Acupuncture and Massage, Changchun University of Traditional Chinese, Changchun 130117, China
焦虑性抑郁症是重度抑郁症的一种亚型,其病情严重且预后较差[1]。临床中约有90%的抑郁症患者伴有不同程度的焦虑症状,约有50%的抑郁症患者存在焦虑抑郁共病[2]。焦虑性抑郁症患者治疗难度更大,自杀风险更高。研究者[3]认为下丘脑-垂体-肾上腺(hypothalamus-pituitary-adrenal, HPA)轴的过度活跃是构成包括焦虑性抑郁在内的精神疾病的基本生物学机制之一。炎症因子(inflammatory factors,IF)的激活可能会导致HPA轴的异常活化,白细胞介素1β(interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)能促进下丘脑中促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)的表达,从而使CRH的分泌增加,进一步刺激垂体促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)的释放,最终导致肾上腺皮质分泌更多的皮质酮(corticosterone,CORT)[4]。炎症反应和HPA轴紊乱可能是导致焦虑性抑郁症的原因之一。因此,对焦虑性抑郁症进行准确诊断和有效治疗,并对其发病机制及治疗机制进行深入研究,对于疾病的临床防治有重要意义。中药复方具有多成分和多靶点的作用,文献[5]记载中药复方对抑郁症有较好的防治作用、不良反应少且无成瘾性。国内研究[6-8]显示:酸枣仁和合欢花药对配伍应用,疗效确切,具有缓解轻中度抑郁患者临床症状的作用。本实验选用酸枣仁和合欢花的水提物,通过单味药及其配伍应用,对焦虑性抑郁症动物模型进行研究,观察各组大鼠行为学、血清中CRH、ACTH、CORT、IL-1β和IL-6水平及海马形态改变,探讨酸枣仁和合欢花配伍应用对焦虑性抑郁症的治疗效果及其作用机制。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器80只Wistar大鼠,SPF级,雌雄各半,体质量220~250 g,由辽宁长生生物技术有限公司提供,动物合格证号:SCXK(辽)2015-0001。酸枣仁和合欢花购自长春中医药大学附属医院药剂科,将药材煎煮浓缩为1 g(生药量)·mL-1药液,由长春中医药大学研究中心实验室制备,4℃保存备用,CORT(TCI上海化成工业发展有限公司),二甲基亚砜(DMSO)(美国MP Biomedicals生物医学公司),甲醛溶液(分析纯,天津永晟精细化工有限公司),CRH、ACTH、CORT、IL-1β和IL-6酶联免疫试剂盒(美国R&D公司)。酶标仪(BIO680,美国伯乐公司),石蜡切片机(RM2245,上海Leica公司产品),全自动纤维照相装置(10AO)和光学显微镜(日本Olympus公司)。
1.2 实验动物分组和给药Wistar大鼠适应环境后随机分为空白组、模型组、低剂量酸枣仁组、高剂量酸枣仁组、低剂量合欢花组、高剂量合欢花组、低剂量酸枣仁-合欢花组和高剂量酸枣仁-合欢花组,每组10只。
酸枣仁与合欢花的给药剂量按实验大鼠与人等效剂量换算系数5.4倍折算后,高剂量酸枣仁、高剂量合欢花和高剂量酸枣仁-合欢花组大鼠给药量相当于该药临床等效剂量的2倍;低剂量酸枣仁、低剂量合欢花和低剂量酸枣仁-合欢花组大鼠给药量相当于该药临床等效剂量的1倍。低剂量酸枣仁组大鼠给药量为1.35 g·kg-1、高剂量酸枣仁组大鼠给药量为2.70 g·kg-1、低剂量合欢花组大鼠给药量为1.80 g·kg-1、高剂量合欢花组大鼠给药量为3.60 g·kg-1、低剂量酸枣仁-合欢花组大鼠给药量为1.35 g·kg-1酸枣仁+1.80 g·kg-1合欢花、高剂量酸枣仁-合欢花组大鼠给药量为2.70 g·kg-1酸枣仁+3.60 g·kg-1合欢花。从造模第1天起,空白组和模型组大鼠每日给予蒸馏水灌胃,其余各组按照大鼠体质量及其组别给予相应药物,每日给药1次,给药体积为10 mL·kg-1,连续28 d。每7 d称大鼠体质量,根据体质量调整给药剂量。
1.3 焦虑性抑郁症动物模型的制备[9]除空白组外,其余各组大鼠均孤笼饲养并采用应激束缚联合CORT皮下注射方法进行造模。每日8:00~14:00将大鼠固定于束缚固定器中造模6 h,期间禁食水。束缚后于大鼠背部皮下进行CORT多点注射,注射量为30 mg·kg-1,CORT混悬液使用5%DMSO配制。连续造模28 d。空白组大鼠不进行束缚造模,于大鼠背部皮下多点注射5%DMSO生理盐水溶液。
1.4 行为学测试 1.4.1 强迫游泳实验(forced swimming test,FST)[10]将大鼠头向下,腹部朝向桶壁放入高度为50 cm、直径为20 cm的圆柱形筒中,水温(24±2)℃,水深约40 cm。强迫游泳共进行6 min,前2 min为适应时间,后4 min为记录时间,记录大鼠在水中静止时间。大鼠静止的标准为大鼠漂浮不动,前爪不动或轻微划动保持身体不下沉。
1.4.2 高架十字迷宫实验(elevatedplus maze,EPM)[11]将大鼠头部正对封闭臂,于迷宫中央平台处放入。记录5 min内大鼠的活动情况:进入开放臂的次数(open arm entry,OE)、进入封闭臂的次数(close arm entry,CE)、进入开放臂的时间(open arm entry time,OT)和进入封闭臂的时间(close arm entry time,CT)。利用以上数据分别计算:进入开放臂和封闭臂的总次数(total entry of open arms and close arms,TE),TE=OE+CE,TE表示大鼠的活动能力;OE占总入臂次数的比例(OE%),OE%=OE/(OE+CE)× 100%;OT占总入臂时间的比例(OT%), OT%= OT/(OT+CT)×100%。以OE%和OT%作为抗焦虑作用的疗效评定指标。
1.5 样本采集28 d后,各组大鼠进行FST后,以20%乌拉坦腹腔注射麻醉(5 mL·kg-1),腹主动脉取血,静置1 h后,于4℃离心机中以3 000 r·min-1离心,离心时间为15 min,离心后取上清液,置于-80℃冰箱,待测。取血后断头处死,迅速取出大鼠脑组织,于冰盒上分离大鼠海马,固定于10%中性甲醛中,48 h后进行HE染色。
1.6 各组大鼠血清中CRH、ACTH、CORT、IL-1β和IL-6水平检测采用ELISA法检测大鼠血清中CRH、ACTH、CORT、IL-1β和IL-6水平,严格按照相关试剂盒说明书的方法及步骤进行操作。
1.7 HE染色观察各组大鼠海马神经细胞形态表现将固定完成的大鼠海马按照文献[12]的方法进行固定染色,光学显微镜下观察各组大鼠海马神经细胞形态表现。
1.8 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组大鼠强迫游泳静止时间,高架十字迷宫实验中大鼠TE、OE%和OT%,血清中CRH、ACTH、CORT、IL-1β和IL-6水平以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠强迫游泳静止时间与空白组比较,模型组大鼠强迫游泳静止时间明显延长(P < 0.01),表明模型组大鼠绝望情绪明显,模型复制成功。与模型组比较,低、高剂量酸枣仁-合欢花组,高剂量酸枣仁组及高剂量合欢花组大鼠强迫游泳静止时间明显缩短(P < 0.05或P < 0.01);低剂量酸枣仁组和低剂量合欢花组大鼠强迫游泳静止时间比较差异无统计学意义(P>0.05)。与高剂量酸枣仁组和高剂量合欢花组比较,高剂量酸枣仁-合欢花组大鼠强迫游泳静止时间明显缩短(P < 0.01);与低剂量酸枣仁组和低剂量合欢花组比较,低剂量酸枣仁-合欢花组大鼠强迫游泳静止时间明显缩短(P < 0.05或P < 0.01)。见表 1。
| (n=10, x±s, t/s) | |
| Group | Immobility time of forced swimming |
| Blank | 35.18±7.25 |
| Model | 60.28±9.37* |
| SDS | |
| Low dose | 57.37±10.02 |
| High dose | 50.72±9.01△ |
| AJF | |
| Low dose | 58.92±9.79 |
| High dose | 49.95±9.27△ |
| SDS-AJF | |
| Low dose | 45.58±8.35△△○▲ |
| High dose | 39.03±6.79△△#□ |
| * P < 0.01 compared with blank group;△ P < 0.05,△△ P < 0.01 compared with model group;# P < 0.01 compared with high dose of AJF group;○ P < 0.01 compared with low dose of AJF group;□ P < 0.05 compared with low dose of SDS group; ▲ P < 0.05 compared with high dose of SDS group.SDS:Spina date seed; AJF:Albizzia julibrissin flower. | |
与空白组比较,模型组大鼠OE%和OT%明显降低(P < 0.01),表明模型组大鼠对新奇环境的探索性降低,恐惧性加重,模型复制成功。与模型组比较,低和高剂量酸枣仁-合欢花组、高剂量酸枣仁组和高剂量合欢花组大鼠OE%和OT%明显升高(P < 0.05或P < 0.01);低剂量酸枣仁组和低剂量合欢花组大鼠OE%和OT%比较差异无统计学意义(P>0.05)。与高剂量酸枣仁组和高剂量合欢花组比较,高剂量酸枣仁-合欢花组大鼠OE%和OT%明显升高(P < 0.05或P < 0.01);与低剂量酸枣仁组和低剂量合欢花组比较,低剂量酸枣仁-合欢花组大鼠OE%和OT%明显升高(P < 0.05或P < 0.01)。见表 2。
| (n=10, x±s) | |||
| Group | TE | OE%(η/%) | OT%(η/%) |
| Blank | 11.90±2.28 | 45.09±9.14 | 30.03±7.48 |
| Model | 9.70±2.36 | 31.09±6.05* | 17.85±5.55* |
| SDS | |||
| Low dose | 10.30±2.98 | 32.55±5.19 | 19.57±5.20 |
| High dose | 10.80±1.75 | 37.45±3.55△ | 22.64±2.85△ |
| AJF | |||
| Low dose | 9.90±1.66 | 31.27±5.72 | 18.21±2.85 |
| High dose | 10.20±1.87 | 36.45±5.33△ | 21.34±3.14 |
| SDS-AJF | |||
| Low dose | 11.50±1.84 | 41.91±8.03△△○▲▲ | 24.19±2.60△△○○▲ |
| High dose | 11.70±2.21 | 43.09±6.88△△#□ | 27.51±5.75△△#□□ |
| * P < 0.01 compared with blank group;△ P < 0.05,△△ P < 0.01 compared with model group # P < 0.05 compared with high dose of SDS group;○ P < 0.05,○○ P < 0.01 compared with low dose of AJF group; □ P < 0.05,□□ P < 0.01 compared with high dose of AJF group; ▲ P < 0.05,▲▲ P < 0.01 compared with low dose of SDS group.SDS:Spina date seed; AJF:Albizzia julibrissin flower. | |||
与空白组比较,模型组大鼠血清中CHR、ACTH和CORT水平明显升高(P < 0.01)。与模型组比较,低和高剂量酸枣仁-合欢花组、高剂量酸枣仁组及高剂量合欢花组大鼠血清中CHR水平明显降低(P < 0.05或P < 0.01);低剂量酸枣仁组、高剂量合欢花组和低剂量合欢花组大鼠血清中CHR水平差异无统计学意义(P>0.05)。与高剂量酸枣仁组和高剂量合欢花组比较,高剂量酸枣仁-合欢花组大鼠血清中CHR水平均明显降低(P < 0.01);与低剂量合欢花组比较,低剂量酸枣仁-合欢花组大鼠血清中CHR水平明显降低(P < 0.05);与低剂量酸枣仁组比较,低剂量酸枣仁-合欢花组大鼠血清中CHR水平差异无统计学意义(P>0.05)。与模型组比较,低和高剂量酸枣仁-合欢花组、低和高剂量酸枣仁组及高剂量合欢花组大鼠血清中ACTH明显降低(P < 0.05或P < 0.01),低剂量合欢花组大鼠血清中ACTH水平差异无统计学意义(P>0.05)。与高剂量酸枣仁和高剂量合欢花组比较,高剂量酸枣仁-合欢花组大鼠血清中ACTH水平明显降低(P < 0.05)。与低剂量合欢花组比较,低剂量酸枣仁-合欢花组大鼠血清中ACTH水平明显降低(P < 0.05);与低剂量酸枣仁组比较,低剂量酸枣仁-合欢花组大鼠血清中ACTH水平差异无统计学意义(P>0.05)。与模型组比较,低和高剂量酸枣仁-合欢花组、高剂量酸枣仁组及高剂量合欢花组大鼠血清中CORT水平明显降低(P < 0.05或P < 0.01),低剂量酸枣仁组和低剂量合欢花组大鼠血清中CORT水平差异无统计学意义(P>0.05)。与高剂量酸枣仁组和高剂量合欢花组比较,高剂量酸枣仁-合欢花组大鼠血清中CORT水平明显降低(P < 0.01);与低剂量酸枣仁组和低剂量合欢花组比较,低剂量酸枣仁-合欢花组大鼠血清中CORT明显降低(P < 0.05)。见表 3。
| [n=10, x±s,ρB/(ng·L-1)] | |||
| Group | CHR | ACTH | CORT |
| Blank | 32.45±2.62 | 41.81±7.23 | 47.26±7.41 |
| Model | 42.98±2.57* | 69.72±8.93** | 81.05±9.44** |
| SDS | |||
| Low dose | 39.23±2.46 | 61.45±8.11△ | 79.21±8.46 |
| High dose | 37.10±2.31△ | 60.58±9.01△ | 71.03±8.42△ |
| AJF | |||
| Low dose | 39.75±2.71 | 67.89±8.46 | 78.89±9.57 |
| High dose | 38.92±2.67△ | 60.27±8.33△ | 70.53±9.01△ |
| SDS-AJF | |||
| Low dose | 36.86±2.75△○ | 56.86±8.75△△ | 68.06±9.82△△○▲ |
| High dose | 34.19±2.21△△##□□ | 49.54±9.13△△#□ | 57.38±10.16△△##□□ |
| * P < 0.05,* * P < 0.01 compared with blank control group;△ P < 0.05,△△ P < 0.01 compared with model group;# P < 0.05,## P < 0.01 compared with high dose of SDS group;○ P < 0.05 compared with low dose of AJF group; □ P < 0.05,□□ P < 0.01 compared with high dose of AJF group;▲ P < 0.05 compared with low dose of SDS group.SDS:Spina date seed; AJF:Albizzia julibrissin flower. | |||
与空白组比较,模型组大鼠血清中IL-1β和IL-6水平明显升高(P < 0.01)。与模型组比较,低和高剂量酸枣仁-合欢花组及高剂量酸枣仁组大鼠血清中IL-1β水平明显降低(P < 0.05或P < 0.01);低剂量酸枣仁组和低、高剂量合欢花组大鼠血清中IL-1β水平差异无统计学意义(P>0.05)。与高剂量酸枣仁-合欢花组比较,高剂量酸枣仁组和高剂量合欢花组大鼠血清中IL-1β水平均明显升高(P < 0.01);与低剂量酸枣仁-合欢花组比较,低剂量酸枣仁组和低剂量合欢花组大鼠血清中IL-1β水平均明显升高(P < 0.01)。
与模型组比较,低和高剂量酸枣仁-合欢花组、高剂量酸枣仁组及高剂量合欢花组大鼠血清中IL-6水平明显降低(P < 0.05或P < 0.01);低剂量酸枣仁组和低剂量合欢花组大鼠血清中IL-6水平差异无统计学意义(P>0.05)。与高剂量酸枣仁-合欢花组比较,高剂量酸枣仁组和高剂量合欢花组大鼠血清中IL-6水平均明显升高(P < 0.01)。与低剂量酸枣仁-合欢花组比较,低剂量酸枣仁组和低剂量合欢花组大鼠血清中IL-6水平均明显升高(P < 0.05)。见表 4。
| [n=10, x±s,ρB/(ng·L-1)] | ||
| Group | IL-1β | IL-6 |
| Blank | 17.36±4.67 | 48.55±6.24 |
| Model | 42.92±7.31* | 82.37±8.77* |
| SDS | ||
| Low dose | 39.47±7.38 | 78.51±8.09 |
| High dose | 34.99±6.47△ | 73.24±8.49△ |
| AJF | ||
| Low dose | 40.55±6.95 | 79.13±9.01 |
| High dose | 38.51±7.29 | 72.18±8.22△ |
| SDS-AJF | ||
| Low dose | 30.92±6.33△△○▲ | 69.11±7.53△△○○▲▲ |
| High dose | 26.68±5.74△△#□ | 58.72±8.35△△#□ |
| * P < 0.01 compared with blank control group;△ P < 0.05,△△ P < 0.01 compared with model group # P < 0.01 compared with high dose of SDS group;○ P < 0.05,○○ P < 0.01 compared with low dose of AJF group;□ P < 0.01 compared with high dose of AJF group;▲ P < 0.05,▲▲ P < 0.01 compared with low dose of SDS group. | ||
空白组大鼠海马神经细胞排列紧密、细胞层次多;模型组大鼠海马神经细胞排列松散,细胞粉染明显,可见大量神经细胞变性、细胞层次减少;低剂量酸枣仁-合欢花组大鼠海马可见少量神经细胞变性;高剂量酸枣仁-合欢花组大鼠海马偶见神经细胞变性;低和高剂量酸枣仁组大鼠海马神经细胞变性略多见,细胞排列较为松散;低和高剂量合欢花组大鼠海马神经细胞变性较多见、细胞层次减少,细胞排列松散。见图 1(插页三)。
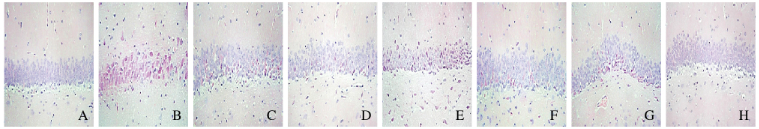
|
| A: Blank group; B: Model group; C: Low dose of SDS group; D: High dose of SDS group; E: Low dose of AJF group; F: High dose of AJF group; G: Low dose of SDS AJF group; H:High dose of SDS AJF group. 图 1 各组大鼠海马细胞形态表现(HE, ×200) Fig. 1 Morphology of hippocampus cells of rats in various groups(HE, ×200) |
|
|
焦虑性抑郁症是一种临床常见的精神系统疾病,相对于无焦虑障碍共病的抑郁症,其病情更为复杂。我国传统医学中的郁证、郁病相当于现代医学中的抑郁症,明代医学家张介宾对郁证进行了分类,即“怒郁”“思郁”和“忧郁”3种类型,其中因“过度思虑”所致的“思郁”,可能是传统医学中最早提及的“焦虑性抑郁障碍”概念[13]。酸枣仁具有养心、安神、补肝、敛汗和生津的功能,临床中常作为组方使用,通过不同的配伍治疗抑郁症,研究[14]表明酸枣仁中有效成分具有抗抑郁的药理活性。合欢花具有解郁、安神、和络和理气等功效,研究[15]显示:合欢花有抗抑郁功效,并且提示其抗抑郁成分可能是黄酮类物质。酸枣仁与合欢花二者合用,有舒肝解郁,宁心安神之效。临床应用酸枣仁与合欢花药对治疗中度抑郁症的疗效与盐酸文拉法辛缓释片相当,且不良反应明显少于西药[16]。
采用应激束缚联合CORT皮下注射的方法可复制焦虑性抑郁症大鼠模型,该造模方法可行性强且成功率较高[17]。本研究结果显示:与空白组比较,模型组大鼠OE%和OT%明显降低,呈现典型的焦虑样行为;模型组大鼠强迫游泳静止时间明显增加,抑郁样行为明显;综合行为学结果说明焦虑性抑郁大鼠模型造模成功。
研究[18]显示:焦虑性抑郁状态模型大鼠HPA轴处于亢进状态,HPA轴异常状态下,HPA轴能促进肾上腺分泌糖皮质激素(GC)的分泌,海马是糖皮质激素受体(GR)的高表达区,海马受到损伤则会导致情绪障碍。HPA轴功能紊乱是焦虑症与抑郁症的共同发病机制[19]。IL-1β和IL-6能够降低5-羟色胺(5-HT)的水平,引起焦虑性抑郁症的发生[20-21]。本研究结果显示:造模成功后,大鼠血清中HPA轴相关指标和炎症因子水平明显升高,表明大鼠的焦虑性抑郁状态与HPA轴紊乱和炎症因子有关。
本研究结果显示:与模型组比较,低和高剂量酸枣仁-合欢花组大鼠强迫游泳实验静止时间明显缩短,血清中HPA轴相关指标和炎症因子水平明显降低;与模型组比较,低、高剂量酸枣仁组和低、高剂量合欢花组大鼠强迫游泳静止时间缩短或有缩短趋势,血清中HPA轴相关指标和炎症因子水平也有降低或有降低趋势。酸枣仁与合欢花配伍使用对于降低HPA轴相关指标和炎症因子水平明显优于单用酸枣仁或合欢花。
综上所述,酸枣仁和合欢花提取物配伍应用可改善焦虑性抑郁症大鼠的焦虑性抑郁行为,降低大鼠血清中CORT、ACTH、CRH、IL-1β和IL-6水平,改善HPA轴功能紊乱,降低炎症反应,从而发挥抗焦虑性抑郁的功效。酸枣仁与合欢花配伍应用作用更佳,其可能通过药物间的多靶点协同作用,直接或间接发挥抗焦虑性抑郁的作用。但焦虑性抑郁症发病机制较复杂,酸枣仁与合欢花配伍的有效成分和配伍比例仍需要进一步探讨,其抗焦虑性抑郁的作用机制有待深入研究。
| [1] | MENKE A, LEHRIEDER D, FIETZ J, et al. Childhood trauma dependent anxious depression sensitizes HPA axis function[J]. Psychoneuroendocrinology, 2018, 98: 22–29. DOI:10.1016/j.psyneuen.2018.07.025 |
| [2] | 吴志国, 吴彦, 方贻儒. 从"焦虑性抑郁症"概念解析抑郁障碍的复杂性[J]. 上海交通大学学报:医学版, 2014, 34(4): 450–454. |
| [3] | WANG S, WANG CH, YU ZX, et al. Agarwood essential oil ameliorates restrain stress-induced anxiety and depression by inhibiting HPA axis hyperactivity[J]. Int J Mol Sci, 2018, 19(11): 3468–3482. DOI:10.3390/ijms19113468 |
| [4] | 张翕婷, 王怡, 李霖, 等. 炎性因子与其他抑郁相关因素关系的研究现状[J]. 中国临床药理学杂志, 2018, 34(21): 2568–2571. |
| [5] | 杜青.百合疏肝安神汤对焦虑性抑郁症模型大鼠前额叶皮层-边缘(海马、杏仁核)神经损伤的影响[D].长沙: 湖南中医药大学, 2017. |
| [6] | 施学丽, 郭超峰, 蒋春雷, 等. 对药酸枣仁-合欢花对抑郁患者认知功能及血清BDNF水平的影响[J]. 世界科学技术-中医药现代化, 2013, 15(7): 1604–1607. |
| [7] | 施学丽, 郭超峰, 范丽丽. 对药酸枣仁-合欢花对老年抑郁症患者生活质量的影响[J]. 世界科学技术-中医药现代化, 2013, 15(9): 1933–1936. |
| [8] | 施学丽, 夏猛, 冯秋瑜, 等. 对药酸枣仁-合欢花对抑郁患者生活质量及神经-内分泌-免疫网络的影响[J]. 时珍国医国药, 2016, 27(10): 2348–2350. |
| [9] | 赵洪庆.焦虑性抑郁动物模型及其多层次评价体系的建立[D].长沙: 湖南中医药大学, 2017. |
| [10] | LI H Y, ZHAO Y H, ZENG M J, et al. Saikosaponin D relieves unpredictable chronic mild stress induced depressive-like behavior in rats:involvement of HPA axis and hippocampal neurogenesis[J]. Psychopharmacology(Berl), 2017, 234(22): 3385–3394. DOI:10.1007/s00213-017-4720-8 |
| [11] | 马向锋, 唐启盛, 赵瑞珍. 丹栀逍遥散对焦虑模型大鼠相关脑区形态结构变化的干预作用[J]. 北京中医药大学学报, 2015, 38(5): 327–331, 338. DOI:10.3969/j.issn.1006-2157.2015.05.009 |
| [12] | 吴九如.熟眠方对失眠模型大鼠IL-1β、PGD2和GABA表达的影响[D].长青: 长春中医药大学, 2014. |
| [13] | 吴志国.焦虑性抑郁障碍临床特征及治疗结局研究[D].上海: 上海交通大学, 2015. |
| [14] | 黄世敬. 酸枣仁治疗抑郁症的研究与应用[J]. 环球中医药, 2013, 6(9): 700–703. DOI:10.3969/j.issn.1674-1749.2013.09.021 |
| [15] | 郭超峰, 夏猛, 银胜高, 等. 合欢花总黄酮的抗抑郁作用及其机制研究[J]. 中国实验方剂学杂志, 2013, 19(13): 225–228. |
| [16] | 施学丽, 张永全, 蒋春雷. 对药酸枣仁-合欢花治疗抑郁症的临床研究[J]. 广西中医药, 2016, 39(3): 21–23. |
| [17] | 赵洪庆, 韩远山, 柳卓, 等. 焦虑性抑郁模型大鼠脑区单胺递质含量与神经因子表达的变化[J]. 中国实验动物学报, 2017, 25(4): 373–379. DOI:10.3969/j.issn.1005-4847.2017.04.006 |
| [18] | 凌佳, 吴梦瑶, 杨琴, 等. 下丘脑-垂体-肾上腺轴紊乱对焦虑性抑郁模型大鼠海马结构的影响[J]. 基础医学与临床, 2018, 38(9): 1231–1238. DOI:10.3969/j.issn.1001-6325.2018.09.004 |
| [19] | CHEN J, WANG Z Z, CHEN N H, et al. Effects of chronic mild stress on behavioral and neurobiological parameter-Role of glucocorticoid[J]. Hormones Behavior, 2016, 78: 150–159. DOI:10.1016/j.yhbeh.2015.11.006 |
| [20] | 吴伟, 林传行, 陈书丽. 慢性失眠伴焦虑抑郁患者血清炎症相关标志物研究进展[J]. 医学与哲学(B), 2017, 38(5): 18–21. |
| [21] | 刘椰, 姜依凡, 刘鑫, 等. 背侧海马齿状回5-HT_(1A)受体在帕金森病大鼠焦虑行为中的作用[J]. 西安交通大学学报:医学版, 2017, 38(3): 402–409. |
 2019, Vol. 45
2019, Vol. 45


