扩展功能
文章信息
- 陈曦, 柏林, 王映映, 曹爽, 穆宏平, 王翊霖, 石浩, 张倩, 高鑫, 张成义, 张若文
- CHEN Xi, BAI Lin, WANG Yingying, CAO Shuang, MU Hongping, WANG Yilin, SHI Hao, ZHANG Qian, GAO Xin, ZHANG Chengyi, ZHANG Ruowen
- 丹参酮ⅡA对人肝癌HepG2细胞增殖和迁移的抑制作用及促凋亡作用
- Inhibitory effect of tanshinone ⅡA on proliferation and migration of human liver cancer HepG2 cells and its apoptosis-promoting effect
- 吉林大学学报(医学版), 2019, 45(03): 531-538
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 531-538
- 10.13481/j.1671-587x.20190311
-
文章历史
- 收稿日期: 2018-12-27
2. 北华大学药学院药理教研室, 吉林 吉林 132011
2. Department of Pharmacology, College of Pharmacy, Beihua University, Jilin 132011, China
肝细胞癌(hepatic cell carcinoma, HCC)是肝脏最常见的原发性恶性肿瘤,是慢性肝病的一种典型并发症,其病因及确切分子机制尚未完全清楚。HCC是全球第5位最常见的肿瘤,每年新增病例超过70万例[1-2]。近年来,生物疗法或生物反应修饰疗法(主要包括免疫疗法)已成为继手术、放疗和化疗之后肿瘤治疗的第4种疗法[3]。目前,由于化疗耐药和不良反应,大多数治疗性抗HCC药物疗效不佳,因此,寻找新的更有效的抗HCC药物势在必行。丹参是我国常用中药,具有活血化瘀和抗肿瘤功效,其主要化学成分为脂溶性的丹参酮类和水溶性的丹参酚酸类。目前国外研究[4]显示:丹参对人肝癌HepG2细胞有生长抑制和诱导凋亡的作用。从活血化瘀中药丹参中提取出来的脂溶性有效成分为丹参酮ⅡA(Tan ⅡA)[5]。关于TanⅡA对人肝癌HepG2细胞生长的抑制作用及对其迁移的影响国内外尚未见报道。本研究采用不同浓度TanⅡA作用于人肝癌HepG2细胞,探讨TanⅡA对人肝癌HepG2细胞的生长抑制、迁移作用和细胞凋亡的影响,为TanⅡA抗HCC的临床应用提供实验基础。
1 材料与方法 1.1 细胞株、主要试剂和仪器HepG2细胞株购于北京鼎国生物技术有限公司。二甲基亚砜(DMSO)和噻唑蓝(MTT)购于美国Sigma公司;Tan ⅡA购自中国食品药品检定研究院为国家药品化学标准物质,以DMSO溶解Tan ⅡA,配制成5 g·L-1储存液,将该储存液置于-20℃冰箱内,避光保存待用;抗生素、DMEM细胞培养液、胰蛋白酶和胎牛血清均购于中国碧云天生物试剂公司;β-actin单克隆抗体以及抗兔二抗均购自英国Abcam公司;GAPDH、兔抗人基质金属蛋白酶9(MMP-9)和核转录因子κB(NF-κB) p65购自美国Santa Cruz公司;高纯度总RNA快捷提取试剂盒和逆转录cDNA试剂盒均购于美国BioTake公司;细胞周期检测试剂盒和TUNEL检测试剂盒购于中国碧云天生物技术公司。Tocan全自动凝胶成像系统购于中国上海领成生物科技有限公司,梯度PCR仪(型号:ETC811)购于中国东胜兴业科学仪器有限公司,AE2000倒置显微镜(MOTICAE2000)和流式细胞仪购于美国Beckman Coulter公司,Bio-Rad550酶标仪购于美国Bio-Rad公司。
1.2 细胞培养采用含10%胎牛血清的DMEM完全培养液培养人肝癌HepG2细胞,并置于37℃、5%CO2培养箱中培养。
1.3 MTT法检测HepG2细胞增殖抑制率取对数生长期的HepG2细胞进行实验,每孔细胞密度为1.0×104 mL-1,接种于96孔细胞培养板,分为空白组和不同浓度Tan ⅡA组,复孔数为5,每孔接种200 μL,进行过夜培养。待细胞贴壁后,弃去培养液。空白组加入完全培养液继续培养24 h;不同浓度Tan ⅡA组加入终浓度为0.5、1.0、2.0、5.0和10.0 mg·L-1的Tan ⅡA完全培养液继续培养24 h,倒置显微镜下观察细胞生长状态。48 h后向每孔加入20 μL新配制的5 g·L-1MTT,轻轻摇匀,孵育4 h,弃去上清,每孔再加入200 μL DMSO,微振荡10 min,使其完全溶解,酶标仪检测波长490 nm处的吸光度(A)值并记录,计算细胞增殖抑制率。细胞增殖抑制率= (1-Tan ⅡA组A值/空白组A值)×100%。
1.4 倒置显微镜下观察各组HepG2细胞凋亡形态表观采用不同浓度Tan ⅡA处理细胞24 h后,倒置显微镜下观察各组HepG2细胞凋亡形态表观。
1.5 细胞划痕实验检测各组HepG2细胞迁移情况取灭活无菌直尺在无菌24孔板背面等距离划3条横线,以便标记和检测。收集对数生长期的HepG2细胞,将浓度为3.5 × 105 mL-1HepG2细胞接种于24孔培养板中,每孔100 μL,过夜培养。倒置显微镜下观察细胞,待80%细胞融合时,弃去培养液,更换为含2%血清的DMEM培养液,继续培养24 h饥饿细胞。待细胞单层贴壁长满时,在每孔单层细胞上采用20 μL加样枪头垂直于3条横线划痕,形成划痕模型。划痕后采用PBS冲洗3次,分为空白组和不同浓度Tan ⅡA组,每组设置2个复孔。24孔板分别加入100 μL含2%血清的DMEM,不同浓度Tan ⅡA组再加入终浓度为1.0、2.0和5.0 mg·L-1的Tan ⅡA,继续培养24 h,并于0和24 h 2个时间点于倒置显微镜下观察划痕愈合程度。分别计数实验组和空白组在0和24 h时间点越过划痕边界的细胞数,并进行比对,从而反映细胞的平面迁移能力。以上实验至少重复3次。
1.6 RT-PCR法检测各组HepG2细胞中NF-κB和MMP-9 mRNA表达水平提取细胞中总RNA,培养不同浓度Tan ⅡA作用下的细胞,0.25%胰蛋白酶消化贴壁细胞,收集细胞,并于1 000 r·min-1离心5 min,弃去上清液,采用PBS洗涤2次;在1.5 mLEP管中离心沉淀,去除上清液;加入50 μL细胞裂解液,混匀,按照试剂盒说明书提取总RNA;采用逆转录酶试剂盒逆转录cDNA;PCR扩增已逆转录的cDNA为模板,在94℃、5 min的条件下进行初始变性,经过35个循环,94℃、1 min变性,55℃、1 min退火和72℃、1 min延伸过程,最后72℃、7 min充分延伸;120 V、30 min电泳。PCR引物序列见表 1。
| Primer | Sequence (5′-3′) | Fragment length (bp) |
| MMP-9 | Forward: CCTGGAGACCTGAGAACCAATC Reverse: CCACCCGAGTGTAACCATAGC | 21 |
| NF-κB | Forward: AGTGTGGAGGCTGCCTTGCGAAT Reverse: TGGGCTTTCAAGACTGGAACGGTC | 269 |
| β-actin | Forward: TGCTATGTTGCCCTAGACTTCG Reverse: GTTGGCATAGAGGTCTTTACGG | 240 |
培养24 h后,检测空白组和不同浓度Tan ⅡA组HepG2细胞的细胞周期,收集细胞培养液于离心管中备用。采用0.25%胰蛋白酶消化细胞,转移到备用的离心管中,1 000 r·min-1离心5 min,去除上清,加入1 mL冰浴预冷的PBS,重悬细胞,再次离心,去除上清,轻轻弹击离心管,分散细胞避免细胞成团;固定细胞。采用1 mL冰浴预冷的70%乙醇,混匀,过夜固定。1 000 r·min-1离心5 min,去除上清,加入1 mL冰浴预冷的PBS重悬细胞,再次离心,去除上清,轻轻弹击离心管,避免细胞成团;用每管样品中加入0.5 mL碘化丙啶染色液,4℃冰浴避光保存;采用流式细胞术检测各组不同细胞周期HepG2细胞百分比,进行分析。
1.8 TUNEL法检测各组HepG2细胞凋亡率将HepG2细胞悬浮培养于含10%胎牛血清的DMEM培养液中,按每孔终浓度为2 × 105mL-1接种于24孔培养板,37℃、5% CO2培养24 h后,不同浓度Tan ⅡA组HepG2细胞给药终浓度分别为0.5、1.0、2.0、5.0和10.0 mg· L-1,37℃、5% CO2继续培养24 h。24 h后各组HepG2细胞取上清液,1 500 r·min-1离心12 min。按TUNEL检测试剂盒说明书操作。任选一个视野进行凋亡细胞计数,计算HepG2细胞凋亡率。HepG2细胞凋亡率=凋亡HepG2细胞数/HepG2细胞总数×100%。
1.9 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组HepG2细胞增殖抑制率、HepG2细胞中NF-κB和MMP-9 mRNA表达水平、不同细胞周期HepG2细胞百分比和HepG2细胞凋亡率均以x±s表示,多组间样本均数比较采用单因素方差分析,组内两两比较采用LSD法。以P < 0.05为差异有统计学意义。
2 结果 2.1 倒置显微镜下HepG2细胞形态表观倒置显微镜下可见空白组HepG2细胞生长状态良好,细胞间连接紧密;1.0和2.0 mg·L-1Tan ⅡA组HepG2细胞体积缩小、连接疏散,间隙变大,细胞核固缩并碎裂,与周围细胞脱离,生长状态差,呈剂量依赖性。见图 1。

|
| A: Blank group; B: 1.0 mg·L-1 Tan ⅡA group; C: 2.0 mg·L-1 Tan ⅡA group. 图 1 倒置显微镜下各组HepG2细胞形态表观(×400) Fig. 1 Morphology of HepG2 cells in various groups under inverted microscope (×400) |
|
|
加入Tan ⅡA后,A值降低,细胞活性降低,细胞增殖抑制率升高。随着Tan ⅡA浓度的增加,细胞增殖抑制率也相应增加,1.0、2.0和10.0 mg·L-1Tan ⅡA组HepG2细胞增殖抑制率与空白组比较差异有统计学意义(P < 0.01)。见图 2。
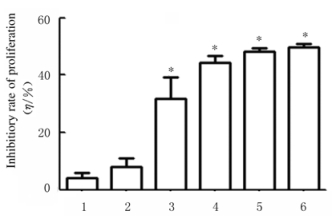
|
| 1:Blank group; 2:0.5mg·L-1 Tan ⅡA group; 3:1.0 mg·L-1 Tan ⅡA group; 4:2.0 mg·L-1 Tan ⅡA group; 5:5.0mg·L-1 Tan ⅡA group; 6:10.0mg·L-1 Tan ⅡA group. *P < 0.05 vs blank group. 图 2 各组HepG2细胞增殖抑制率 Fig. 2 Inhibitiory rate of proliferation of HepG2 cells in various groups |
|
|
空白组人肝癌HepG2细胞培养24 h后向划痕边缘铺展,距离明显变小。Tan ⅡA组细胞向划痕边缘迁移的速度明显降低,划痕缺损处修复减慢。随着Tan ⅡA浓度升高,2.0和5.0mg·L-1Tan ⅡA组HepG2细胞迁移的速度降低。见图 3。

|
| A-D:0 h; E-H:24 h; A, E:Blank group; B, F:1.0 mg·L-1 Tan ⅡA group; C, G:2.0 mg·L-1 Tan ⅡA group; D, H:5.0 mg·L-1 Tan ⅡA group. 图 3 细胞划痕实验检测各组HepG2细胞迁移情况(×200) Fig. 3 Migration of HepG2 cells in various groups detected by cell scratch test (×200) |
|
|
与0.5mg·L-1Tan ⅡA组比较,1.0、2.0和5.0mg·L-1Tan ⅡA组HepG2细胞中MMP-9和NF-κB mRNA表达水平明显降低(P < 0.05或P < 0.01),且随着Tan ⅡA浓度升高呈现一定剂量依赖性。见图 4和5。
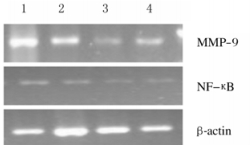
|
| Lane 1:0.5 mg·L-1 Tan ⅡA group; Lane 2:1.0 mg·L-1 Tan ⅡA group; Lane 3:2.0 mg·L-1 Tan ⅡA group; Lane 4:5.0 mg·L-1 Tan ⅡA group. 图 4 各组HepG2细胞中NF-κB和MMP-9 mRNA表达电泳图 Fig. 4 Electrophoregram of expressions of NF-κB and MMP-9 mRNA in HepG2 cells in various groups |
|
|
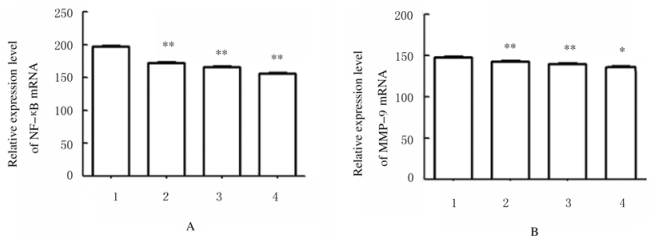
|
| *P < 0.05, **P < 0.01 vs 0.5 mg·L-1 Tan ⅡA group.1:0.5 mg·L-1 Tan ⅡA group; 2:1.0 mg·L-1 Tan ⅡA group; 3:2.0 mg·L-1 Tan ⅡA group; 4:5.0 mg·L-1 Tan ⅡA group. 图 5 RT-PCR法检测各组HepG2细胞中NF-κB(A)和MMP-9(B) mRNA表达水平 Fig. 5 Expression levels of NF-κB(A) and MMP-9(B) mRNA in HepG2 cells in various groups detected by RT-PCR method |
|
|
HepG2细胞经不同浓度TanⅡA作用48 h后,与空白组比较,不同浓度1.0、2.0和5.0和10.0mg·L-1Tan ⅡA组S期HepG2细胞百分比降低(P < 0.05),G0/G1期和G2期HepG2细胞百分比升高(P < 0.05)。见图 6和7。

|
| A:Blank group; B:0.5 mg·L-1 Tan ⅡA group; C:1.0 mg·L-1 Tan ⅡA group; D:2.0 mg·L-1 Tan ⅡA group; E:5.0 mg·L-1 Tan ⅡA group; F:10.0 mg·L-1 Tan ⅡA group. 图 6 流式细胞术检测各组HepG2细胞的细胞周期 Fig. 6 Cell cycles of HepG2 cells in various groups detected by flow cytrometry |
|
|
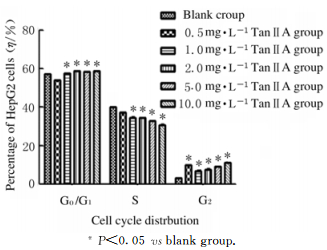
|
| *P < 0.05 vs blank group. 图 7 各组不同细胞周期HepG2细胞百分比 Fig. 7 Percentages of HepG2 cellsin different cell cycles in various groups |
|
|
与空白组比较,不同浓度Tan ⅡA组HepG2细胞凋亡率明显升高(P < 0.05或P < 0.01)。当Tan ⅡA浓度达到10.0 mg·L-1时,HepG2细胞凋亡率最高,见表 2。200倍荧光显微镜下各组细胞形态表现见图 8(插页三)。
| (n=7, x±s, η/%) | |
| Group | Apoptotic rate |
| Blank | 5.89±0.53 |
| Tan ⅡA(mg·L-1) | |
| 0.5 | 8.89±0.11* |
| 1.0 | 10.89±0.21* |
| 2.0 | 17.89±0.13** |
| 5.0 | 23.10±0.41** |
| 10.0 | 25.29±0.33** |
| * P < 0.05, * * P<0.01 compared with blank group. | |

|
| A: Blank group; B-F:0.5, 1. 0, 2.0, 5.0 mg·L-1, and 10.0 mg·L-1Tan ⅡA groups. 图 8 TUNEL法检测各组HepG2细胞凋亡形态表现(×200) Fig. 8 Apoptotic morphology of HepG2 cells in various groups detected by TUNEL method (×200) |
|
|
HCC是死亡率高居第2位的恶性肿瘤,中国是每年HCC新增病例最多的国家[6-13]。因此,寻找有效的抗肿瘤药物已成为科研工作者的重要任务之一。细胞增殖和凋亡之间的平衡失调可诱发肿瘤的形成;采用一种有效的治疗肿瘤的途径和方法,可能会诱导肿瘤细胞凋亡。因此,某些抗肿瘤药物作用的强弱与其诱导肿瘤细胞凋亡的活性成正比[5]。
本研究结果表明:不同浓度Tan ⅡA能使HepG2细胞形态发生变化、细胞皱缩和连接消失,与周围细胞发生脱离。在一定细胞数范围内, 波长490 nm处采用酶标仪测定A值,可判断其活细胞数量。酶标仪测定的A值越大,代表细胞活性越强[6]。本研究MTT实验结果显示:不同浓度Tan ⅡA均可明显抑制HepG2细胞增殖,并呈现一定的剂量依赖关系;细胞划痕实验结果显示:Tan ⅡA作用HepG2细胞后,HepG2细胞的运动和迁移抑制能力明显降低。恶性肿瘤的基本特征之一是侵袭和转移,癌细胞侵袭的始动条件则是黏附[7-12]。肿瘤转移是肿瘤研究领域的瓶颈,癌症患者死于肿瘤转移者超过90%[8]。
肿瘤通过多种蛋白水解酶,如基质金属蛋白酶(MMP)和尿激酶型纤溶酶原激活物等降解细胞外基质,从而使原位癌到局部侵袭及远处转移的演变过程中Ⅳ型胶原组成细胞外基质的基本骨架能够被明胶酶(MMP-2和MMP-9)降解。本研究结果显示:Tan ⅡA可抑制MMP-9 mRNA表达,且呈剂量依赖性。
NF-κB是一种转录因子,在正常情况下和适应性免疫反应的协调中起重要和决定性的作用,调节许多细胞介质的表达。研究[14-15]显示:肝癌的进展伴随着NF-κB的激活。本研究结果显示:Tan ⅡA可抑制NF-κBmRNA表达,且呈剂量依赖性。
影响肿瘤的侵袭和转移因素有很多,其中一些分子与信号通路发挥重要作用。MMP可以通过降解细胞外基质及内皮细胞基底膜中的蛋白,参与肿瘤细胞的转移与侵袭过程[9-19]。MMP是反映肿瘤转移变化的敏感指标,其中MMP-9具有明胶活性,在HCC的发生发展中起关键性作用[9-17]。NF-κB为抗凋亡因子,其激活与肿瘤的侵袭生物特性有关,并且NF-κB活化炎性因子、MMP和黏附分子等水平影响许多肿瘤的浸润和转移。研究[10-18]显示:HCC的浸润和转移行为与NF-κB激活MMP-9表达有关。本研究结果表明:不同浓度Tan ⅡA作用HepG2细胞后,细胞中NF-κB和MMP-9 mRNA表达水平呈现降低趋势,并呈剂量依赖性,表明Tan ⅡA可抑制HepG2细胞的迁移与转移,其诱发细胞凋亡可能与抑制NF-κB和MMP-9 mRNA表达有关。
Tan ⅡA是丹参重要的脂溶性成分之一,在白血病、肝癌和肺癌等的治疗中已得到广泛应用[11-16]。本研究结果显示:不同浓度Tan ⅡA均能影响细胞周期,作用于人肝癌HepG2细胞24 h后,S期HepG2细胞百分比降低,表明Tan ⅡA可以将人肝癌HepG2细胞阻滞在G1期,使进入S期的细胞减少,从而HepG2细胞在早期发生凋亡,抑制细胞增殖;Tan ⅡA浓度越高,G1期阻滞越明显。Tan ⅡA的化学结构中含有菲醌结构,由于其菲环可与DNA结合以及其呋喃环和醌类结构可产生自由基、引起DNA的损伤和肿瘤细胞DNA的合成受到抑制,从而使Tan ⅡA作用后S期细胞百分比降低,G0/G1期细胞百分比升高[20]。
综上所述,Tan ⅡA能够抑制人肝癌HepG2细胞发生迁移和转移,诱发细胞凋亡,Tan ⅡA对MMP-9表达的抑制作用可能是通过下调NF-κB mRNA表达来实现的,但其具体作用机制仍需要进一步探索。
| [1] | PACHE I, BIZE P, HALKIC N, et al. Management of hepatocellular carcinoma[J]. Rev Med Suisse, 2010, 6(233): 198–202. |
| [2] | 沈隽, 王照艳, 张晓, 等. 丹参酮ⅡA对HeLa宫颈癌细胞凋亡的影响[J]. 中国药房, 2007, 18(27): 2102–2104. DOI:10.3969/j.issn.1001-0408.2007.27.009 |
| [3] | 钟志宏, 陈文贵, 柳永和, 等. 丹参酮ⅡA抑制HepG2细胞生长及诱导其凋亡的实验研究[J]. 中南大学学报, 2007, 32(1): 99–103. DOI:10.3321/j.issn:1672-7347.2007.01.017 |
| [4] | LIU J, SHEN H M, ONG C N. Salvia mitiorrh izainhibits growth and induces apoption in human hepatoma HepG2 cells[J]. Cancer Lett, 2000, 153(1/2): 85–93. |
| [5] | 陈竹, 李小峰, 杨兆文, 等. 丹参酮ⅡA对Hela细胞增殖和细胞周期的影响[J]. 中国药物与临床, 2008, 8(7): 539–542. DOI:10.3969/j.issn.1671-2560.2008.07.010 |
| [6] | 袁婉雯, 杨玲, 叶名冠, 等.青藤碱抑制人肝癌细胞HepG2作用的研究[J/OL].广东药科大学学报, 2018: 1-4[2018-10-27]. https: //doi.org/10.16809/j.cnki.2096-3653.2018061503. |
| [7] | ZHANG Y, HE X, LIU Y, et al. microRNA-320a inhibits tumor invasion by targeting neuropilin 1 and, is associated with liver metastasis in colorectal cancer[J]. Oncol Rep, 2015, 27(3): 685–694. |
| [8] | 喻丽珍, 年四辉, 李丽华, 等. 芒果苷对HepG2细胞侵袭及转移的抑制作用及机制研究[J]. 通化师范学院学报, 2018, 39(8): 19–23. |
| [9] | 伍天影, 刘震, 李志强, 等. 甲基纳曲酮对肝癌HepG2细胞体内外增殖及体外迁移能力的影响[J]. 广西医学, 2018, 40(11): 1228–1230, 1234. |
| [10] | 张克君, 李德春, 高焱明, 等. NF-κB、MMP-9与肝细胞肝癌浸润转移的实验研究[J]. 中华肝胆外科杂志, 2006, 12(10): 691–695. DOI:10.3760/cma.j.issn.1007-8118.2006.10.013 |
| [11] | 陈阳, 赵秋宇, 宋囡, 等. 丹参酮ⅡA诱导人肝癌HepG2细胞凋亡的机制[J]. 中国老年学杂志, 2015, 35(5): 1312–1315. DOI:10.3969/j.issn.1005-9202.2015.05.076 |
| [12] | 赵行宇, 侯建成, 金连海, 等. 胡桃醌对人宫颈癌HeLa细胞侵袭与迁移的影响[J]. 解剖学报, 2017, 48(2): 160–164. |
| [13] | LIU JS, WEI XD, WU YF, et al. Giganteaside D induces ROS-mediated apoptosis in human hepatocellular carcinoma cells through the MAPK pathway[J]. Cell Oncol(Dordr), 2016, 39(4): 333–342. DOI:10.1007/s13402-016-0273-9 |
| [14] | KRETZMANN N A, CHIELA E, MATTE U, et al. N-acetylcysteine improves antitumoural response of interferon alpha by NF-κB downregulation in liver cancer cells[J]. Comp Hepatol, 2012, 11(1): 4. DOI:10.1186/1476-5926-11-4 |
| [15] | 杨涛, 贺小军, 谭凯, 等. 肝癌组织中HIF-1α、VEGF表达水平及临床意义[J]. 肝胆外科杂志, 2017, 25(6): 467–470. DOI:10.3969/j.issn.1006-4761.2017.06.021 |
| [16] | 邓敬桓, 卢国栋. 脂代谢在肝癌发生发展过程中作用机制的探讨[J]. 医学争鸣, 2017, 8(6): 38–42. |
| [17] | 徐玉峰.姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素对人肝癌细胞HepG2中MMP-2、MMP-9蛋白表达的影响[D].石家庄: 河北医科大学, 2014. |
| [18] | 李晓光. 肝癌消融联合靶向药物治疗[J]. 肝癌电子杂志, 2017, 4(4): 21–26. DOI:10.3969/j.issn.2095-7815.2017.04.009 |
| [19] | 盛庆寿, 古训东, 许峰铭. 中医药防治原发性肝癌的表观遗传学研究进展[J]. 中西医结合肝病杂志, 2017, 27(6): 382–384. |
| [20] | 刘佳维, 石秀梅, 于凤波, 等. 黒参粗多糖抑制人胃和肝癌细胞增殖作用的研究[J]. 实验室科学, 2017, 20(6): 29–30, 34. DOI:10.3969/j.issn.1672-4305.2017.06.009 |
 2019, Vol. 45
2019, Vol. 45


