扩展功能
文章信息
- 邵春燕, 付文亮, Md Zuki Bin Abu Bakar ZAKARIA
- SHAO Chunyan, FU Wenliang, Md Zuki Bin Abu Bakar ZAKARIA
- 海扇壳源性碳酸钙纳米微粒对大鼠的急性毒性作用
- Acute toxicity of cockle shell-derived calcium carbonate nanoparticles on rats
- 吉林大学学报(医学版), 2019, 45(03): 524-530
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 524-530
- 10.13481/j.1671-587x.20190310
-
文章历史
- 收稿日期: 2018-07-18
2. 承德医学院人体解剖学教研室, 河北 承德 067000;
3. 博特拉大学兽医学院解剖教研室, 雪兰莪州 沙登 43400
2. Department of Human Anatomy, Chengde Medical University, Chengde 067000, China;
3. Department of Anatomy, School of Veterinary Medicine, Putra University, Serdang 43400, Malaysia
近几十年来,纳米微粒在抗癌药物载药体系中的应用受到了广泛的关注。纳米载药体系较传统的抗癌药物具有更高的肿瘤微环境靶向选择性和更强的肿瘤组织聚集作用[1]。与其他载药体系比较,生物源性碳酸钙纳米微粒(calcium carbonate nanoparticles, CCNPs)具有良好的生物相容性、生物降解性和pH敏感性[2],展现了其作为载药体系的强大潜力。海扇贝由纯文石型碳酸钙组成[3],本课题组前期研究[4]已经成功采用海扇壳制备CCNPs,并将其作为抗癌药物阿霉素的载药体系,经阿霉素装载的CCNPs可以有效地杀灭骨肉瘤细胞,对于肿瘤细胞的细胞毒性作用方面,其与游离的阿霉素效果类似。CCNPs的毒性试验可评价其作为药物载体的潜在应用价值。但是国内外尚无关于CCNPs的体内注射安全剂量的实验研究报道。目前,CCNPs的生物学效应尚未明确,大部分研究还局限于细胞实验水平。体外细胞实验无法获得体内细胞间作用,如纳米颗粒与炎症细胞之间的相互作用等。从体外细胞实验获得的数据可能是片面的,无法准确地阐述纳米颗粒的生物学效应,因此,在体外实验中观察到的纳米颗粒生物学效应需要通过体内动物实验来验证[5]。本研究将首次探讨14 d重复剂量静脉注射海扇壳源性CCNPs对SD大鼠的急性毒性效应,为CCNPs在生物医学和药物应用中的安全性评价提供可靠的实验依据。
1 材料与方法 1.1 实验动物、药品、主要试剂和仪器5周龄清洁级雄性SD大鼠,体质量100~160 g,购自博特拉大学兽医学院动物资源部,动物许可证号:UPM/R027/2015,40只SD雄性大鼠用于14 d重复剂量毒性试验,动物实验于博特拉大学兽医学院动物中心进行,大鼠饲养于恒温(25℃±3℃)及恒湿(55%±5%)的环境中。海扇壳购自马来西亚当地市场。十二烷基二甲基胺乙内酯(dodecyl dimethyl betaine,BS-12)购自美国Sigma-Aldrich公司,血清生化学指标的临床化学试剂检测盒由马来西亚博特拉大学兽医学院血液学及临床生物化学实验室提供。全自动血细胞分析仪和全自动生化分析仪购自日本东芝公司。
1.2 CCNPs的制备首先将海扇壳彻底清洗去除杂质和泥沙。将海扇壳打碎研磨并用75 μm的试验筛过筛得到微米级的粉末。5 g微米级的粉末加入50 mL去离子水中搅拌,1 300 r·min-1、70℃离心1 h。1 mL BS-12加入到混悬液中,继续1 000 r·min-1室温搅拌110 min。制备的CCNPs经过滤收集并于70℃烘箱中干燥2 d,收集备用。在毒性试验开始前,将CCNPs粉末采用紫外线照射灭菌2 h,将CCNPs粉末加入到无菌生理盐水中,配成不同浓度CCNPs注射液。
1.3 CCNPs的表面形态表现和离子电位采用透射电子显微镜(TEM)测量CCNPs的形状和大小。采用扫描电子显微镜(SEM)观察CCNPs的表面形态表现。新制备的纳米微粒粉末采用去离子水稀释,采用电位分析仪测定其离子电位。
1.4 动物分组和给药40只SD大鼠随机分为对照组,低、中和高剂量CCNPs组,每组10只。各剂量CCNPs组大鼠以无菌生理盐水悬液尾静脉注射给药,每天1次,连续14 d。各剂量CCNPs组大鼠给药剂量为30、60和120 mg·kg-1。对照组大鼠每天给予等量的生理盐水尾静脉注射,连续14 d。
1.5 各组大鼠临床症状观察和体质量检测在14 d的治疗期间,每天观察大鼠的死亡率、临床症状(皮肤、皮毛、眼睛或自主活动的改变)、行为异常表现(步态和姿势的变化)和毒理学症状。每天记录大鼠的体质量和日平均进食量。
1.6 各组大鼠血液学指标检测在实验结束后,禁食大鼠在麻醉状态下进行心脏穿刺取血,采集血液样本。血液由抗凝真空采血管(K2-EDTA)收集并立即摇匀。在血液收集后2 h内,采用全自动血液分析仪分析各组大鼠血液学指标,包括红细胞(RBC)、白细胞(WBC)、血红蛋白(HGB)、血小板(PLT)、红细胞比容(PCV)、平均红细胞体积(MCV)、平均血红蛋白浓度(MCHC)、中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、中性杆状粒细胞和血浆蛋白质。
1.7 各组大鼠血清生化指标的检测血液样本由无抗凝的采血管采集。采血后待血液完全凝固,血液样本离心并采集血清。血清学指标均采用标准诊断试剂盒(Roche)经全自动生物化学分析仪测定。血清学指标包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)和肌酸激酶(CK)活性以及血清中肌酐和尿素水平。
1.8 各组大鼠器官相对质量测量在大鼠安乐死前测量每只大鼠的禁食体质量。取血后,经麻醉过量处死大鼠。迅速切除器官(肝、肾、脾、心和肺)。在取出器官5 min内,采用精密电子天平测定每个器官质量。器官相对质量=器官质量/体质量×100%。同时对大鼠的器官进行大体检查,以监测器官质量、质地和形状有无明显的变化。
1.9 HE染色检测各组大鼠组织病理形态表现将收集的器官标本切成小块,采用10%中性甲醛固定。修剪固定的样本,放置到塑料包埋盒中,使用病理自动脱水机进行脱水,然后进行石蜡包埋。切片厚度为5 μm。组织切片采用HE染色,在显微镜下观察并照相。
1.10 统计学分析采用SPSS 23.0统计软件进行统计学分析。各组大鼠体质量和进食量、血液及血清学指标、器官相对质量以x±s表示,多组间均数比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 CCNPs的表面形态表现和离子电位本实验制备的CCNPs为球形,直径为20~60 nm。SEM检测结果与TEM结果一致。TEM检测结果显示:CCNPs呈多孔样,多孔特性有助于通过物理吸附作用装载药物到纳米粒子。本研究中制备的CCNPs离子电位为-(46.17±3.82)mV。见图 1。
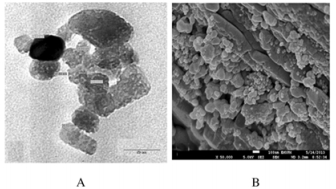
|
| 图 1 CCNPs的表面形态表现(×50 000) Fig. 1 Surface morphology of CCNPs (×50 000) |
|
|
实验结束时,高剂量CCNPs组中有2只大鼠死亡(存活率为66.67%),而在中和低剂量CCNPs组中均未发现大鼠死亡(存活率为100%)。实验期间,低剂量CCNPs组大鼠未出现呼吸困难、行动困难和弓背等毒性反应。在整个实验过程中,低剂量CCNPs组大鼠的临床症状与对照组无明显区别。中和高剂量CCNPs组一些大鼠出现的主要异常包括皮毛变得粗糙和大鼠活动度降低;不规则呼吸和严重嗜睡是中及高剂量CCNPs组大鼠死亡之前的主要临床症状。此外,各剂量CCNPs组大鼠均未见注射部位有局部损伤病变。
2.3 各组大鼠体质量和日平均进食量在整个实验进程中,各组大鼠体质量均平稳逐渐增加。实验结束时,各剂量CCNPs组大鼠体质量增加幅度低于对照组,但组间比较差异无统计学意义(P>0.05)。各剂量CCNPs组大鼠日平均进食量与对照组比较略低,但组间比较差异无统计学意义(P>0.05)。各剂量CCNPs组大鼠体质量和日平均进食量与对照组比较差异均无统计学意义(P>0.05),可见CCNPs(< 120 mg·kg-1)连续静脉注射14 d不会扰乱哺乳动物的正常代谢。见图 2。
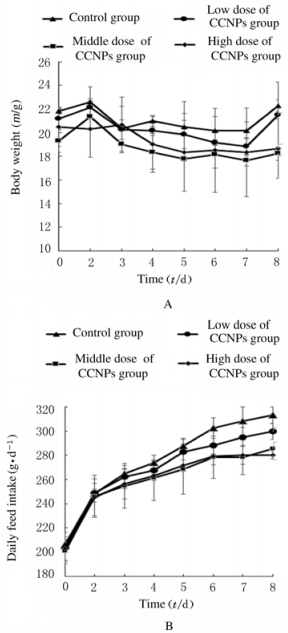
|
| 图 2 各组大鼠体质量(A)和日平均进食量(B) Fig. 2 Body weights (A) and daily feed intakes (B) of rats in various groups |
|
|
各剂量CCNPs组大鼠嗜酸性粒细胞和MCHC水平低于对照组(P < 0.05)。各剂量CCNPs组大鼠其他血液学指标与对照组比较差异均无统计学意义(P>0.05)。见表 1。
| (x±s) | ||||||||
| Group | n | RBC (×1012 L-1) |
HGB [ρB/(g·L-1)] |
PCV [φB/(L·L-1)] |
MCV (V/fL) |
MCHC [ρB/(g·L-1)] |
WBC (×109 L-1) |
PLT (×109 L-1) |
| Control | 10 | 7.39±0.23 | 143.67±2.08 | 0.44±0.02 | 59.00±4.00 | 329.33±10.26 | 11.63±2.03 | 671.67±122.40 |
| CCNPs | ||||||||
| Low dose | 10 | 7.29±0.59 | 138.33±9.00 | 0.43±0.03 | 58.50±2.59 | 329.50±10.15 | 13.84±2.21 | 736.5±44.55 |
| Middle dose | 10 | 7.43±0.54 | 140.00±8.92 | 0.45±0.32 | 60.17±1.60 | 313.00±4.00* | 11.81±2.39 | 727.00±136.09 |
| High dose | 8 | 7.67±0.41 | 151.25±7.63 | 0.45±0.17 | 62.50±3.70 | 311.75±5.50* | 10.04±0.30 | 727.75±84.92 |
| Group | n | Neutrophils (η/%) |
Lymphocytes (η/%) |
Monocytes (η/%) |
Eosinophils (η/%) |
Band neutrophils (η/%) |
Plasma protein [ρB/(g·L-1)] |
|
| Control | 10 | 2.19±0.92 | 8.26±0.79 | 0.80±0.42 | 0.23±0.04 | 0.28±0.12 | 66.67±6.43 | |
| CCNPs | ||||||||
| Low dose | 10 | 2.69±0.26 | 8.96±0.75 | 0.74±0.12 | 0.13±0.02* | 0.30±0.11 | 66.00±2.83 | |
| Middle dose | 10 | 2.21±0.53 | 8.22±1.08 | 0.79±0.10 | 0.14±0.05* | 0.20±0.87 | 70.60±3.58 | |
| High dose | 8 | 1.69±0.47 | 7.22±0.49 | 0.77±0.08 | 0.14±0.05* | 0.14±0.07 | 69.25±5.32 | |
| * P < 0.05 vs control group. | ||||||||
各剂量CCNPs组大鼠绝大部分血清生化指标处于正常范围,与对照组大鼠比较差异无统计学意义(P>0.05),只有ALP水平(P < 0.01)和尿素水平(P < 0.05)低于对照组。见表 2。
| (x±s) | |||||
| Group | n | Calcium [cB/(mmol·L-1)] | ALT[λB/(U·L-1)] | AST[λB/(U·L-1)] | ALP [λB/(U·L-1)] |
| Control | 10 | 4.12±0.36 | 70.57±3.61 | 176.65±2.47 | 525.00±6.24 |
| CCNPs | |||||
| Low dose | 10 | 3.47±0.86 | 66.97±5.66 | 168.34 ±25.70 | 339.50±67.30** |
| Middle dose | 10 | 3.87±0.75 | 66.88±8.33 | 193.73±40.13 | 321.17±48.68** |
| High dose | 8 | 3.33±0.55 | 64.97±11.39 | 167.93±13.39 | 255.33±57.50** |
| Group | n | CK [λB/(U·L-1)] | Urea [cB/(mmol·L-1)] | LDH [λB/(U·L-1)] | Creatinine[cB/(mmol·L-1)] |
| Control | 10 | 3503.33±1475.70 | 10.53±0.95 | 2580.00±158.39 | 76.00±3.46 |
| CCNPs | |||||
| Low dose | 10 | 3755.00±947.35 | 7.83±2.08* | 2409.80±120.36 | 75.20±14.31 |
| Middle dose | 10 | 4266.67±1060.50 | 8.15±1.76* | 2563.75±64.48 | 76.60±15.03 |
| High dose | 8 | 4552.00 ±914.72 | 6.50±0.89** | 2318.67±244.53 | 72.00±4.00 |
| * P < 0.05, * * P < 0.01 vs control group. | |||||
各剂量CCNPs组大鼠肺脏相对质量高于对照组(P < 0.05)。低和中剂量CCNPs组大鼠脾脏相对质量高于对照组(P < 0.05)。高剂量CCNPs组大鼠脾脏相对质量与对照组比较差异无统计学意义(P < 0.05)。各剂量CCNPs组大鼠肝脏相对质量降低,其中高剂量CCNPs组大鼠肝脏相对质量与对照组比较差异有统计学意义(P < 0.05)。见表 3。
| (x±s) | ||||||
| Organs | n | Relative weight | ||||
| Liver | Kidney | Spleen | Heart | Lung | ||
| Control | 10 | 3.92±0.04 | 0.72±0.06 | 0.25±0.02 | 0.40±0.06 | 0.56±0.04 |
| CCNPs | ||||||
| Low dose | 10 | 3.68±0.35 | 0.78±0.05 | 0.37±0.05* | 0.43±0.03 | 0.71±0.09* |
| Middle dose | 10 | 3.35±0.27 | 0.70±0.06 | 0.38±0.11* | 0.45±0.04 | 0.86±0.05** |
| High dose | 8 | 2.89±0.70** | 0.70±0.05 | 0.26±0.05 | 0.44±0.08 | 0.78±0.10** |
| *P < 0.05, * * P < 0.01 vs control group. | ||||||
对照组大鼠肝脏切片:肝组织结构正常,肝细胞胞浆完整;低剂量CCNPs组:肝细胞仍以索状排列,同时可以观察到轻度的空泡变性和淋巴细胞浸润;中和高剂量CCNPs组:肝细胞排列轻度紊乱,肝细胞空泡增多,肝脏组织中出现了大量的炎性细胞浸润。肺脏切片:与对照组比较,低剂量CCNPs组大鼠肺泡间隔膜增厚且伴有炎性细胞浸润,在肺间质中有轻度的肉芽肿形成,提示轻度的肺脏毒性; 中和高剂量CCNPs组大量炎性细胞浸润,肺泡间质增厚及大量肉芽肿形成。脾脏切片显示:各剂量CCNPs组大鼠脾脏结构轮廓扭曲,尤其在中和高剂量CCNPs组明显。高剂量CCNPs组白髓轮廓不规则或者消失。心脏切片显示:低剂量CCNPs组大鼠心脏切片发现有轻度的炎性浸润;中剂量CCNPs组大鼠心肌细胞间质中有明显扩张的充血血管,红细胞外渗和中度炎性浸润; 高剂量CCNPs组心肌纤维肿胀、断裂甚至坏死,伴有严重的淋巴细胞浸润, 高剂量CCNPs组大鼠心肌的退行性改变最为明显。肾脏切片显示:低剂量CCNPs组大鼠无明显病理学改变; 中和高剂量CCNPs组大鼠肾脏组织的典型改变为肾小球出现萎缩和裂隙,同时发现动脉管壁增厚。见图 3(插页三)。
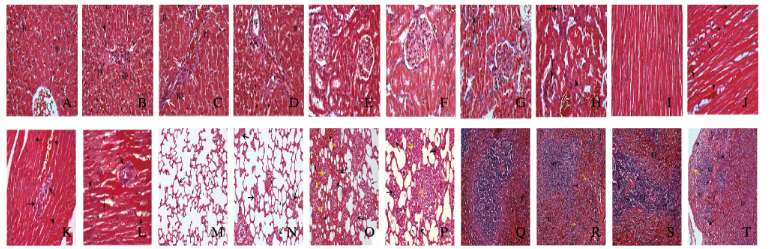
|
| A-D: Liver tissue (X400); E-H: Kidney tssue(X400); I-L: Heart tissue(X400); M- P: Lung tissue(X200); Q- T: Spleen tissue (X200); A. E.I, M. Q: Control group; B. F, K, N, R: Low dose of CCNPs group; C. G, K.O, S: Middle dose of CCNPs group; D, H, L, P, T: High dose of CCNPs group. 图 3 各组大鼠脏器组织病理形态表现(HE) Fig. 3 Pathomorphology of organ tissues of rats in various groups (HE) |
|
|
肝脏和骨骼疾病是ALP水平病理性升高最常见的原因,因此血液中ALT、ALP和AST水平的变化可以间接为肝脏毒性损伤的诊断提供重要参考[6]。心脏组织中含量丰富,心脏疾病或毒性损伤时会导致血清中CK水平升高[7]。血清中肌酐和尿素水平可以反映肾脏功能[6]。传统的抗癌药物由于缺乏肿瘤细胞和组织靶向性,因此抗癌药物在杀死肿瘤细胞的同时也会分布到正常的组织和器官,造成剂量相关的毒副作用[8-9]。随着纳米技术的发展,具有肿瘤组织靶向性的纳米载药体系可以在增加药物抗癌效果的同时减少对正常组织的毒副作用。纳米载药体系与传统的抗癌药物比较具有更高的肿瘤微环境靶向选择性和更强的肿瘤组织聚集作用,可以选择性地在肿瘤组织中蓄积[10-11]。因此纳米微粒在抗癌药物载药体系中的应用受到了广泛的关注。与其他载药体系比较,CCNPs具有良好的生物相容性、生物降解性和pH敏感性,展现了作为载药体系的强大潜力。但是CCNPs的体内安全剂量及其具体的生物学效应尚不清楚。因为临床中化疗药物一般采用静脉给药的方式,因此本研究采用14 d连续静脉注射的给药方式,初步探讨不同剂量CCNPs对SD大鼠的急性毒性作用。
当纳米微粒通过尾静脉注射给药时,纳米微粒通过静脉回流进入心脏,此后,肺脏接收心脏输出的静脉血。当通过肺脏后,含有纳米微粒的血液回到心脏,并随血液分布于全身。由于肝脏和脾脏的血液供应丰富并含有大量的网状内皮系统,因此大部分纳米微粒被捕获在肝脏和脾脏。此外,肾脏接受心输出量的20%,并且由于其特有的肾小球血液滤过系统,也可能是受到纳米颗粒暴露损伤的器官。因此纳米微粒静脉注射可以导致心脏、肺脏、肝脏、脾脏和肾脏这些主要器官的损伤[12]。
血液学指标可以作为评价静脉给药化合物的安全性和毒性的敏感指标[13]。本实验结果显示:各剂量CCNPs组大鼠嗜酸性粒细胞和MCHC水平与对照组比较明显降低,但是这些指标均在大鼠血液指标的正常参考值范围内[14]。本研究结果表明:低剂量CCNPs静脉给药不会引起大鼠血液学指标的紊乱,可以作为一个理想的静脉给药的载药体系。大鼠体质量和器官相对质量的逐渐增加直接反映实验动物的营养状态,而且间接反映药物对实验动物的毒性作用[15]。本研究结果与其他研究团队[16]的实验结果类似,均发现纳米微粒注射会引起肺脏相对质量增加。推测低和中剂量CCNPs组大鼠脾脏相对质量增加可能是由于连续注射CCNPs后脾脏的代偿改变,而高剂量CCNPs组大鼠脾脏相对质量未增加可能是因为在短时间内大量纳米微粒进入机体后脾脏的失代偿性表现。肝脏是毒性研究的常见靶器官。本研究结果显示:高剂量CCNPs连续注射导致大鼠肝脏相对质量明显降低,表明大剂量CCNPs连续注射对肝脏产生了毒性作用。
本研究结果显示:中和高剂量CCNPs连续注射可以引起大鼠明显的肺组织病理学改变,包括肺泡间隔膜增厚且伴有炎性细胞浸润,在肺间质中有肉芽肿形成,表明CCNPs通过血液循环到达了肺脏,并引起肺脏的毒性反应。同时,各剂量CCNPs组大鼠肺脏的相对质量明显增加,推测其与肺脏组织炎性信号介导的由血管到肺的渗出增加、纳米微粒滞留和肉芽肿形成有关[17]。肝脏和脾脏作为血液的主要贮存和过滤器官,也成为外来纳米颗粒的主要聚集处[18]。脾脏是机体免疫系统的一部分,是淋巴细胞作为机体免疫和防御感染的储存场所。本研究结果显示:CCNPs持续注射可以引起大鼠剂量相关性的巨噬细胞增生和脾脏组织空泡变性。巨噬细胞吞噬的纳米微粒可以刺激免疫应激引起脾脏巨噬细胞吞噬功能亢进[19]。本研究结果显示:中和低剂量CCNPs组大鼠脾脏相对质量明显增大,推测纳米微粒在脾脏被免疫细胞捕获并长期滞留,从而影响脾脏的免疫功能,引起剂量相关的脾脏毒性。Kupffer细胞是肝脏巨噬细胞。在免疫应答期间,Kupffer细胞释放高水平的促炎性标记物和细胞因子,进而加重组织炎症,这可能导致氧化应激和细胞损伤[20]。本研究结果显示:高剂量CCNPs组大鼠肝脏相对质量明显降低,同时CCNPs连续注射可以引起剂量相关的肝脏组织病理学改变,但是未引起血清生化指标的异常升高,提示纳米微粒静脉注射未造成显著的肝肾功能障碍。CCNPs持续给药可以引起剂量相关的心肌毒性病理学改变,但与心肌损伤相关的血液学指标并未达到异常水平。
金属离子从纳米微粒中释放是纳米材料产生细胞效应的一个重要因素[5]。与锌、铜和银等金属离子比较,钙离子的毒性作用相对很小,因为钙离子是人体必需的元素。此外,体内存在维持血钙水平平衡的钙离子调节系统[21]。本实验中,各剂量CCNPs组大鼠血钙水平与对照组相比并未升高。CCNPs暴露引起的大鼠组织病理学改变主要见于肺、肝和心脏的淋巴细胞浸润,此外脾脏主要表现为空泡变性和局灶性坏死。但血液学指标和血清生化指标的检测并未发现大鼠出现任何亚临床全身毒性表现。
综上所述,在14 d重复剂量的毒性实验中,低剂量CCNPs组未发现大鼠的死亡或毒性迹象,而在中和高剂量CCNPs组中虽然多个脏器均发生了微观的组织病理改变,而肝肾功能未受到影响,也未发现心肌损伤相关的血液学指标出现异常升高。低剂量CCNPs组大鼠多个脏器的轻度组织病理改变可能是由于注射纳米微粒后的细胞代偿改变,这些轻微的变化并不一定代表毒性作用。在纳米颗粒的注射部位未观察到任何局部毒性改变,表明小剂量CCNPs静脉给药不会引起严重的急性毒性反应。本实验首次报道了大鼠静脉注射CCNPs的14d重复毒性试验,观察和分析CCNPs引起的主要脏器的毒性作用,本研究结果为CCNPs在生物医学和药物应用中的安全性评价提供了实验依据。
| [1] | CERQUERIA B B S, LASHAM A, SHELLING A N, et al. Nanoparticle therapeutics:technologies and methods for overcoming cancer[J]. Eur J Pharm Biopharm, 2015, 97(2015): 140–151. |
| [2] | PEROVIC I, DAVIDYANTS A, EVANS J S. Aragonite-associated mollusk shell protein aggregates to form mesoscale "smart" hydrogels[J]. ACS Omega, 2016, 1(5): 886–893. DOI:10.1021/acsomega.6b00236 |
| [3] | BHARATHAM B H, ABU BAKAR M Z, PERIMAL E K, et al. Development and characterization of novel porous 3d alginate-cockle shell powder nanobiocomposite bone scaffold[J]. Biomed Res Int, 2014, 2014: 146723. |
| [4] | FU W L, NOHD M H, YUSOF L M, et al. In vitro evaluation of a novel pH sensitive drug delivery system based cockle shell-derived aragonite nanoparticles against osteosarcoma[J]. J Exp Nanosci, 2017, 12(1): 166–187. DOI:10.1080/17458080.2017.1287965 |
| [5] | HORIE M, LWAHASHL H. The impact of the physiochemical properties of manufactured nanoparticles on in vitro and in vivo evaluation of particle toxicity[J]. J Phys Chem Biophys, 2014, 4(2): 139. |
| [6] | GOWADA S, DESAI P B, HULL V V, et al. A review on laboratory liver function tests[J]. Pan Afr Med J, 2009, 3: 1–11. |
| [7] | SWAMY A V, GULLIAYA S, THIPPESWAMY A, et al. Cardioprotective effect of curcumin against doxorubicin-induced myocardial toxicity in albino rats[J]. Indian J Pharmacol, 2012, 44(1): 73–77. DOI:10.4103/0253-7613.91871 |
| [8] | LUETKE A, MEYERS P A, LEWIS I, et al. Osteosarcoma treatment - where do we stand? a state of the art review[J]. Cancer Treat Rev, 2014, 40(4): 523–532. DOI:10.1016/j.ctrv.2013.11.006 |
| [9] | THEEK B, RIZZO L Y, EHLING J, et al. The theranostic path to personalized nanomedicine[J]. Clin Transl Imaging, 2014, 2: 67–76. DOI:10.1007/s40336-014-0051-5 |
| [10] | LEU A J, BERK D A, LYMBOUSSAKI A, et al. Absence of functional lymphatics within a murine sarcoma:a molecular and functional evaluation[J]. Cancer Res, 2000, 60(16): 4324–4327. |
| [11] | BARUA S, MITRAGOTRI S. Challenges associated with penetration of nanoparticles across cell and tissue barriers:a review of current status and future prospects[J]. Nano Today, 2014, 9(2): 223–243. DOI:10.1016/j.nantod.2014.04.008 |
| [12] | XU J Y, SHI H B, RUTH M, et al. Acute toxicity of intravenously administered titanium dioxide nanoparticles in mice[J]. PLoS One, 2013, 8(8): e70618. DOI:10.1371/journal.pone.0070618 |
| [13] | ARIKA W M, NYAMAI D W, MUSILA M N, et al. Hematological markers of in vivo toxicity[J]. J Hematol Thrombosis Dis, 2016, 4(2): 236. |
| [14] | CAMPBELL T W. Exotic animal hematology and cytology[M]. Wiley Blankwell: John Wiley Sons, 2015: 383-391. |
| [15] | MICHAEL B, YANO B, SELLERS R S, et al. Evaluation of organ weights for rodent and non-rodent toxicity studies:a review of regulatory guidelines and a survey of current practices[J]. Toxicol Pathol, 2007, 35(5): 742–750. DOI:10.1080/01926230701595292 |
| [16] | BLUM J L, ROSENBLUM L K, GRUNIG G, et al. Short-term inhalation of cadmium oxide nanoparticles alters pulmonary dynamics associated with lung injury, inflammation, and repair in a mouse model[J]. Inhal Toxicol, 2014, 26(1): 48–58. DOI:10.3109/08958378.2013.851746 |
| [17] | AMAN J, VAN DERHEIJDEN M, VAN LINGEN A, et al. Plasma protein levels are markers of pulmonary vascular permeability and degree of lung injury in critically ill patients with or at risk for acute lung injury/acute respiratory distress syndrome[J]. Crit Care Med, 2011, 39(1): 89–97. DOI:10.1097/CCM.0b013e3181feb46a |
| [18] | YU Y, LI Y, WANG W, et al. Acute toxicity of amorphous silica nanoparticles in intravenously exposed ICR mice[J]. PLoS One, 2013, 8(4): e61346. DOI:10.1371/journal.pone.0061346 |
| [19] | YU T, GREISH K, MCGILL L D, et al. Influence of geometry, porosity and surface characteristics of silica nanoparticles on acute toxicity:their vasculature effect and tolerance threshold[J]. ACS Nano, 2012, 6(3): 2289–2301. DOI:10.1021/nn2043803 |
| [20] | PETERSEN H J, SMITH A M. The role of the innate immune system in granulomatous disorders[J]. Front Immunol, 2013, 4: 120. |
| [21] | PU F, CHEN N, XUE S. Calcium intake, calcium homeostasis and health[J]. Food Sci Hum Wellness, 2016, 5: 8–16. DOI:10.1016/j.fshw.2016.01.001 |
 2019, Vol. 45
2019, Vol. 45


