扩展功能
文章信息
- 王梦旭, 李胜男, 胡伟东, 陈少凤, 陈杏兰, 李友
- WANG Mengxu, LI Shengnan, HU Weidong, CHEN Shaofeng, CHEN Xinglan, LI You
- miR-186海绵载体的构建及其在EA.hy926细胞株中的表达
- Construction of miR-186 sponge vectorand its expression in EA.hy926 cells
- 吉林大学学报(医学版), 2019, 45(03): 498-503
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 498-503
- 10.13481/j.1671-587x.20190306
-
文章历史
- 收稿日期: 2018-08-06
2. 广东医科大学附属医院神经病学研究所, 广东 湛江 524002
2. Institute of Neurology, Affiliated Hospital, Guangdong Medical University, Zhanjiang 524002, China
微小RNA(microRNA miRNA)是一段非编码单链RNA核苷酸序列,广泛存在于动植物和人类的基因组中,长度为22~24 bp, 进化上高度保守,可与靶基因的3′UTR端通过完全或不完全配对结合的方式抑制mRNA的翻译或使其降解,抑制蛋白质的合成[1]。目前研究[2-3]表明:miRNA在细胞增殖、分化和迁移以及疾病的病理生理过程中起重要作用。Hsa-miR-186位于人类染色体1p31.1,锌指蛋白265基因的第8个内含子处,其序列在各物种中高度保守。研究[4-6]显示:miR-186可以通过其下游的各个不同的靶基因抑制肿瘤细胞的增殖、转移并促进凋亡,可以通过ABCB1增强卵巢癌细胞对化疗药物的敏感性[7]。研究[8]表明:在心肌细胞中过表达miR-186可以改善高糖的毒性作用,抑制细胞凋亡。KIM等[9]研究显示:miR-186在衰老的小鼠脑组织中表达下调,而过表达miR-186能下调BACE1的表达并降低Aβ的水平。临床数据[10]显示miR-186在心肌梗死患者的血液中呈高表达。动脉粥样硬化是急性冠脉综合征和缺血性脑梗死等心脑血管疾病的重要病理基础,而miR-186在该过程中的作用还尚未明确。本实验构建miR-186的海绵载体并包装成慢病毒,感染人脐静脉细胞融合细胞(EA.hy926细胞),构建稳定敲减miR-186的细胞株,旨在为探讨miR-186的生物学功能奠定基础。
1 材料与方法 1.1 细胞株和主要试剂HEK293T细胞株和EA.hy926细胞株购自美国ATCC公司。载体FV040(CMV-MCS-3FLAG-SV40-EGFP-IRES-puromycin)及病毒包装辅助质粒Helper 1.0、Helper2.0和Virus store buffer由上海复百澳生物科技有限公司提供。大肠埃希菌DH5α购自中国Solarbio公司,限制性内切酶EcoR Ⅰ、Xho Ⅰ、XbaⅠ和BamHⅠ及T4 DNA连接酶为美国NEB公司产品,逆转录试剂盒为美国Thermo公司产品,2×增强型染料法实时荧光定量PCR预混液为中国GenStar公司产品,胰蛋白酶、DMEM和胎牛血清购自美国Gibco公司,TRIzol和Lipofectamine 2000为美国Invitrogen公司产品,质粒提取试剂盒、50× TAE和胶回收试剂盒购自中国TIANGEN公司,酵母提取物、氯化钠、琼脂粉和胰蛋白胨购自美国VETEC公司。
1.2 PCR引物的设计和合成根据miRbase数据库中miR-186的成熟序列,设计并合成1对含有2个重复序列的寡核苷酸链,重复序列的第9~12位碱基与miR-186第9~12位碱基错配,两端包含限制性酶切位点EcoR Ⅰ、XhoⅠ和Sal Ⅰ。miR-186成熟序列的错配序列:正义链5′-AATTCGCCTCGAGAGCCCAAAAGC-TCATTCTTTGGCGAGCCCAAAAGCTCATTC-TTTGG-3′;反义链,5′-TCGACCAAAGAATG-AGCTTTTGGGCTCGCCAAAGAATGAGCTTT-TGGGCTCTCGAGGCG-3′。设计并合成miR-186和U6的反转录及qPCR引物:miR-186-RT,5′-GTCGTATCCAGTGCAGGGTCCGAGGTATT-CGCACTGGATACGACAGCCCA-3′; miR-186-F,5′-CGCGCGCGCAAAGAATTCTCCTTT-3′; miR-186-R,5′-ATCCAGTGCAGGGTCCGAGG-3′; U6-RT,5′-CGCTTCACGAATTTCCGTGTCAT-3′;U6-F:5′-CTCGCTTCGGCAGCACA-3′;U6-R,5′-AACGCTTCACGAATTTGCGT-3′。以上序列均由上海生工公司合成。
1.3 miR-186-sponge慢病毒载体的构建将miR-186错配序列的正、反义寡核苷酸单链退火,总体积为50 μL,正和反义链(10 μmol·L-1)各5 μL、10×缓冲液5 μL、ddH2O 35 μL,放入沸水中逐渐冷却。EcoR Ⅰ和Xho Ⅰ双酶切FV040表达载体,跑胶回收载体片段,将退火产物与回收的载体片段连接过夜。连接产物转化大肠埃希氏菌感受态DH5α,涂板,37℃培养过夜,挑取单克隆菌落接种于LB培养基(含氨苄青霉素),37℃摇床培养过夜;采用质粒提取试剂盒抽提质粒,质粒经EcoRⅠ和BamHⅠ酶切鉴定,再进行测序,验证正确的载体再次经EcoR Ⅰ和XhoⅠ双酶切并与退火产物连接,如此重复3次。
1.4 慢病毒包装和病毒滴定 1.4.1 慢病毒包装转染前1 d,取生长状态良好、处于对数生长期的HEK293T细胞铺板于10 cm细胞培养皿,置于37℃、5% CO2培养箱内培养,转染当天待细胞密度达80%~90%时进行转染。转染前2 h更换为Opti-MEM培养基;转染时向1个已灭菌的1.5 mL EP管中加入相应体积的Opti-MEM与各质粒溶液(目的载体质粒10 μg、pHelper 1.0载体5 μg、pHelper 2.0载体5 μg)混匀,总体积为500 μL,室温放置5 min;取50 μL Lipofectamine 2000转染试剂与450 μL Opti-MEM混合,室温放置5 min;将质粒溶液和转染试剂稀释液混合均匀,上下颠倒,室温放置20 min;将转染混合物加入HEK293T细胞培养皿中,摇匀,继续培养;6 h后,更换为新的10% FBS完全培养基。转染48 h后,荧光显微镜下观察含绿色荧光的细胞数,判定转染效率。确定转染成功后,进行第1次收毒操作,收集细胞培养基于1个无菌的50 mL离心管中,4℃保存,换液后继续培养24 h;转染72 h后,进行2次收毒操作。将收获的含病毒的培养基经0.22 μm过滤器过滤,过滤液收集于无菌超速离心管中,密封;低温、超速离心80 000 g离心4 h;弃上清,采用Virus store buffer重悬沉淀;再经过0.22 μm过滤器过滤除菌,分装于无菌EP管中,做好标记,保存于-80℃冰箱。
1.4.2 病毒滴度测定感染前1 d,接种生长状态良好和无污染的HEK293T细胞于96孔板中,每孔约1×104个,于37℃、5% CO2条件下培养。转染当天操作步骤:①准备96孔板1个,选择4个孔分别标记为10、1、10-1和10-2;②向每个孔中加入90 μL含2% FBS的DMEM培养基;③取10 μL病毒原液加入至标记为10的孔,混匀,从该孔中吸取10 μL液体加入到标记为1的孔,混匀,依次取10 μL加入到下一孔,直至最后一孔;④从标记为10-2的孔到标记为1的孔中吸取90 μL含病毒的稀释液,加入到含有HEK293T细胞的96孔培养板中,将培养板置于37℃、5% CO2条件下继续培养24 h后换液,培养过程中根据培养基颜色变化更换新鲜培养基;3 d后在荧光显微镜下观察含绿色荧光的细胞数。选择荧光细胞比例低于100%的孔进行计算,每孔细胞数为1×105个。病毒滴度(TU·mL-1)=荧光细胞数/病毒原液量。
1.5 miR-186-sponge稳定转染细胞系的建立和鉴定 1.5.1 慢病毒感染EA.hy926细胞系感染前1 d,接种处于对数生长期的EA.hy926细胞至6孔板,使感染时细胞密度约为30%,第2天根据感染复数(MOI)值(MOI=200)加入对照慢病毒FV040-control和目的基因慢病毒FV040-miR-186-sponge;24 h后换液,继续培养48 h后加入嘌呤霉素1 g·L-1进行筛选,隔天换液,筛选2周后荧光显微镜下观察感染效率。
1.5.2 荧光定量PCR(qPCR)法检测EA.hy926细胞中miR-186的相对表达水平实验分为空白对照组、FV040-control组和FV040-miR-186-sponge组,采用经典的TRIzol法提取各组细胞总RNA,测定纯度和浓度后,取500 ng总RNA,按照逆转录试剂盒说明书合成cDNA。总体系20 μL:5 ×缓冲液4 μL、Reverse Transcriptase 1 μL、RNase inhibitor 1 μL、RT-Primer 1.2 μL,加入不含RNase的ddH2O至20 μL。反应程序:16℃、30 min,42℃、45 min,85℃、5 min。采用中国GENSTAR公司的2×RealStar Green Power Mixture进行qPCR检测。10 μL反应体系:预混液(2×) 5 μL,上、下游引物(10 μmol·L-1)各0.1 μL,ddH2O 3.8 μL,cDNA模板1 μL。qPCR反应扩增条件:95℃、10 min,95℃、10 s,60℃、10 s,72℃、10 s共40个循环。绘制熔解曲线,反应条件:95℃、10 s,65℃、60 s,97℃、1 s。每组3个复孔,实验重复3次,以U6作为内参对照,采用2-△△CT法[11]计算EA.hy926细胞中miR-186的相对表达水平。
1.6 统计学分析采用Graphpad Prism 6.0统计软件进行统计学分析。各组细胞中miR-186相对表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 miR-186海绵载体的构建和验证设计针对miR-186成熟序列第9~12位碱基错配的序列(图 1A)。经过EcoR Ⅰ和Xho Ⅰ双酶切的FV040表达载体与退火后的错配序列连接后,进行EcoRⅠ和BamHⅠ双酶切鉴定,如第1次酶切的小片段约为310 bp,且测序验证成功,则验证正确的载体再次进行EcoR Ⅰ和XhoⅠ双酶切并与退火产物连接,如此重复3次;每次酶切验证的小片段约增加60 bp(图 1B和C),经测序验证miR-186海绵载体构建成功(图 2,见插页二)。
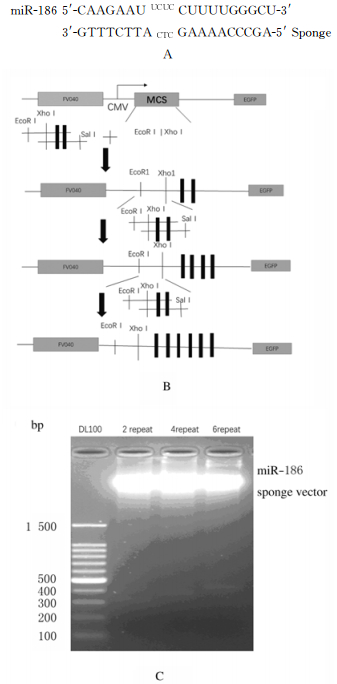
|
| miR-186 5′-CAAGAAU UCUC CUUUUGGGCU-3′ 3′-GTTTCTTA CTC GAAAACCCGA-5′ Sponge 图 1 miR-186海绵载体的技术路线(A-B)和电泳图(C) Fig. 1 Technology roadmap(A-B)and electrophoregram(C) of miR-186 spongevector |
|
|
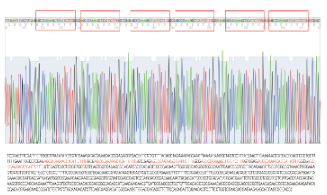
|
| 图 2 miR-186海锦载体的测序结果 Fig. 2 Sequencing rresults of miR-186 sponge vector |
|
|
将构建好的慢病毒表达载体与包装质粒一起转染293T细胞,转染48 h后在荧光显微镜下可见细胞生长状态良好且荧光表达强烈,表明病毒包装成功;收集病毒液,检测病毒滴度,FV040-control慢病毒滴度为2×108 TU·mL-1,FV040-miR-186-sponge慢病毒滴度为6×108 TU·mL-1。依据MOI值取相应病毒量感染EA.hy926细胞,72 h后加入1 g·L-1嘌呤霉素进行筛选,直至荧光强度达到95%以上,成功构建多克隆稳转细胞株。见图 3(插页二)。
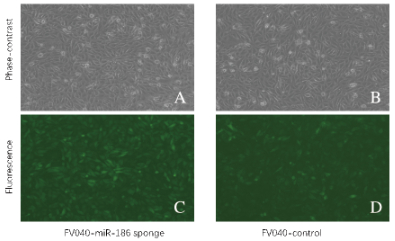
|
| 图 3 miR-186海锦载体病毒与对照病毒稳定转染EA.hy926细胞的形态表现(Bar= 400 μm) Fig. 3 Morphology of EA. hy926 cells stably transfected with FV040-miR-186 sponge and control virus (Bar= 400 μm) |
|
|
采用qPCR法检测空白对照组、FV040-control组和FV040-miR-186-sponge组EA.hy926细胞中miR-186相对表达水平,与空白对照组(1.014 ± 0.061)和FV040-control组(1.015 ± 0.050)比较,FV040-miR-186-sponge组miR-186相对表达水平(0.678 ± 0.044)明显降低(P < 0.01)。
3 讨论动脉粥样硬化是脑卒中、急性冠脉综合征和高血压等心脑血管疾病最常见的病理基础,其起始环节主要是内皮功能受损。当高血脂、高血糖和高血压等有害因素作用于内皮细胞时,可引起内皮细胞功能紊乱,炎症细胞被激活,IL-6和TNF等炎症因子异常分泌,最终促进动脉粥样硬化的形成[12]。目前研究[13]显示:miRNA作为基因转录后的负调控因子,可以通过各自不同的靶基因或信号途径影响动脉粥样硬化的形成过程。在高脂环境下,内皮细胞中过表达的miR-126-5p可以通过下调Dlk1,促进细胞增殖,抑制动脉粥样硬化的形成[14]。巨噬细胞的miR-21表达下调则会引起其下游MKK3的表达上调,激活p38-CHOP和JNK信号通路,促进斑块坏死及血管炎性反应,加速动脉粥样硬化的形成[15]。而miR-1907和miR-876分别通过下调Bcl-2和Bcl-Ⅺ促进内皮细胞凋亡,引起动脉粥样硬化的发生[16-17]。目前多项临床数据[18-20]显示:在患心肌梗死或血脂异常等高危心血管疾病的患者中miR-186表达水平呈升高趋势,YAO等[21]的研究结果也证实:miR-186在巨噬细胞中通过靶向胱硫醚-γ-裂解酶(CSE),促进巨噬细胞脂质聚集及促炎细胞因子的释放。低氧诱导时,miR-186可以通过靶向下游的HIF-1α抑制内皮细胞的增殖和迁移[22]。关于川崎病的基础研究[23]结果显示:miR-186可以通过下游的SMAD6基因激活MAPK途径,引起内皮细胞凋亡。本文作者推测miR-186可能在动脉粥样硬化的形成过程中起重要作用。
目前对miRNA的功能研究主要集中在通过不同的方式改变其在细胞内的表达,再结合各类实验,探讨miRNA可能具有的生物学功能。miRNA海绵技术是2007年EBERT等[24]开发出的一种可长期抑制miRNA的研究方法。miRNA海绵载体上含有几个miRNA结合位点,miRNA与这些位点之间有部分错配,使得miRNA与之结合的更稳定而不易被降解,同时也阻碍了miRNA结合靶基因,减弱miRNA的作用[24]。慢病毒载体可以将目标基因整合入宿主细胞基因组中,利用相应的抗生素或荧光标记进行筛选,得到稳定表达目标基因的细胞株,有利于开展后续的实验[25]。
本研究根据miR-186成熟序列设计合成了针对其第9~12位碱基的错配重复序列并在两端带有限制性酶切位点,利用载体构建技术构建miR-186海绵载体,并包装成慢病毒感染EA.hy926细胞,建立了稳定转染的细胞株,经qPCR法检测发现:miR-186海绵能明显下调miR-186的表达,为下一步探讨miR-186在动脉粥样硬化中的功能奠定了基础。
| [1] | BARTEL D P. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281–297. DOI:10.1016/S0092-8674(04)00045-5 |
| [2] | RIVERA-BARAHONA A, PEREZ B, RICHARD E, et al. Role of miRNAs in human disease and inborn errors of metabolism[J]. J Inherit Metab Dis, 2017, 40(4): 471–480. DOI:10.1007/s10545-017-0018-6 |
| [3] | VIENBERG S, GEIGER J, MADSEN S, et al. MicroRNAs in metabolism[J]. Acta Physiol (Oxf), 2017, 219(2): 346–361. DOI:10.1111/apha.2017.219.issue-2 |
| [4] | HUANG T, SHE K, PENG G, et al. MicroRNA-186 suppresses cell proliferation and metastasis through targeting MAP3K2 in non-small cell lung cancer[J]. Int J Oncol, 2016, 49(4): 1437–1444. DOI:10.3892/ijo.2016.3637 |
| [5] | ZHAO X, WANG Y, DENG R, et al. miR186 suppresses prostate cancer progression by targeting Twist1[J]. Oncotarget, 2016, 7(22): 33136–33151. |
| [6] | HE W, FENG J, ZHANG Y, et al. microRNA-186 inhibits cell proliferation and induces apoptosis in human esophageal squamous cell carcinoma by targeting SKP2[J]. Lab Invest, 2016, 96(3): 317–324. DOI:10.1038/labinvest.2015.134 |
| [7] | SUN K X, JIAO J W, CHEN S, et al. MicroRNA-186 induces sensitivity of ovarian cancer cells to paclitaxel and cisplatin by targeting ABCB1[J]. J Ovarian Res, 2015, 8(1): 80–87. DOI:10.1186/s13048-015-0207-6 |
| [8] | JIANG JM, MO HL, LIU C, et al. Inhibition of miR-186-5p contributes to high glucose-induced injury in AC16 cardiomyocytes[J]. Exp Ther Med, 2018, 15(1): 627–632. |
| [9] | KIM J, YOON H, CHUNG D E, et al. miR-186 is decreased in aged brain and suppresses BACE1 expression[J]. J Neurochem, 2016, 137(3): 436–445. DOI:10.1111/jnc.2016.137.issue-3 |
| [10] | BOSTJANCIC E, ZIDAR N, GLAVAC D. MicroRNA microarray expression profiling in human myocardial infarction[J]. Dis Markers, 2009, 27(6): 255–268. DOI:10.1155/2009/641082 |
| [11] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [12] | GIMBRONE M A, GARCIA-CARDENA G. Endothelial cell dysfunction and the pathobiology of atherosclerosis[J]. Circ Res, 2016, 118(4): 620–636. DOI:10.1161/CIRCRESAHA.115.306301 |
| [13] | SMALL E M, OLSON E N. Pervasive roles of microRNAs in cardiovascular biology[J]. Nature, 2011, 469(7330): 336–342. DOI:10.1038/nature09783 |
| [14] | SCHOBER A, NAZARI-JAHANTIGH M, WEI YY, et al. MicroRNA-126-5p promotes endothelial proliferation and limits atherosclerosis by suppressing Dlk1[J]. Nat Med, 2014, 20(4): 368–376. DOI:10.1038/nm.3487 |
| [15] | CANFRÁN-DUQUE A, ROTLLAN N, ZHANG X, et al. Macrophage deficiency of miR-21 promotes apoptosis, plaque necrosis, and vascular inflammation during atherogenesis[J]. EMBO Mol Med, 2017, 9(9): 1244–1262. DOI:10.15252/emmm.201607492 |
| [16] | ZHAO J, OU S L, WANG W Y, et al. MicroRNA-1907 enhances atherosclerosis-associated endothelial cell apoptosis by suppressing Bcl-2[J]. Am J Transl Res, 2017, 9(7): 3433–3442. |
| [17] | XU KC, LIU P, ZHAO Y. Upregulation of microRNA-876 induces endothelial cell apoptosis by suppressing Bcl-Ⅺ in development of atherosclerosis[J]. Cell Physiol Biochem, 2017, 42(4): 1540–1549. DOI:10.1159/000479271 |
| [18] | WANG K J, ZHAO X, LIU Y Z, et al. Circulating MiR-19b-3p, MiR-134-5p and MiR-186-5p are promising novel biomarkers for early diagnosis of acute myocardial infarction[J]. Cell Physiol Biochem, 2016, 38(3): 1015–1029. DOI:10.1159/000443053 |
| [19] | ZELLER T, KELLER T, OJEDA F, et al. Assessment of microRNAs in patients with unstable angina pectoris[J]. Eur Heart J, 2014, 35(31): 2106–2114. DOI:10.1093/eurheartj/ehu151 |
| [20] | WU J, SONG J, WANG C, et al. Identification of serum microRNAs for cardiovascular risk stratification in dyslipidemia subjects[J]. Int J Cardiol, 2014, 172(1): 232–234. |
| [21] | YAO Y, ZHANG X, CHEN H P, et al. MicroRNA-186 promotes macrophage lipid accumulation and secretion of pro-inflammatory cytokines by targeting cystathionine gamma-lyase in THP-1 macrophages[J]. Atherosclerosis, 2016, 250: 122–132. DOI:10.1016/j.atherosclerosis.2016.04.030 |
| [22] | DANG R Y, LIU F L, LI Y. Circular RNA hsa_circ_0010729 regulates vascular endothelial cell proliferation and apoptosis by targeting the miR-186/HIF-1alpha axis[J]. Biochem Biophys Res Commun, 2017, 490(2): 104–110. DOI:10.1016/j.bbrc.2017.05.164 |
| [23] | WU RZ, SHEN DP, SOHUN H, et al. miR186, a serum microRNA, induces endothelial cell apoptosis by targeting SMAD6 in Kawasaki disease[J]. Int J Mol Med, 2018, 41(4): 1899–1908. |
| [24] | EBERT M S, NEILSON J R, SHARP P A. MicroRNA sponges:competitive inhibitors of small RNAs in mammalian cells[J]. Nature Methods, 2007, 4(9): 721–726. DOI:10.1038/nmeth1079 |
| [25] | NASRI M, KARIMI A, ALLAHBAKHSHIAN FARSANI M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes[J]. Cytotechnology, 2014, 66(6): 1031–1038. DOI:10.1007/s10616-013-9652-5 |
 2019, Vol. 45
2019, Vol. 45


