扩展功能
文章信息
- 李爽, 郭浩然, 魏伟
- LI Shuang, GUO Haoran, WEI Wei
- 灵长类动物限制性因子SAMHD1的生物学功能分析
- Analysis on biological functions of restriction factor SAMHD1 of primates
- 吉林大学学报(医学版), 2019, 45(03): 484-490
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 484-490
- 10.13481/j.1671-587x.20190304
-
文章历史
- 收稿日期: 2018-09-20
不育-α-基序结构域和组氨酸/天冬氨酸残基双联体结构域包涵蛋白1(sterile alpha motif and HD domain containing protein-1, SAMHD1)是哺乳动物细胞内唯一已知的脱氧核糖核酸水解酶(dNTPase),由626个氨基酸组成,含有1个不育-α-基序结构域(SAM)和1个组氨酸/天冬氨酸残基双联体结构域(HD)[1-2]。研究者[3]于2000年发现干扰素γ(interferon-γ, IFN-γ)处理后的鼠源树突状细胞能提升SAMHD1的mRNA水平,进而发现了samhd1基因。2009年,RICE等[4]进一步报道了samhd1基因突变是自身免疫病Aicardi-Goutières综合征的重要诱因之一,表明SAMHD1蛋白在机体免疫调控中起关键作用。2011年,SAMHD1蛋白被证实是人巨噬细胞和树突状细胞拮抗1型人类免疫缺陷病毒(human immunodeficiency virus-1, HIV-1)感染的重要防御因子[5]。静息期免疫细胞借助SAMHD1蛋白的dNTPase酶活性,消耗细胞中dNTPs浓度,抑制HIV-1病毒逆转录过程中病毒DNA的合成,切断病毒复制周期[6]。研究[7-8]显示:SAMHD1抗病毒活性对于静止CD4+T细胞抵御HIV-1感染同样重要。2型人类免疫缺陷病毒(human immunodificiency virus-2, HIV-2)和部分猴免疫缺陷病毒(siman immunodeficiency virus, SIV)通过编码病毒非结构蛋白Vpx识别宿主CRL4(DCAF1)泛素化复合体诱导SAMHD1蛋白降解,进而突破宿主固有免疫防线[5, 9-12]。SAMHD1蛋白对乙型肝炎病毒(HBV)、单纯疱疹病毒(HSV)和牛痘病毒等病毒的复制均有明显的抑制作用[13-14]。因此,SAMHD1蛋白是机体抵御外源病毒感染的重要限制因子。
除了具有抗病毒活性,近年的研究[15-20]表明SAMHD1在DNA损伤修复、内源性逆转录因子转座活性和固有免疫识别等重要生理过程中均具有关键调控作用。本实验室与其他课题组进行系统发育分析[21-22]结果显示:该基因在物种进化中的存有显著阳性筛选。然而,对于SAMHD1蛋白在进化中功能差异研究的报道较少。本研究重点探讨了类人猿[黑猩猩(Pan troglodytes,简称Pan)、白颊长臂猿(Nomascus leucogenys,简称Noma)、苏门答腊猩猩(Pongo abelii,简称Pongo)]、旧世界猴子[恒河猴(Macaca mulatta,简称Mac)、食蟹猴(Macaca fascicularis,简称Fasci)]和新世界猴子狨猴(Callithrix jacchus,简称Calli)等灵长类动物体内SAMHD1蛋白的多种生物学功能,对研究灵长类物种内源性限制因子的功能进化提供理论依据。
1 材料与方法 1.1 细胞、质粒和主要试剂人胚胎肾HEK293T细胞和人组织细胞淋巴瘤U937细胞(美国ATCC公司)。本实验中灵长类动物SAMHD1、HIV-2rod、SIVmac和SIVdeb的Vpx表达质粒均购自上海捷瑞公司,所有质粒使用前均进行测序确认序列正确。DMEM培养基和RPMI-1640培养基(美国HyClone公司),胎牛血清(美国Gibco公司),佛波酯(PMA,美国Promega公司),Anti-α-tubulin抗体(美国Abcam公司),鼠二抗和兔二抗(美国Jackson Immuno Research Laboratories公司)。化学发光检测仪(美国Thermo公司),流式细胞分析仪(美国BD公司)。
1.2 细胞培养HEK293T细胞采用含10%胎牛血清和1%青霉素/链霉素的DMEM培养基,置于恒温培养箱中培养(37℃、5%CO2)。细胞融合达80%~90%时,采用0.25%胰蛋白酶消化传代。取生长状态良好的对数生长期细胞进行实验。U937细胞采用含10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基,置于恒温培养箱中培养(37℃、5%CO2)。每隔3 d使用半数换液法进行传代。
1.3 SAMHD1稳定表达细胞系的建立和抗病毒实验HEK293T细胞瞬时转入不同灵长类动物PLVX-SAMHD1、pRSV-Rev(Addgene, 12253)、pMDLg/pRRE (Addgene, 12251)和pCMV-VSV-G (Addgene, 8454)质粒,转染48~72 h后收获含有假病毒颗粒的上清液。离心、过滤纯化,将上清加入U937细胞中共孵育48 h后,采用嘌呤霉素进行目的细胞阳性筛选。构建成功后能够分别稳定表达Noma、Pongo、Macaca和CalliSAMHD1蛋白的U937细胞,以pLVX-puro空载体构建的U937-control细胞系为阴性对照组,以稳定表达灵长类动物SAMHD1蛋白的U937-SAMHD1细胞为实验组,经PMA诱导处理48 h后,分化成巨噬细胞样,再加入等滴度的HIV-1-GFP病毒感染2 h后换液,2 d后采用流式细胞术对病毒成功感染的绿色荧光蛋白(GFP)阳性细胞进行计数。HIV-1病毒感染率=病毒成功感染的GFP阳性细胞数/总细胞数×100%。
1.4 Western blotting法检测病毒蛋白Vpx诱导灵长类动物限制因子SAMHD1降解将处于对数生长期的HEK293T细胞接种至12孔板中,贴壁过夜后,分别转入灵长类带有HA标签SAMHD1与不同种属Vpx表达质粒,48 h后收集细胞,制备蛋白样品。采用SDS-PAGE凝胶电泳进行检测,电泳条件为120 V恒压120 min。将电泳的SDS-PAGE凝胶取出,采用半干转膜仪进行转膜,转膜条件为20 V、20 min。转膜完成后将硝酸纤维素(NC)膜置入含有5%奶粉的TBST溶液中封闭20 min。加入一抗,置于4℃摇床过夜。采用TBST洗膜3次,再采用TBS洗膜1次,每次10 min。加入种属对应的二抗,室温下孵育1 h。洗膜后将NC膜置于配置好的碱性磷酸酶显色液中,避光显色5~15 min,显色结束后晾干NC膜,放入扫描仪中扫描。采用Image J软件进行灰度值分析,计算蛋白表达水平。蛋白表达水平=每个样本条带灰度值/α-tubulin灰度值。
1.5 灵长类动物SAMHD1蛋白的细胞内定位HEK293T细胞转入人与灵长类动物SAMHD1-HA表达质粒,48 h后采用4%多聚甲醛对细胞进行固定,随后采用Triton X-100(0.3%~0.5%)进行通透处理,经过与HA抗体过夜孵育后,与荧光二抗进行孵育,使用核酸荧光染料DAPI对细胞核进行染色,所制备样品在倒置荧光显微镜下观察与照相。
1.6 流式细胞术检测灵长类动物SAMHD蛋白对LINE-1转座子的活性在HEK293T细胞中,以单独转染2 μg LINE-1-GFP(99 PUR RPS EGFP)的HEK293T细胞为对照组,以共同转染2 μg LINE-1-GFP(99 PUR RPS EGFP)与含HA标签的SAMHD1表达质粒的HEK293T细胞为实验组,48 h后加入嘌呤霉素清除未被转染细胞,48 h后采用流式细胞术检测GFP阳性细胞率。GFP阳性细胞率=GFP阳性细胞数/总细胞数×100%。以GFP阳性细胞率表示SAMHD1蛋白对LINE-1转座子的活性。
1.7 化学发光仪检测HEK293T细胞中荧光素酶活性在HEK293T细胞中,以单独转染100 ng IFN-luciferase报告质粒的HEK293T细胞为对照组,以共同转染100ng IFN-luciferase报告质粒与SAMHD1表达质粒的HEK293T细胞为实验组,24 h后加入等滴度仙台病毒SeV,病毒处理后24 h收获样品进行荧光素酶活性检测。荧光素酶活性=发光细胞数/总细胞数×100%。
1.8 统计学分析采用GraphPad Prism5.0统计软件进行统计学分析。各组GFP阳性细胞率和干扰素荧光素酶活性以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 灵长类动物HIV-1病毒感染率通过慢病毒表达系统建立稳定表达SAMHD1蛋白的U937细胞系,在经过PMA诱导处理48 h后,均表达了SAMHD1蛋白。见图 1。向诱导分化后的细胞分别加入相同滴度的HIV-1-GFP病毒,感染复数(MOI)=0.7。与pLVX-puro空载体构建的U937-control细胞系的阴性对照组(45.39%±0.33%)比较,实验组Pongo(17.65%±0.22%)、Noma(31.54%±0.08%)、Calli(14.39%±0.03%)和Mac(14.66%±0.16%)的HIV-1病毒感染率明显降低(P < 0.01)。见图 2。
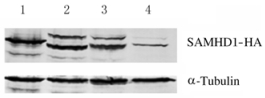
|
| Lane 1:Pongo; Lane 2:Noma; Lane 3:Calli; Lane 4:Mac. 图 1 Pongo、Noma、Calli和Mac中SAMHD1蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of SAMHD1 protein in Pongo, Noma, Calli, and Mac |
|
|
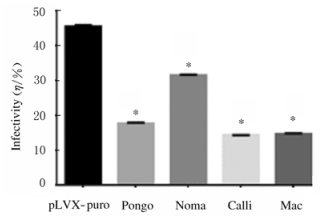
|
| *P < 0.05 vs pLVX-puro group. 图 2 各组灵长类动物细胞系中HIV-1病毒感染率 Fig. 2 Virus infection rates of HIV-1 in cell lines of primates in various groups |
|
|
与单独转染SAMHD1表达质粒的HEK293T细胞比较,共同转染SAMHD1与HIV-2/SIV Vpx表达质粒细胞的SAMHD1蛋白表达水平均明显降低。HIV-2rod-Vpx、SIVmac-Vpx和SIVdeb-Vpx均能够高效诱导人、Pongo、Noma和Calli的SAMHD1蛋白的降解。见图 3和4。
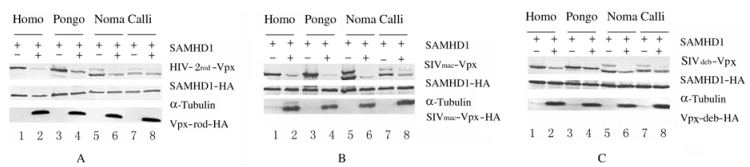
|
| A-C: Expressions of SAMHD1 induced by HIV-2rod-Vpx, SIVmac-Vpx, and SIVdeb-Vpx. 图 3 不同灵长类动物SAMHD1蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of SAMHD1 protein in different primates |
|
|
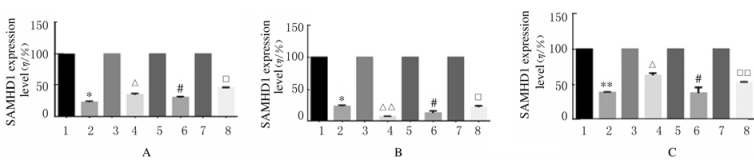
|
| A:HIV-2rod-Vpx; B:SIVmac-Vpx; C:SIVdeb-Vpx.1:Homo; 2:Homo+Vpx; 3:Pongo; 4:Pongo+Vpx; 5:Noma; 6:Noma+Vpx; 7:Calli; 8:Calli+Vpx.*P < 0.05, * *P < 0.01 vs Homo; △ P < 0.05, △△ P < 0.01 vs Pongo; #P < 0.05 vs Noma; □P < 0.05 vs Calli. 图 4 不同灵长类动物SAMHD1蛋白表达水平 Fig. 4 Expression levels of SAMHD1 protein in different primates |
|
|
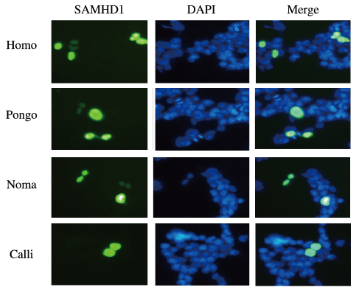
灵长类动物SAMHD1蛋白均保持定位在细胞核中。不同灵长类动物SAMHD1的N端区域均含有一个高度保守的“KRPR”核定位信号(nuclear location signal, NLS),进一步支持SAMHD1蛋白定位于细胞核中。免疫荧光染色结果见图 5(插页一),进核信号氨基酸序列见图 6。
|
| 图 5 灵长类动物SAMHDI蛋白在细胞中的定位(免疫荧光,×400) Fig. 5 Location of SAMHD1 protein in cells in primates(Immunofluorescence,×400) |
|
|

|
| 图 6 灵长类动物SAMHD1蛋白NLS的氨基酸序列 Fig. 6 Acid sequences of NLS of SAMHD1 protein of primates |
|
|
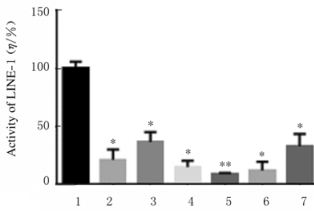
与对照组比较, 实验组人(Homo: 100.30±3.33)、Pongo(16.41±1.96)、Noma (28.54±2.12)、Calli(7.13±1.18)、Mac(9.33± 0.33)和Pan(22.97±1.69)的SAMHD1对LINE-1转座子活性均降低(P < 0.05或P < 0.01)。见图 7。
|
| 1:Control group; 2:Homo; 3:Pongo; 4:Noma; 5:Calli; 6:Mac; 7:Pan.*P < 0.05, **P < 0.01 vs control group. 图 7 各种灵长类动物SAMHD1对LINE-1转座子的活性 Fig. 7 Activities of SAMHD1 to LINE-1 transposon in primates |
|
|
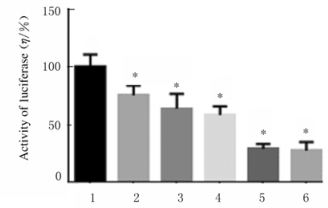
在HEK293T细胞分别过表达人(78.33±5.86)和Mac(70.31±6.13)、Pongo(65.31±4.34)SAMHD1蛋白后,不同程度地抑制了SeV病毒对IFN产生的激活效果。Noma(32.10±3.81)和Calli(30.63±2.92)来源的SAMHD1蛋白对IFN-Luc的抑制作用最为明显。见图 8。
|
| 1:Control group; 2:Homo; 3:Mac; 4:Pango; 5:Noma; 6:Calli.*P < 0.05 vs control group. 图 8 各组HEK293T细胞中荧光素酶活性 Fig. 8 Activities of luciferase in HEK293T cells in various groups |
|
|
SAMHD1蛋白是一种具有广谱抗病毒活性的固有免疫防御因子,依赖其自身的脱氧核糖核苷三磷酸水解酶(dNTPase)活性,降低髓系细胞和静息状态下的CD4+T细胞中dNTPs水平,导致逆转录病毒和DNA病毒由于缺乏DNA合成的必要原料而中止病毒复制。近期研究[23-25]已表明:SAMHD1蛋白抗逆转录病毒作用中仍受到磷酸化和氧化还原等蛋白翻译后修饰调控,对于SAMHD1抗病毒活性机制仍有待进一步深入研究。本课题组前期研究[26]已证实samhd1基因在灵长类动物进化中受到正向选择(Positive Selection),导致SAMHD1蛋白与病毒辅助蛋白Vpx/Vpr之间相互作用存在种属特异性。SAMHD1蛋白已被发现在免疫反应调控、内源性逆转录因子活性抑制和肿瘤发生发展[27-28]等重要生理进程中具有重要的细胞学功能。但是,对于SAMHD1蛋白的生物学功能在灵长类动物进化中的保守性研究仍然较少。
本研究结果显示:虽然目前尚未有SIV感染Pongo、Noma和Calli的相关报道,但是所检测的所有灵长类动物SAMHD1蛋白均具有明显的抗HIV-1病毒感染的活性,表明SAMHD1蛋白早在灵长类动物出现就已经进化成为宿主的重要免疫防御之一。HIV-2和特定的SIV亚型病毒编码的Vpx/Vpr蛋白同时识别CRL4(DCAF1) E3泛素化连接酶和SAMHD1蛋白,指导SAMHD1蛋白发生泛素化,致使SAMHD1蛋白被细胞内蛋白酶体识别并降解。本研究结果显示:灵长类动物SAMHD1蛋白能够被HIV-2、SIVmac和SIVdeb所编码的Vpx/Vpr识别而降解,充分说明了免疫缺陷病毒Vpx蛋白在进化中靶向了SAMHD1蛋白高度保守的区域,实现广谱有效地中和SAMHD1抗病毒活性,可作为后续的抗病毒治疗靶点研究。
在物种进化历程中,多种活跃的转座子发挥着巨大的作用,但在正常生理条件下,过度活跃的转座元件对基因组有不稳定的诱变效应。LINE-1是Long interspersed elements (LINEs)家族的主要成员,是人类基因组中已知的唯一具有自主转座活性的逆转录子。正常条件下,LINE-1转座插入仅存在于生殖细胞和胚胎形成等特定细胞中,其他细胞中LINE-1转座活性受到了严格控制。本研究结果显示:灵长类动物SAMHD1蛋白对LINE-1活性均具有强烈的抑制作用,证实SAMHD1蛋白是灵长类物种机体内维持基因组稳定的重要调控因子。同时近期多项研究[18-19]也揭示了samhd1基因突变与基因组不稳定以及肿瘤发生发展具有正相关关系,进一步支持了本研究的结论。
已有研究[29]在部分AGS患者体内发现了samhd1基因的突变。AGS患者主要临床表现包括颅内多发钙化灶、脑白质病变和冻疮样皮损等, 患者体内伴有干扰素产生水平明显增强现象。并且最近研究[30]显示SAMHD1蛋白能够抑制细胞内DNA或RNA诱发的IFN产生信号通路,支持SAMHD1是机体天然免疫的负调控因子。本研究结果显示:灵长类动物体内SAMHD1蛋白具有保守的抑制天然免疫激活的能力,表明SAMHD1蛋白在灵长类动物体内具有监控和压制机体免疫过度异常激活的重要作用。
综上所述,灵长类动物SAMHD1蛋白在进化过程中,其抗病毒活性、与病毒蛋白Vpx相互作用、细胞内定位、抗内源性LINE-1活性和抑制免疫激活等重要特性是高度保守的,本研究进一步加深了对灵长类限制因子功能性进化轨迹的认识和了解,为基于趋向性增强SAMHD1抗病毒活性治疗病毒感染的治疗策略提供了进化角度的依据。
| [1] | HOFMANN H, VANWALSCAPPEL B, BLOCH N, et al. TLR7/8 agonist induces a post-entry SAMHD1-independent block to HIV-1 infection of monocytes[J]. Retrovirology, 2016, 13(1): 83. DOI:10.1186/s12977-016-0316-3 |
| [2] | RYOO J, CHOI J, OH C, et al. The ribonuclease activity of SAMHD1 is required for HIV-1 restriction[J]. Nat Med, 2014, 20(8): 936–941. DOI:10.1038/nm.3626 |
| [3] | L IN, ZHANG W, CAO X. Indenfification of human homologue of mouse IFN-gamma induced protein from human dendritic cells[J]. Immunol Lett, 2000, 74(3): 221–224. DOI:10.1016/S0165-2478(00)00276-5 |
| [4] | RICE GVI, BOND J, ASIPU A, et al. Mutations involved in Aicardi-Goutières syndrome implicate SAMHD1 as regulator of the innate immune response[J]. Nat Genet, 2009, 41(7): 829–832. DOI:10.1038/ng.373 |
| [5] | LAQUETE N, SOBHIAN B, CASARTELLI N, et al. SAMHD1 is the dendritic- and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx[J]. Nature, 2011, 474(7353): 654–657. DOI:10.1038/nature10117 |
| [6] | GOLDSTONE D C, ENNIS-ADENRIAN V, HEDDEN J J, et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase[J]. Nature, 2011, 480(7377): 379–382. DOI:10.1038/nature10623 |
| [7] | BALDAUF H M, PAN X, ERIKSON E, et al. SAMHD1 restricts HIV-1 infection in resting CD4(+) T cells[J]. Nat Med, 2012, 18(11): 1682–1687. DOI:10.1038/nm.2964 |
| [8] | DESCOURS B, CRIBIER A, CHABLE-BESSIA C, et al. SAMHD1 restricts HIV-1 reverse transcription in quiescent CD4(+) T-cells[J]. Retrovirology, 2012, 9: 87. DOI:10.1186/1742-4690-9-87 |
| [9] | WEI W, GUO H, HAN X, et al. A novel DCAF1-binding motif required for Vpx-mediated degradation of nuclear SAMHD1 and Vpr-induced G2 arrest[J]. Cell Microbiol, 2012, 14(11): 1745–1756. DOI:10.1111/cmi.2012.14.issue-11 |
| [10] | HRECKA K, HAO C, GIERSZEWSKA M, et al. Vpx relieves inhibition of HIV-1 infection of macrophages mediated by the SAMHD1 protein[J]. Nature, 2011, 474(7353): 658–661. DOI:10.1038/nature10195 |
| [11] | GUO H, WEI W, WEI Z, et al. Identification of critical regions in human SAMHD1 required for nuclear localization and Vpx-mediated degradation[J]. PLoS One, 2013, 8(7): e66201. DOI:10.1371/journal.pone.0066201 |
| [12] | WEI W, GUO H, LIU X, et al. A first-in-class NAE inhibitor, MLN4924, blocks lentiviral infection in myeloid cells by disrupting neddylation-dependent Vpx-mediated SAMHD1 degradation[J]. J Virol, 2014, 88(1): 745–751. DOI:10.1128/JVI.02568-13 |
| [13] | HOLLENBAUGH J A, GEE P, BAKER J, et al. Host factor SAMHD1 restricts DNA viruses in non-dividing myeloid cells[J]. PLoS Pathog, 2013, 9(6): e1003481. DOI:10.1371/journal.ppat.1003481 |
| [14] | HU J, QIAO M, CHEN Y, et al. Cyclin E2-CDK2 mediates SAMHD1 phosphorylation to abrogate its restriction of HBV replication in hepatoma cells[J]. FEBS Lett, 2018, 592(1): 1893–1904. |
| [15] | CABELLO-LOBATO M J, WANG S, SCHMID C K, et al. SAMHD1 sheds moonlight on DNA double-strand break repair[J]. Trends Genet, 2017, 33(12): 895. DOI:10.1016/j.tig.2017.09.007 |
| [16] | COQUEL F, SILVA M J, TECHER H, et al. SAMHD1 acts at stalled replication forks to prevent interferon induction[J]. Nature, 2018, 557(7703): 57–61. DOI:10.1038/s41586-018-0050-1 |
| [17] | ZHAO K, DU J, HAN X, et al. Modulation of LINE-1 and Alu/SVA retrotransposition by Aicardi-Goutieres syndrome-related SAMHD1[J]. Cell Rep, 2013, 4(6): 1108–1115. DOI:10.1016/j.celrep.2013.08.019 |
| [18] | WHITE T E, BRANDARIZ-NUNEZ, HAN K, et al. Modulation of LINE-1 retrotransposition by a human SAMHD1 polymorphism[J]. Virol Rep, 2016, 6: 53–60. DOI:10.1016/j.virep.2016.06.001 |
| [19] | MAELFAIT J, BRIDGEMAN A, BENLAHRECH A, et al. Restriction by SAMHD1 Limits cGAS/STING-dependent innate and adaptive immune responses to HIV-1[J]. Cell Rep, 2016, 16(6): 1492–1501. DOI:10.1016/j.celrep.2016.07.002 |
| [20] | CHEN S, BONIFATI S, QIN Z, et al. SAMHD1 suppresses innate immune responses to viral infections and inflammatory stimuli by inhibiting the NF-κB and interferon pathways[J]. Proc Natl Acad Sci, 2018, 115(16): E3798–E3807. DOI:10.1073/pnas.1801213115 |
| [21] | WEI W, GUO H, GAO Q, et al. Variation of two primate lineage-specific residues in human SAMHD1 confers resistance to N terminus-targeted SIV Vpx proteins[J]. J Virol, 2014, 88(1): 583–591. DOI:10.1128/JVI.02866-13 |
| [22] | LIM E S, FREGOSO O I, MCCOY C O, et al. The ability of primate lentiviruses to degrade the monocyte restriction factor SAMHD1 preceded the birth of the viral accessory protein Vpx[J]. Cell Host Microbe, 2012, 11(2): 194–204. DOI:10.1016/j.chom.2012.01.004 |
| [23] | CRIBIER A, DESCOURS B, VALADAO A L, et al. Phosphorylation of SAMHD1 by cyclin A2/CDK1 regulates its restriction activity toward HIV-1[J]. Cell Rep, 2013, 3(4): 1036–1043. DOI:10.1016/j.celrep.2013.03.017 |
| [24] | WANG Z, BHATTACHARYA A, WHITE T, et al. Functionality of redox-active cysteines is required for restriction of retroviral replication by SAMHD1[J]. Cell Rep, 2018, 24(4): 815–823. DOI:10.1016/j.celrep.2018.06.090 |
| [25] | WHITE T E, BRANDARIZ-NUNEZ A, VALLE-CASUSO J C, et al. The retroviral restriction ability of SAMHD1, but not its deoxynucleotide triphosphohydrolase activity, is regulated by phosphorylation[J]. Cell Host Microbe, 2013, 13(4): 441–451. DOI:10.1016/j.chom.2013.03.005 |
| [26] | WEI W, GUO H, GAO Q, et al. Variation of two primate lineage-specific residues in human SAMHD1 confers resistance to N terminus-targeted SIV Vpx proteins[J]. J Virol, 2014, 88(1): 583–591. DOI:10.1128/JVI.02866-13 |
| [27] | WANG JL, LU F Z, SHEN X Y, et al. SAMHD1 is down regulated in lung cancer by methylation and inhibits tumor cell proliferation[J]. Biochem Biophys Res Commun, 2014, 455(3/4): 229–233. |
| [28] | CLIFFORD R, LOUIS T, ROBBE P, et al. SAMHD1 is mutated recurrently in chronic lymphocytic leukemia and is involved in response to DNA damage[J]. Blood, 2014, 123(7): 1021–1031. DOI:10.1182/blood-2013-04-490847 |
| [29] | WHITE T E, BRANDARIZ-NUNEZ A, MARTINEZ-LOPEZ A, et al. A SAMHD1 mutation associated with Aicardi-Goutières syndrome uncouples the ability of SAMHD1 to restrict HIV-1 from its ability to downmodulate type Ⅰ interferon in humans[J]. Hum Mutat, 2017, 38(6): 658–668. DOI:10.1002/humu.2017.38.issue-6 |
| [30] | MAELFAIT J, BRIDGEMAN A, BENLAHRECH A, et al. Restriction by SAMHD1 limits cGAS/STING-dependent innate and adaptive immune responses to HIV-1[J]. Cell Rep, 2016, 16(6): 1492–1501. DOI:10.1016/j.celrep.2016.07.002 |
 2019, Vol. 45
2019, Vol. 45


