扩展功能
文章信息
- 周海霞, 侯力键, 王正明, 田宇, 韩亮, 李密馥
- ZHOU Haixia, HOU Lijian, WANG Zhengming, TIAN Yu, HAN Liang, LI Mifu
- HOXA4调控Wnt/β-catenin信号通路对裸鼠移植胶质瘤的抑制作用
- Inhibitory effect of HOXA4 on transplantationglioma of nude mice through regulating Wnt/β-catenin signal pathway
- 吉林大学学报(医学版), 2019, 45(03): 474-478
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 474-478
- 10.13481/j.1671-587x.20190302
-
文章历史
- 收稿日期: 2018-05-04
2. 吉林大学中日联谊医院病理科, 吉林 长春 130033;
3. 吉林大学中日联谊医院神经外科, 吉林 长春 130033;
4. 武警吉林总队医院神经外科, 吉林 长春 130052
2. Department of Pathology, China-Japan Union Hospital, Jilin University, Changchun 130033, China;
3. Department of Neurosurgery, China-Japan Union Hospital, Jilin University, Changchun 130033, China;
4. Department of Neurosurgery, Armed Police Jilin General Hospital, Changchun 130052, China
胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,具有发病率高和生存率低的特点,目前寻求分子靶点治疗成为胶质瘤新的突破点[1]。同源异型盒基因(homeobox gene HOX)作为转录调节因子在肿瘤细胞增殖分化过程中起到重要的调控作用[2],同源异型盒基因A4(homeobox gene A4, HOXA4)作为HOX家族一员,在肺癌、结肠癌和卵巢癌等不同肿瘤中表达异常并发挥调控作用[3-5]。研究[6]显示:在胚胎干细胞生长发育过程中,HOXA4可作用于Wnt/β-catenin信号通路,同时最新研究[7]显示:在肺癌组织中HOXA4可通过调控Wnt/β-catenin信号通路影响肿瘤的生长和侵袭。本课题组前期体外研究[8]显示:人胶质瘤组织中HOXA4基因表达上调并促进细胞增殖、抑制凋亡从而发挥促癌作用,但是否存在HOXA4通过Wnt/β-catenin信号通路影响胶质瘤恶性生物学行为尚未清楚。本研究通过建立人胶质瘤HOXA4基因敲除荷瘤裸鼠模型,进一步探讨HOXA4对胶质瘤细胞体内生长的影响及其对Wnt/β-catenin信号通路的调控作用。
1 材料与方法 1.1 主要试剂和仪器TRIzol试剂和Polyfect-V试剂(Invitrogen公司,美国),HiFi-MMLV cDNA第1链合成试剂盒和UltraSYBR Mixture(北京康为世纪生物技术公司),DMEM高糖培养基和FBS(Gibco公司,美国),HOXA4 siRNA载体质粒(Vigene公司,美国),慢病毒包装体系(北京英茂盛业生物科技有限公司),AxyPrep质粒DNA小量试剂盒(Axygen公司,美国),HOXA4、CTNNB1和Gsk3β PCR引物(上海生工生物工程股份有限公司),HOXA4抗体(美国Santa Cruz公司),β-catenin、Gsk3β、CyclinD1和p53抗体(武汉博士德生物技术公司)。荧光定量PCR仪(Applied Biosystems公司,美国),倒置光学显微镜(Nikon公司,日本)。
1.2 人胶质瘤U251细胞培养和慢病毒转染人胶质瘤U251细胞购于中国科学院上海细胞所,常规培养于DMEM高糖培养基(内含10% FBS、100 U·L-1青霉素和100 mg·L-1链霉素),置于37℃、5% CO2培养箱中。HOXA4 siRNA载体质粒和阴性对照质粒转化E.coil TG1感受态细胞后进行质粒扩增,小剂量提取质粒DNA后按照慢病毒包装体系操作对U251细胞进行Polyfect-V转染。48~72 h后观察绿色荧光蛋白(GFP)表达情况,感染率=(表达GFP的细胞数/总细胞数)× 100%,感染率大于90%即为成功建立稳转细胞。U251细胞稳转HOXA4 siRNA后命名为si-HOXA4,U251细胞稳转阴性对照后命名为si-NC。si-HOXA4上游引物:5′-CGCCCGCCTACACCCGGCAGCACTCGAGTGCTGCCGGGTGTAG- GCGGTTTTTTA-3′;下游引物:5′-CGCGTAA- AAAACCGCCTACACCCGGCAGCACTCGAGT- GCTGCCGGGTGTAGGCGGGCGAT-3′。
1.3 人胶质瘤荷瘤裸鼠模型的建立及分组9只4~6周龄雌性BALB/c裸鼠购于中国上海斯莱克实验动物有限公司,SPF级。取对数生长期U251、si-NC和si-HOXA4细胞,将细胞用灭菌PBS重悬浮,使细胞密度为1×107 mL-1,采用1 mL注射器细胞吸取100 μL细胞悬液,分别接种于裸鼠颈背部皮下,每种细胞接种3只裸鼠并分组命名为对照组、si-NC组和si-HOXA4组。每3~4 d观察裸鼠肿瘤生长情况,并使用游标卡尺测量肿瘤的体积,肿瘤体积=(长×宽2)/2。培养21 d后荷瘤裸鼠断颈处死,剥离颈背部皮下肿瘤组织,肿瘤称质量。部分肿瘤组织置于液氮中保存用于RNA检测,部分组织以甲醛固定后用于蛋白检测。
1.4 qRT-PCR法检测各组裸鼠肿瘤组织中HOXA4、CTNNB1和Gsk3β mRNA相对表达量TRIzol试剂一步法提取组织总RNA,以该RNA为模板使用HiFi-MMLV cDNA第1链合成试剂盒将RNA逆转录为cDNA,对cDNA进行qRT-PCR检测,反应条件为95℃、10 min,95℃、15 s,58℃、30 s,72℃、30 s,共40个循环,结果计算采用2-ΔΔCt方法。内参管家基因为β-actin。HOXA4上游引物:5′-GATAAACTCCAACTACATCG-3′,HOXA4下游引物:5′-GTAGTAGGAGGCAGTGGGCT-3′;CTNNB1上游引物:5′-GGAATGAAGGCGTGGCAACAT- AC-3′,CTNNB1下游引物:5′-GGCGATATCCAAGGGCTTCTCC-3′;Gsk3β上游引物:5′-AT GCCACAGCAGCGTCAG-3′,GSK3β下游引物e:5′-GGTCTGTCCACGGTCTCC-3′;β-actin上游引物:5′ -GGCACCACACCTTCTACAAT-3′,β-actin下游引物:5′-GTGGTGGTGAAGCTGT- AGCC-3′。
1.5 免疫组织化学(IHC)法检测各组裸鼠肿瘤组织中Wnt/β-catenin信号道路相关蛋白(HOXA4、β-catenin、Gsk3β、CyclinD1和P53蛋白)表达水平3~4 μm石蜡切片经65℃烤片2 h后,以二甲苯脱蜡,梯度乙醇水化,3%过氧化氢浸泡阻断内源性过氧化物酶,柠檬酸高压修复,切片放湿盒内加入一抗孵育45 min,PBS洗涤后加入辣根过氧化物酶标记的二抗孵育30 min,DAB显色,苏木素复染。采用ImagePro Plus 6.0软件检测蛋白平均吸光度(A)值,以A值代表各种蛋白表达水平。
1.6 统计学分析采用GraphPad Prism 5.0软件绘制统计图。采用SPSS 19.0统计软件进行统计学分析。各组裸鼠肿瘤体积和质量,各组裸鼠肿瘤组织中HOXA4、CTNNB1和Gsk3β mRNA相对表达量,各组裸鼠肿瘤组织中HOXA4、β-catenin、Gsk3β、CyclinD1和P53蛋白表达水平以x ±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
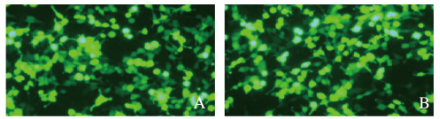
2 结果 2.1 慢病毒转染后U251细胞中GFP表达和感染率HOXA4 siRNA载体质粒和阴性对照质粒经慢病毒转染至U251细胞后,si-HOXA4和si-NC细胞中均有绿色荧光表达,感染率均大于90%。见图 1(插页一)。
|
| 图 1 荧光显微镜观察si-HOXA4组(A)和si-NC组(B)细胞中GFP的表达(×200) Fig. 1 Expressions of GFP in cells in si-HOXA4 (A) and si-NC (B) groups observed under fluorescence microscope(×200) |
|
|
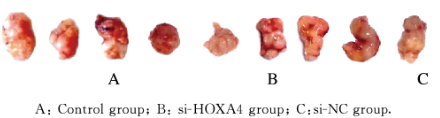
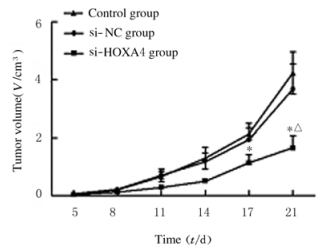
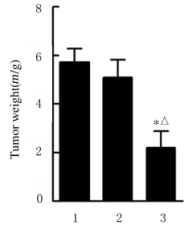
裸鼠颈背部皮下注射U251、si-NC和si-HOXA4细胞,人胶质瘤荷瘤裸鼠均成活并在注射后5 d可见瘤体形成。见图 2(插页一)。注射后11和14 d si-HOXA4组裸鼠肿瘤体积较si-NC组减小,但组间比较差异无统计学意义(P>0.05);注射后17d,si-HOXA4组裸鼠肿瘤体积[(1.13±0.29)cm3]明显小于si-NC组[(1.94±0.16)cm3](P < 0.05)。注射后21dsi-HOXA4组裸鼠肿瘤体积[(1.65±0.42)cm3]、肿瘤质量[(2.20±0.69)g]明显小于对照组[(4.23±0.72)cm3、(5.71±0.57)g]和si-NC组[(3.67± 0.88)cm3、(5.09±0.73)g] (P < 0.05)。见图 3和4。
|
| 图 2 3组荷瘤裸鼠肿瘤组织形态表现(Bar=3cm) Fig. 2 Morphology of tumor tissue of nude mice in three groups(Bar= 3 cm) |
|
|
|
| * P < 0.05 vs si-NC group; △P < 0.05 vs control group. 图 3 3组裸鼠肿瘤生长曲线 Fig. 3 Tumor growth curves of nude mice in three groups |
|
|
|
| * P < 0.05 vs si-NC group; △P < 0.05 vs control group. 图 4 注射后21 d时3组裸鼠肿瘤质量 Fig. 4 Tumor weights of nude mice in three groups 21 dafter injection |
|
|
si-HOXA4组裸鼠肿瘤组织中HOXA4、CTNNB1和Gsk3β mRNA相对表达量分别为0.31±0.04、0.49±0.11和1.06±0.12;与si-NC组比较,si-HOXA4组裸鼠肿瘤组织中HOXA4和CTNNB1相对表达量明显降低(P < 0.05),而Gsk3β相对表达量比较差异无统计学意义(P>0.05)。见图 5。
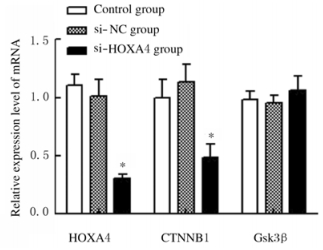
|
| *P < 0.05 vs si-NC group. 图 5 3组裸鼠肿瘤组织中HOXA4、CTNNB1和Gsk3β mRNA相对表达量 Fig. 5 Relative expression amounts of HOXA4, CTNNB1 and Gsk3β mRNA in tumor tissue of nude mice in three groups |
|
|
与si-NC组比较,si-HOXA4组裸鼠肿瘤组织中HOXA4、β-catenin和CyclinD1表达水平明显降低(P < 0.05),而Gsk3β和P53蛋白表达水平升高(P < 0.05)。见图 6。IHC法检测3组裸鼠肿瘤组织中Wnt/β-catemin信号通路蛋白表达见图 7(插页一)。
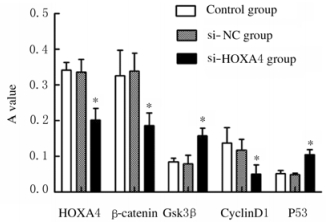
|
| *P < 0.05 vs si-NC group. 图 6 3组裸鼠肿瘤组织中Wnt/β-catenin信号通路相关蛋白表达水平 Fig. 6 Expression levels of Wnt/β-catenin signaling pathway-related proteins in tumor tissue of nude mice in three groups |
|
|
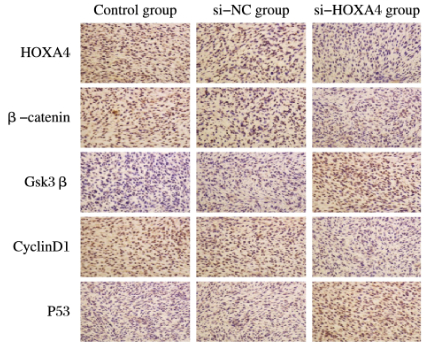
|
| 图 7 3组荷瘤裸鼠肿瘤组织中Wnt/B-catenin信号通路相关蛋白的表达(免疫组织化学,×100) Fig. 7 Expressions of proteins related to W nt/ β catenin signaling pathway in tumorr tissue of nudein three mice groups(Immunohistochemistry, ×100) |
|
|
胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,由于侵袭性高、增殖速度快,使得全切手术困难;其对化疗药物替莫唑胺的耐药性致使患者预后差、复发率高,严重影响患者的生存质量和生存期[1, 9]。随着分子病理学和影像学[10]的发展,研究者们更深入地理解与胶质瘤发生发展相关的基因和信号通路,进一步发掘适宜的靶点基因,并在此基础上开拓胶质瘤诊治的新策略。HOX基因含有可编码同源结构域的高度保守序列,编码螺旋-转角-螺旋结构的蛋白产物,其可作为转录调节因子与靶基因DNA序列特异性结合起调控作用[11-12],HOXA9[13]、HOXA13[14]、HOXC11[15]和HOXD8[16]异常表达与胶质瘤的发生发展密切相关。本课题组前期研究[8]显示:HOXA4在人胶质瘤组织中通过影响细胞增殖、克隆、周期、凋亡率和侵袭能力发挥致瘤性。本实验通过慢病毒转染建立荷瘤裸鼠模型并对HOXA4在体内的作用进行了研究,发现HOXA4低表达能够明显抑制肿瘤的生长。Wnt/β-catenin信号通路作为一种在进化中高度保守的信号通路,在胚胎发育过程中对细胞的分化起决定性作用,并且在成熟细胞的多种生理进程中也起到至关重要的影响作用。Wnt/β-catenin信号通路的异常调节可导致多种疾病,在包括胶质瘤在内多种肿瘤的发生发展中起作用[17]。经典Wnt/β-catenin信号通路中Wnt分泌蛋白通过Frizzled家族跨膜受体蛋白和Dsh/Dvl松散蛋白将信号传至Gsk3β,Gsk3β磷酸化后导致“APC-Axin-Gsk3β复合物”无法形成,阻断了β-catenin蛋白的降解,β-catenin蛋白胞质内聚集并进入核内,与TCF/LEF结合后可调控靶基因发挥生物学作用[18]。本研究证明HOXA4通过转录调控作用上调β-catenin蛋白的表达水平从而激活Wnt信号通路。另一个信号关键蛋白Gsk3β表达水平在HOXA4表达抑制后升高,但其mRNA表达水平未见异常,原因考虑为HOXA4表达抑制后β-catenin蛋白表达下降反馈于“APC-Axin-Gsk3β复合物”的合成,导致游离Gsk3β蛋白表达水平升高,佐证HOXA4调控机制未作用于Wnt/β-catenin信号通路Gsk3β蛋白。而在Wnt/β-catenin信号通路下游研究[19]中发现β-catenin与TCF/LEF结合形成复合物后可作用于CyclinD1启动子,导致CyclinD1表达上调。CyclinD1作为细胞周期基因,其主要功能是促进细胞增殖。本文作者发现HOXA4表达抑制后,CyclinD1蛋白表达水平降低,提示CyclinD1基因参与了胶质瘤HOXA4表达下降后细胞增殖和周期阻滞作用。研究[20]显示:p53作为Wnt/β-catenin信号通路下游靶基因,可通过促进细胞凋亡在不同肿瘤中发挥作用,而且p53已明确参与胶质瘤的发病并可作为胶质瘤基因诊断依据。本研究结果显示:HOXA4表达抑制后P53蛋白表达水平升高,提示p53基因参与了胶质瘤HOXA4表达异常后的促癌作用。
综上所述,抑制HOXA4的表达可在体内通过Wnt/β-catenin信号通路调控CyclinD1和P53的表达,从而抑制人胶质瘤荷瘤裸鼠肿瘤的生长。
| [1] | WELLER M, VANDENBENT M, HOPKINS K, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma[J]. Lancet Oncol, 2014, 15(9): e395–e403. DOI:10.1016/S1470-2045(14)70011-7 |
| [2] | SHAH N, SUKUMAR S. The Hox genes and their roles in oncogenesis[J]. Nat Rev Cancer, 2010, 10(5): 361–371. DOI:10.1038/nrc2826 |
| [3] | TANG X, JIANG J, ZHU J, et al. HOXA4-regulated miR-138 suppresses proliferation and gefitinib resistance in non-small cell lung cancer[J]. Mol Genet Genomics, 2019, 294(1): 85–93. DOI:10.1007/s00438-018-1489-3 |
| [4] | BHATLEKAR S, ERTEL A, GONYE G E, et al. Gene expression signatures for HOXA4, HOXA9, and HOXD10 reveal alterations in transcriptional regulatory networks in colon cancer[J]. J Cell Physiol, 2019, 234(8): 13042–13056. DOI:10.1002/jcp.v234.8 |
| [5] | KLAUSEN C, LEUNG P C, AUERSPERG N. Cell motility and spreading are suppressed by HOXA4 in ovarian cancer cells:possible involvement of beta1 integrin[J]. Mol Cancer Res, 2009, 7(9): 1425–1437. DOI:10.1158/1541-7786.MCR-08-0466 |
| [6] | CHENG S, QIAN F, HUANG Q, et al. HOXA4, down-regulated in lung cancer, inhibits the growth, motility and invasion of lung cancercells[J]. Cell Death Dis, 2018, 9(5): 465. DOI:10.1038/s41419-018-0497-x |
| [7] | FOURNIER M, LEBERT-GHALI C E, BIJL J J. HOXA4 provides stronger engraftment potential to short-term repopulating cells than HOXB4[J]. Stem Cells Dev, 2015, 24(20): 2413–2422. DOI:10.1089/scd.2015.0063 |
| [8] | 韩亮, 周海霞, 田男, 等. HOXA4基因抑制对胶质瘤细胞U251的影响[J]. 中国微侵袭神经外科杂志, 2016, 21(7): 321–324. |
| [9] | ALIFIERIS C, TRAFALIS D T. Glioblastoma multiforme:Pathogenesis and treatment[J]. Pharmacol Ther, 2015, 152(6): 63–82. |
| [10] | LI C, CAMPBELL B K, LIU Y, et al.A fast nulti-layer boundary element method for direct numerical simulation of sound propagation in shallow water enviroments[OJ/L].J Comput Phys, 2019, 392: 694-712[2019-05-17].https: //doi.org.10.1016/j.jcp.2019.04.068. |
| [11] | HOLLAND P W, BOOTH H A, BRUFORD E A. Classification and nomenclature of all human homeobox genes[J]. BMC Biol, 2007, 5(1): 47. DOI:10.1186/1741-7007-5-47 |
| [12] | 张艳霞, 李跃辉, 张丽红, 等. 沉默HOXA13基因对肝癌HepG2和QGY-7703细胞恶性表型的影响[J]. 吉林大学学报:医学版, 2018, 44(2): 315–320. |
| [13] | COSTA B M, SMITH J S, CHEN Y, et al. Reversing HOXA9 oncogene activation by PI3K inhibition:epigenetic mechanism and prognostic significance in human glioblastoma[J]. Cancer Res, 2010, 70: 453–462. DOI:10.1158/0008-5472.CAN-09-2189 |
| [14] | DUAN R, HAN L, WANG Q, et al. HOXA13 is a potential GBM diagnostic marker and promotes glioma invasion by activating the Wnt and TGF-β pathways[J]. Oncotarget, 2015, 6(29): 27778–27793. |
| [15] | ZHANG X, HAMADA J, HISHIMOTO A, et al. HOXC6 and HOXC11 increase transcription of S100beta gene in BrdU-induced in vitro differentiation of GOTO neuroblastoma cells into Schwannian cells[J]. J Cell Mol Med, 2007, 11: 299–306. DOI:10.1111/jcmm.2007.11.issue-2 |
| [16] | MANOHAR C F, SALWEN H R, FURTADO M R, et al. Up-regulation of HOXC6, HOXD1, and HOXD8 homeobox gene expression in human neuroblastoma cells following chemical induction of differentiation[J]. Tumour Biol, 1996, 17: 34–47. DOI:10.1159/000217965 |
| [17] | KRIMPENFORT P, BERNS A. Wnt down, tumors wind up[J]. Cell, 2015, 161(7): 1494–1496. DOI:10.1016/j.cell.2015.06.008 |
| [18] | TSAI B P, HIVERTERN P, WATERMAN M L. Blending hippo and WNT:sharing messengers and regulation[J]. Cell, 2012, 151(7): 1401–1403. |
| [19] | TETSU O, MCCORMICK F. β-catenin regulates expression of cyclin D1 in colon carcinoma cells[J]. Nature, 1999, 398(6726): 422–426. DOI:10.1038/18884 |
| [20] | KUO T L, CHENG K H, SHAN Y S, et al. β-catenin-activated autocrine PDGF/Src signaling is a therapeutic target in pancreatic cancer[J]. Theranostics, 2019, 9(2): 324–336. DOI:10.7150/thno.28201 |
 2019, Vol. 45
2019, Vol. 45


