扩展功能
文章信息
- 李娜, 周丽婷, 朱健, 于光艳, 叶琳
- LI Na, ZHOU Liting, ZHU Jian, YU Guangyan, YE Lin
- 塑化剂邻苯二甲酸二(2-乙基己)酯对雌性大鼠子宫组织的毒性作用
- Toxic effect of plasticizer DEHP on uterus tissue of female rats
- 吉林大学学报(医学版), 2019, 45(03): 469-473
- Journal of Jilin University (Medicine Edition), 2019, 45(03): 469-473
- 10.13481/j.1671-587x.20190301
-
文章历史
- 收稿日期: 2018-10-31
2. 海南医学院热带医学研究院, 海南 海口 570100
2. Institute of Tropical Medicine, Hainan Medical University, HaiKou 570100, China
近年来,我国塑化剂污染问题日趋严重。塑化剂事件在国内不断出现,食品、保健品、药品和白酒等安全风波持续蔓延。深入系统地研究塑化剂的毒性机制,提高民众对禁用塑化剂的安全意识,已成为学者亟待解决的问题。邻苯二甲酸二(2-乙基己)酯[di(2-ethylhexyl) phthalate,DEHP]作为增塑剂被广泛应用[1],约占塑化剂总产量的50% [2]。在塑料制品中DEHP与塑料基质之间以氢键或范德华力连接,彼此保持独立的化学性质,因此极易溶出,直接进入人体或者外环境,造成对空气、水和土壤的污染[3]。DEHP具有雌激素样作用,可影响机体正常激素分泌,对生物的生殖系统造成损害[4-5]。目前,DEHP暴露对雌性生殖系统的影响成为生殖毒理学研究的新领域, 同时也面临很多挑战。动物毒理学研究[6-7]显示:DEHP能够减轻雌性动物子宫和卵巢质量,促使子宫内膜血管扩张,促进子宫基质细胞发生增殖。流行病学调查[8]显示:女性DEHP暴露可导致妊娠率降低和流产率升高。一项前瞻性病例对照研究[9]显示:女性血浆中DEHP剂量与子宫内膜异位症发生率呈正相关关系。尽管已有相关报道,但DEHP的雌性生殖毒性研究较少,且作用机制尚不明确。本研究采用体内实验观察DEHP暴露对雌性大鼠子宫组织形态和子宫组织激素受体表达的影响,为全面评价DEHP的毒理学作用及其对人类生殖系统潜在的危害提供科学依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器选择清洁级健康成年雌性Wistar大鼠48只,2~3个月龄,体质量(200±20)g。经阴道脱落细胞涂片筛查,性周期正常,由吉林大学实验动物中心提供,动物许可证号:SCXK-(吉)2007-0003。大鼠适应性饲养1周,饲养环境温度为(20±2)℃,湿度为(50±20)%,自由饮水摄食。将雌性大鼠随机分为对照组(玉米油)、低剂量DEHP组(300 mg·kg-1·d-1,1/100LD50)、中剂量DEHP组(1 000 mg·kg-1·d-1,1/30LD50)和高剂量DEHP组(3 000 mg·kg-1·d-1,1/10LD50),每组12只。每天灌胃1次,每周6 d,连续染毒4周。
DEHP(国药集团化学试剂有限公司),SABC试剂盒和DAB kit酶底物显色剂(福建福州迈新生物技术开发公司),卵泡刺激素受体(follicle-stimulating hormone receptor, FSHR)和促黄体生成激素受体(luteinizing hormone receptor, LHR)(北京博奥森生物技术公司)。光学显微镜(日本Olympus公司),微量移液器(德国Eppendorf公司)。
1.2 大鼠动情周期观察以生理盐水润湿棉签,取阴道脱落细胞均匀涂抹于载玻片,自然干燥,甲醇固定10 min,室温干燥,Giemsa染色10 min,流水冲洗,并使之干燥。按照雌性大鼠动情周期判断标准[10]确定大鼠动情周期。动情前期(proestrus,P):可见大量有核上皮细胞,少量角化上皮细胞;动情期(estrus,E):无核角化鳞状细胞由散在增至集块;动情后期(metaestrus,M):角化上皮细胞减少、堆积,有核上皮细胞及无数白细胞;动情间期(anestrus,A):可见大量白细胞和黏液。
1.3 各组大鼠子宫脏器系数测定动情间期处死大鼠,无菌条件下,采用眼科镊和剪刀分离子宫,称脏器湿重,计算脏器系数。脏器系数=脏器湿重/体质量×100%。
1.4 各组大鼠子宫组织病理形态表现观察以10%中性甲醛溶液固定各组大鼠子宫组织,石腊脱水包埋,组织块行5 μm切片,58℃烤片2 h,HE染色,封片,光镜下观察各组大鼠子宫组织病理形态表现。
1.5 各组大鼠子宫组织中FSHR和LHR表达水平检测采用SABC法检测大鼠子宫组织中FSHR和LHR表达水平。切片常规脱蜡至水,高压修复,加入一抗(兔抗鼠多克隆抗体)、二抗、DAB显色,苏木精复染,脱水,中性树脂封片。
结果判定:与对照组比较,DEHP组大鼠子宫组织细胞胞浆呈棕黄色为胞浆染色阳性细胞。每个视野通过Image-Pro Plus 6.0(IPP 6.0)医学图像分析系统进行半定量分析,随机选择5个视野,测定阳性细胞平均吸光度(absorbence, A)值,以A值表示FSHR和LHR表达水平。
1.6 质量控制雌性大鼠阴道脱落细胞涂片和子宫组织病理切片的镜下观察均采用盲片法。
1.7 统计学分析采用SPSS 13.0统计软件进行统计学分析。各组大鼠体质量、子宫脏器系数和子宫组织中FSHR及LHR表达水平均以x±s表示。多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠体质量染毒第1周,各组大鼠体质量比较差异无统计学意义(P>0.05);染毒第2和3周,中和高剂量DEHP组大鼠体质量明显小于对照组和低剂量DEHP组(P<0.05);染毒第4周,低、中和高剂量DEHP组大鼠体质量较对照组明显降低(P<0.05),并且随着染毒剂量的增加,大鼠体质量逐渐降低,呈现明显的剂量-效应关系。见图 1。
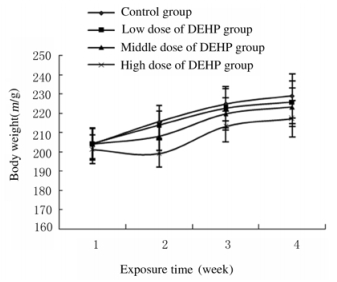
|
| 图 1 DEHP作用不同时间各组大鼠体质量 Fig. 1 Body weights of rats in various groups after treated with DEHP for different time |
|
|
对照组和低、中及高剂量DEHP组大鼠子宫脏器系数分别为18.891±5.077、19.226±3.741、19.702±6.829和18.088±7.947,各组大鼠子宫脏器系数比较差异均无统计学意义(P>0.05)。
2.3 各组大鼠子宫组织病理形态表现 2.3.1 肉眼表现肉眼可见对照组大鼠子宫形态正常,中和高剂量DEHP组大鼠子宫扭曲、管壁变薄,管腔内有大量黄色或清亮液体,并呈重度扩张;子宫浆膜面可见不同程度的积水、充血和肿胀现象,颜色多暗红。见图 2(插页一)。
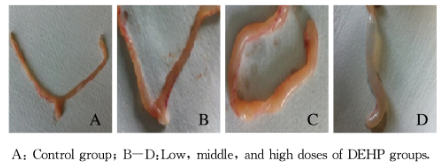
|
| 图 2 各组大鼠子宫大体形态 Fig. 2 General morphology of uterus of rats in various groups |
|
|
对照组大鼠子宫组织结构正常,管径均匀,子宫壁内膜、肌层及外膜组织轮廓清楚。与对照组比较,各剂量DEHP组大鼠子宫内膜出现不同程度的胞核假复层现象,可见内膜薄厚不均,上皮增生和内皮纤维化;固有层腺体数减少,部分腺体发生萎缩;腔上皮细胞排列不整齐、疏松,细胞核大小不均。箭头所指为出现上皮增生和胞核假复层现象。见图 3(插页一)。
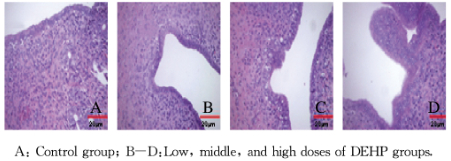
|
| 图 3 各组大鼠子宫组织形态表现(HE, X400) Fig. 3 Morphology of uterus tissue of rats in various groups |
|
|
经显色剂3, 3-二氨基联苯胺(DAB)显色后FSHR和LHR呈棕黄色颗粒状,在子宫中主要位于子宫内膜腔上皮和间质细胞的胞质中。与对照组比较,各剂量DEHP组大鼠子宫组织中免疫组织化学染色程度减弱,面积减小。见图 4(插页一)。

|
| 图 4 各组大鼠子宫组织中FSHR和LHR的表达(免疫组织化学,×400) Fig. 4 Expressions of FSHR and LHR in uterus tissue of rats in various groups(Immunohistochemistry, ×400) |
|
|
大鼠子宫组织中FSHR表达水平随DEHP剂量增加逐渐降低,但组间比较差异无统计学意义(P>0.05)。与对照组比较,各剂量DEHP组大鼠子宫组织中LHR表达水平明显降低(P<0.05);中和高剂量DEHP组大鼠子宫组织中LHR表达水平明显低于低剂量DEHP组(P<0.05)。见表 1。
| (n=12, x±s) | ||||
| Group | Dose (mg·kg-1) |
FSHR | LHR | |
| Control | 0 | 0.21±0.02 | 0.21±0.01 | |
| DEHP | ||||
| Low dose | 300 | 0.20±0.01 | 0.17±0.01* | |
| Middle dose | 1 000 | 0.19±0.02 | 0.14±0.01*△ | |
| High dose | 3 000 | 0.20±0.01 | 0.14±0.02*△ | |
| *P<0.05 vs control group; △P<0.05 vs low dose of DEHP group. | ||||
子宫作为雌性动物主要的生殖器官,是产生月经和孕育胎儿的场所。由于体内或外源性雌激素的持续增多,例如环境毒素暴露,可导致子宫内膜组织形态学及功能学的异常变化,进而诱导机体子宫内膜异位症形成。因此,研究DEHP暴露对子宫组织形态和功能的影响,对预防和治疗现代社会女性子宫肿瘤疾病具有重要意义。
CHA等[6]将成年CD-1雌性小鼠暴露于含有1 330 g·L-1DEHP饮用水中的实验发现:DEHP可减轻子宫质量。有学者[11]发现:雌性Wistar大鼠宫内给药和哺乳期DEHP经口给药,大鼠子代子宫质量和脏器系数未见明显改变。雌性狨猴经DEHP(0~2 500 mg·kg-1)灌胃染毒,染毒组狨猴子宫质量明显增加,但病理组织形态未见异常改变[12]。本研究结果显示:各剂量DEHP组大鼠子宫脏器系数比较差异无统计学意义。目前,DEHP对雌性啮齿动物子宫质量的毒性作用研究结果不一,有待进一步探讨。
RICHARDSON等[7]发现:CD-1雌性小鼠经口暴露DEHP (200 μg·kg-1)后,小鼠子宫上皮细胞增殖率明显降低,子宫腺体和基质细胞增殖率明显升高,可见子宫内膜血管扩张现象。SOMASUNDARAM等[13]发现:成年雌性大鼠经口给予DEHP,实验组大鼠子宫组织学表现为腺上皮直径减小、上皮层变薄、破坏等结构异常改变。本研究结果显示:各剂量DEHP组大鼠子宫内膜出现胞核假复层现象,上皮增生和内皮纤维化,可见固有层腺体数减少,部分腺体萎缩,子宫腔上皮细胞排列不整齐、疏松,细胞核大小不均。由于子宫受性激素调控,因此推测DEHP对子宫的损伤作用可能是性激素紊乱所致,也不排除DEHP对子宫造成了直接的损伤。
本课题组前期研究[14]显示:DEHP能够影响雌性小鼠性激素分泌水平。激素的生物学效应主要通过特异性受体介导,与靶细胞上特定的受体结合是激素发挥其生物学效应的关键和前提[15-16]。本研究结果显示:镜下FSHR和LHR阳性细胞主要位于子宫内膜腔上皮和间质细胞的胞质中,各剂量DEHP组大鼠子宫组织中免疫组织化学染色程度减弱,面积减小。半定量分析结果显示:与对照组比较,各剂量DEHP组大鼠子宫组织中LHR表达水平明显降低;FSHR表达水平随剂量增加呈降低趋势,但组间比较差异无统计学意义。目前,DEHP对子宫组织中FSHR和LHR表达水平的影响研究鲜有报道,因此其具体机制有待深入研究。
综上所述,DEHP可能通过改变雌性大鼠的子宫组织形态和相关性激素受体表达水平,对其生殖器官和生殖内分泌产生影响,具有一定的雌性生殖毒性作用。
| [1] | CHIELLINI F, FERRI M, LATINI G. Physical-chemical assessment of di-(2-ethylhexyl)-phthalate leakage from poly(vinyl chloride) endotracheal tubes after application in high risk newborns[J]. Int J Pharm, 2011, 409(1/2): 57–61. |
| [2] | SAMPSON J, DE KORTE D. DEHP-plasticised PVC:relevance to blood services[J]. Transfus Med, 2011, 21(2): 73–83. DOI:10.1111/tme.2011.21.issue-2 |
| [3] | ZENG F, WEN J, CUI K, et al. Seasonal distribution of phthalate esters in surface water of the urban lakes in the subtropical city, Guangzhou, China[J]. J Hazard Mater, 2009, 169(1-3): 719–725. DOI:10.1016/j.jhazmat.2009.04.006 |
| [4] | BIEMANN R, NAVARRETE SANTOS A, NAVARRETE SANTOS A, et al. Endocrine disrupting chemicals affect the adipogenic differentiation of mesenchymal stem cells in distinct ontogenetic windows[J]. Biochem Biophys Res Commun, 2012, 417(2): 747–752. DOI:10.1016/j.bbrc.2011.12.028 |
| [5] | INADA H, CHIHARA K, YAMASHITA A, et al. Evaluation of ovarian toxicity of mono-(2-ethylhexyl) phthalate (MEHP) using cultured rat ovarian follicles[J]. J Toxicol Sci, 2012, 37(3): 483–490. DOI:10.2131/jts.37.483 |
| [6] | CHA S, JUNG K, LEE M Y, et al. Nonmonotonic effects of chronic low-dose di(2-ethylhexyl) phthalate on gonadal weight and reproductive[J]. Dev Reprod, 2018, 22(1): 85–94. DOI:10.12717/DR.2018.22.1.085 |
| [7] | RICHARDSON K A, HANNON P R, JOHNSON-WALKER Y J, et al. Di (2-ethylhexyl) phthalate (DEHP) alters proliferation and uterine gland numbers in the uteri of adult exposed mice[J]. Reprod Toxicol, 2018, 77: 70–79. DOI:10.1016/j.reprotox.2018.01.006 |
| [8] | SNIJDER C A, ROELEVELD N, Te VELDE E, et al. Occupational exposure to chemicals and fetal growth:the Generation R Study[J]. Hum Reprod, 2012, 27(3): 910–920. DOI:10.1093/humrep/der437 |
| [9] | KIM S H, CHUN S, JANG J Y, et al. Increased plasma levels of phthalate esters in women with advanced-stage endometriosis:A prospective case-control study[J]. Fertil Steril, 2011, 95(1): 357–359. DOI:10.1016/j.fertnstert.2010.07.1059 |
| [10] | LOVEKAMP T N, DAVIS B J. Mono-(2-ethylhexyl) phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells[J]. Toxicol Appl Pharmacol, 2001, 172(3): 217–224. DOI:10.1006/taap.2001.9156 |
| [11] | GRANDE S W, ANDRADE A J, TALSNESS C E, et al. A dose-response study following in utero and lactational exposure to di-(2-ethylhexyl) phthalate (DEHP):reproductive effects on adult female offspring rats[J]. Toxicology, 2007, 229(1/2): 114–122. |
| [12] | TOMONARI Y, KURATA Y, DAVID R M, et al. Effect of di(2-ethylhexyl) phthalate (DEHP) on genital organs from juvenile common marmosets:I. Morphological and biochemical investigation in 65-week toxicity study[J]. J Toxicol Environ Health Part A, 2006, 69(17): 1651–1672. DOI:10.1080/15287390600630054 |
| [13] | SOMASUNDARAM D B, MANOKARAN K, SELVANESAN B C, et al. Impact of di-(2-ethylhexyl) phthalate on the uterus of adult Wistar rats[J]. Hum Exp Toxicol, 2017, 36(6): 565–572. DOI:10.1177/0960327116657601 |
| [14] | LI N, LIU T, ZHOU L T, et al. Di-(2-ethylhcxyl) phthalate reduces progesterone levels and induces apoptosis of ovarian granulosa cell in adult female ICR mice[J]. Environ Toxicol Pharmacol, 2012, 34(3): 869–875. DOI:10.1016/j.etap.2012.08.013 |
| [15] | DIAS J A, COHEN B D, LINDAU-SHEPARD B, et al. Molecular, structural, and cellular biology of follitropin and follitropin receptor[J]. Vitam Horm, 2002, 64: 249–322. DOI:10.1016/S0083-6729(02)64008-7 |
| [16] | 王晓华, 李辉, 李俊, 等. 下调SIRT1表达对子宫内膜癌细胞增殖及凋亡的影响[J]. 郑州大学学报:医学版, 2019, 54(2): 213–217. |
 2019, Vol. 45
2019, Vol. 45


