扩展功能
文章信息
- 张登伟, 刘鹏, 王兆麟, 牟建辉, 孙东, 赵广胜, 刘祥, 王艺澎
- ZHANG Dengwei, LIU Peng, WANG Zhaolin, MOU Jianhui, SUN Dong, ZHAO Guangsheng, LIU Xiang, WANG Yipeng
- 以骨质破坏为主要表现的戈谢病1例报告及文献复习
- Gaucher's disease with bone destruction as main performance: A case report and literature review
- 吉林大学学报(医学版), 2019, 45(02): 430-434
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 430-434
- 10.13481/j.1671-587x.20190239
-
文章历史
- 收稿日期: 2018-12-10
戈谢病(Gaucher’ s disease), 又称葡萄糖脑苷脂沉积病,是一种溶酶体贮积症,属罕见遗传代谢病,为常染色体隐性遗传。戈谢病在德系犹太人中发病率较高(1/400~1/1 000)[1],但在国内仅有单发病例报告,无确切的流行病学统计资料。1964年BRADY等[2]研究发现:葡糖脑苷脂的贮积是由β-葡糖脑苷酯酶(glucerebrosidase,GBA)缺乏所致,为戈谢病的诊断和治疗提供了理论依据。戈谢病病因主要是编码葡萄糖脑苷脂酶的基因异常,导致葡萄糖脑苷脂酶活性降低,葡萄糖脑苷脂分解代谢途径受阻,造成其底物葡萄糖脑苷脂在肝、脾、骨骼、肺、甚至脑的巨噬细胞溶酶体中贮积,激发炎症反应,最终导致受累组织器官出现病变而产生一系列症状。目前已发现有400多种变异,包括点突变、缺失、插入和剪切位点突变等[3-4]。国内相关研究及报道极少,而且多为未成年患者脾功能亢进、血象及个别酶替代治疗相关方面的报道[5]。本文作者分析1例成人以骨质破坏为主要临床表现的Ⅰ型戈谢病患者的临床资料,结合相关文献复习,探讨戈谢病患者的临床表现、并发症、治疗方案、预后及最新相关研究进展,为戈谢病的诊断和治疗提供参考。
1 临床资料 1.1 一般资料患者,男性,49岁,因“右大腿间断性疼痛2年”于2018年3月26日入院。患者陈述戈谢病家族史(图 1),其父母为近亲结婚(表兄妹)且母亲有脾肿大病史(未确诊),患者同胞兄弟姐妹共6人(包括患者本人),患者一位姐姐、一位妹妹及患者本人7年前于北京协和医院确诊为戈谢病(葡萄糖脑苷脂酶活性均不足正常30%),其家族史符合孟德尔常染色隐性遗传规律。患者母亲、姐姐、妹妹脾功能亢进,均已行脾切除治疗。
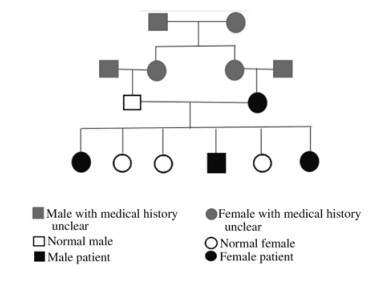
|
| 图 1 戈谢病患者家族遗传系谱图 Fig. 1 Family genetic lineage of a patient with Gaucher's disease |
|
|
患者神志清楚,贫血貌,右大腿疼痛、肿胀,扶拐行走,负重后右大腿疼痛加剧,无表面血管怒张,无异常色素沉着,右下肢较健侧短缩(40年前因髋关节结核于吉林大学第一医院行股骨头切除术),右髋关节活动度较左侧略差。腹部略膨隆,脾脏重度肿大(触诊达脐水平)。
1.3 影像学检查腹部彩超提示患者脾脏厚7 cm, 侧卧肋下平脐,脾脏重度增大。右股骨正侧位X线检查提示溶骨性病变(图 2),右股骨CT(图 3)提示溶骨性改变、大片骨质坏死。全身骨扫描、PET/CT融合显像结果(图 4)提示右侧股骨骨盐代谢异常活跃,局部可见骨质破坏及团块状高密度影,右侧髂骨骨盐代谢异常活跃,局部骨质密度减低。病理穿刺2次,均提示骨组织坏死(图 5,见插页五)。
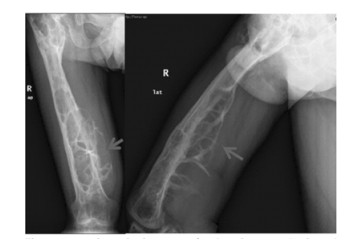
|
| The arrow showed the osteolytic change of the right femur 图 2 戈谢病患者右股骨正侧位X线图像 Fig. 2 X-ray image of right femur of patient with Gaucher 's disease |
|
|
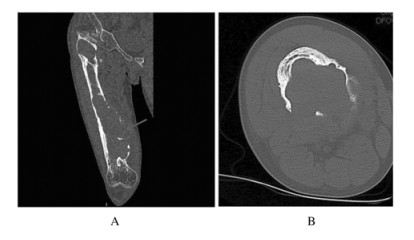
|
| A:Coronal scan; B:Axial CT scan. The arrow showed the osteolytic change and osteonecrosis of the right femur. 图 3 戈谢病患者右股骨CT影像 Fig. 3 CT images of right femur of a patient with Gaucher 's disease |
|
|

|
| The arrow showed the active metabolism of the right femur. 图 4 戈谢病患者全身骨显像(A)和PET/CT(B)影像 Fig. 4 Whole body skeletal SPECT(A) and PET/CT(B) images of a patient with Gaucher's disease |
|
|
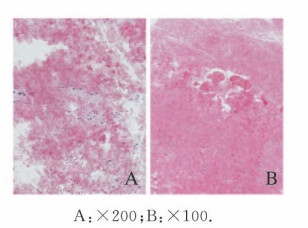
|
| A: X200;B: X100. 图 5 HE染色观察戈谢病患者右股骨组织病理表现 Fig. 5 Pathology of right femoraltissue of patient with Gaucher? s disease observed by HE staining |
|
|
入院查血常规:血小板计数43×109 L-1,血红蛋白90 g·L-1,红细胞压积和白细胞计数均降低。第2次脾栓塞治疗术后1周,复查血常规:血小板计数87×109L-1,血红蛋白91 g·L-1。
1.5 诊断根据2015年中国戈谢病专家共识[4]推荐的葡萄糖脑苷脂酶活性不足正常30%为戈谢病确诊金标准,结合患者家族史(父母近亲结婚)、临床表现、右股骨影像学检查及病理穿刺结果、腹部彩超及血常规,明确诊断为Ⅰ型戈谢病、右股骨骨质破坏和脾功能亢进。
1.6 治疗患者右股骨广泛破坏、疼痛剧烈,酶替代是其目前最有效的治疗方法,常用药物伊米苷酶(商品名:思而赞),50 kg体质量成人每月费用至少5万元,患者无法承担酶替代治疗高昂的费用,拟行病损切除以减轻病痛、改善生活质量。患者伴有脾功能亢进和血小板减少(43×109L-1),为手术禁忌证,分2次先后行脾动脉部分栓塞治疗(第1次栓塞体积为25%、第2次栓塞体积为35%),脾栓塞术后1周复查,血小板计数87×109L-1、血红蛋白91 g·L-1,患肢疼痛缓解。患者认为非肿瘤性骨质破坏,无远处转移顾虑,因经济问题,放弃手术。出院建议避免外伤、减少负重,预防病理性骨折,定期随访。
2 讨论戈谢病属于罕见的遗传代谢病,根据其临床表现分为3型[4-6]:Ⅰ型无原发中枢神经系统受累表现,各个年龄段均可发病,通常发病年龄越小,症状越重,主要表现为肝脾肿大,常伴脾功能亢进,血液学表现为贫血和血小板降低,可伴有白细胞减少、凝血功能异常,多数患者骨骼受累但轻重不一,表现为骨痛、骨坏死、溶骨性改变和病理性骨折[7];Ⅱ型,又称急性神经病变型,除了Ⅰ型症状外,主要为急性神经系统受累表现,进展较快,病死率高,中位生存期为9个月,多数患者4岁前死亡[5, 7-8];Ⅲ型(慢性或亚急性神经病变型)早期表现与Ⅰ型相似,逐渐出现神经系统受累表现,病情进展缓慢,寿命可较长[9]。在国内戈谢病相关报道少,无骨质破坏方面的相关研究。该患者父母近亲结婚(表兄妹),根据患者陈述推测其母亲为戈谢病患者(未确诊),其父亲为戈谢病基因携带者,患者同胞兄弟姐妹共6人(包括患者本人),患者一位姐姐、一位妹妹及患者本人7年前于北京协和医院确诊为戈谢病(葡萄糖脑苷脂酶活性均不足正常30%),其家族系谱图符合孟德尔常染色体隐性遗传规律。患者发病较晚,无神经系统受损表现,首发表现为右股骨骨质破坏,伴脾脏肿大、脾功能亢进,属Ⅰ型戈谢病。
目前,酶替代治疗是Ⅰ型戈谢病患者最有效的治疗方法,能缓解脾功能亢进,控制骨质破坏、骨梗死,预防骨危象及其他部位骨质破坏,但价格昂贵[10],常用药物为伊米苷酶(商品名:思而赞),50 kg体质量成人每月费用至少5万元,需终生用药,长期用药致使机体产生相应抗体,影响疗效。段彦龙等[5]报道:1999年美国Genzyme公司与世界健康基金会设立慈善援助项目,为中国戈谢病患者提供免费的伊米苷酶,全国接受治疗患者共120余例,其中72例在北京市儿童医院,并对北京市儿童医院接受酶替代治疗的72例儿童进行了长达6年的随访,其中Ⅱ和Ⅲ型患者酶替代治疗后,仍有抽搐等神经系统症状,接受长时间酶替代治疗患者血象、脾脏体积和骨痛均有不同程度好转。
2015年中国戈谢病专家共识[4]指出:在不接受酶替代治疗的情况下进行脾脏切除治疗,可能会加重其他系统症状,需长期监测。该患者无法承担酶替代治疗相关费用。患者骨质破坏广泛,为减轻疼痛、提高生活质量,建议患者行右股骨病损切除假体置换,患者脾功能亢进、血小板减少(43×109L-1),为手术禁忌证,故行脾部分栓塞治疗以缓解脾功能亢进而致的血小板降低、贫血,1周后患者血小板计数87×109L-1、血红蛋白91 g·L-1,右下肢疼痛明显减轻。李平等[11]在大鼠模型模拟脾栓塞术后发现外周血单核细胞及NK细胞减少,单核巨噬细胞吞噬功能降低,据此推测患者脾栓塞后骨质浸润戈谢氏细胞(葡萄糖脑苷脂贮积的巨噬细胞)减少并吞噬功能降低,骨质破坏减轻,从而患者疼痛明显减轻,但需进一步证实。该患者自觉疼痛缓解,非肿瘤性骨质破坏,无远处转移顾虑,由于经济问题,放弃手术,选择保守治疗。建议患者出院后定期随访,避免外伤、减少负重,预防病理性骨折。
2012年LEE等[12]证实:对于有神经症状的Ⅱ和Ⅲ型戈谢病患者,由于酶无法通过血脑屏障,酶替代治疗几乎无效。同年WANG等[13]研究发现:药理性分子伴侣在内质网中通过稳定促进酶的正确折叠,使酶不被分解而顺利转运至溶酶体行使功能,对于Ⅱ和Ⅲ型患者具有理想的应用前景,但还处于基础研究阶段。SINGLA等[14]研究通过抑制底物葡萄糖脑苷脂的合成,从而减少贮积导致的细胞破坏,产品N-丁基-1-脱氧野尻霉素已通过美国食品药品监督管理局(FDA)以及欧洲药品评价局(EMEA)认证应用于成人轻症戈谢病患者。另一个治疗方面的探索是细胞治疗,将经过基因修饰或未经修饰的造血干细胞移植、神经干细胞移植、诱导性多功能干细胞直接输入中枢神经系统或移植到大脑外来治疗患者, 对Ⅱ和Ⅲ型患者的神经功能损害有极大应用价值,目前尚处于临床研究阶段[15-17]。有研究者[18-19]报道将含有人类GBA基因的AAV9载体注射入妊娠第16天GBA基因突变的模拟Ⅱ型戈谢病小鼠胎儿颅内,小鼠出生后,其生存和神经功能改善,在新生小鼠做了相同实验,效果不如胎儿时期,2组小鼠仍表现出内脏疾病,随后研究者又将含有人类GBA基因的AAV9载体注射入新生模拟Ⅱ型戈谢病小鼠静脉,发现其内脏和神经症状均有所改善,生存时间延长。
综上所述,对于Ⅰ型戈谢病患者,酶替代治疗是目前最有效的治疗方法,但其价格昂贵,相应的医疗保障体系不完善,临床应用极少。此类疾病罕见、早期症状隐匿,漏诊、误诊及延期诊断率极高,就诊较晚,就诊时已经出现脾脏肿大、脾功能亢进和骨质破坏等晚期症状,主要是成分输血、脾栓塞和病损切除假体置换等对症治疗。Ⅱ和Ⅲ型患者的治疗,目前还处于基础研究阶段。对于此类疾病,基因治疗的前景最为期待。戈谢病由于其多器官损害,致残率极高,所以对这类疾病,预防显得尤为重要,避免近亲结婚,婚前遗传咨询,产前诊断包括胎盘绒毛、羊水细胞培养进行酶活性和基因检测,可避免此类有缺陷患儿出生,减轻家庭和社会负担[5]。
| [1] | SOBREIRA E, PIRES R F, CIZMARIK M, et al. Phenotypic and genotypic heterogeneity in Gaucher disease type1:a comparison between Brazil and the rest-of-the world[J]. Mol GenetMetab, 2007, 90(1): 81–86. |
| [2] | BRADY R O, KANFER J N, SHAPIRO D. Metabolism of glucocerebrosides Ⅱ.Evidence of an enzymatic deficiency in Gaucher's disease[J]. Biochem Biophys Res Commun, 1965, 18: 221–225. DOI:10.1016/0006-291X(65)90743-6 |
| [3] | 刘林玉, 杜司晨, 张进, 等. 戈谢病致病机制及治疗方法[J]. 遗传, 2015, 37(6): 510–516. |
| [4] | 中华医学会儿科学分会遗传代谢内分泌学组, 中华医学会儿科学分会血液学组, 中华医学会血液学分会红细胞疾病(贫血)学组. 中国戈谢病诊治专家共识(2015)[J]. 中华儿科杂志, 2015, 53(4): 256–261. DOI:10.3760/cma.j.issn.0578-1310.2015.04.006 |
| [5] | 段彦龙, 张永红, 臧晏, 等. 酶替代治疗戈谢病72例[J]. 中华儿科杂志, 2006, 44(9): 653–656. DOI:10.3760/j.issn:0578-1310.2006.09.004 |
| [6] | GRABOWSKI G A. Phenotype, diagnosis, and treatment of Gaucher's disease[J]. Lancet, 2008, 372(9645): 1263–1271. DOI:10.1016/S0140-6736(08)61522-6 |
| [7] | WENSTRUP R J, ROCA-ESPIAU M, WEINREB N J, et al. Skeletal aspects of Gaucher disease:a review[J]. Br J Radiol, 2002, 75: A2–A12. DOI:10.1259/bjr.75.suppl_1.750002 |
| [8] | CHAN A, HOLLERAN W M, FERGUSON T, et al. Skin ultrastructural findings in type 2 Gaucher disease:diagnostic implications[J]. Mol Genet Metab, 2011, 104(4): 631–636. DOI:10.1016/j.ymgme.2011.09.008 |
| [9] | ELSTEIN D, ABRAHAMOV A, ALTARESCU G, et al. Evolving features in type 3 Gaucher disease on long-term enzyme replacement therapy[J]. Blood Cells Mol Dis, 2013, 50(2): 140. DOI:10.1016/j.bcmd.2012.09.008 |
| [10] | KHALIFA A S, TANTAWY A A, SHAWKY R M, et al. Outcome of enzyme replacement therapy in children with Gaucher disease:The Egyptian experience[J]. Egypt J Med Human Genet, 2011, 12(1): 9–14. DOI:10.1016/j.ejmhg.2011.02.008 |
| [11] | 李平, 袁弥满, 蔡则骥, 等. 大鼠部分脾栓塞后脾脏巨噬细胞吞噬功能的定量测定[J]. 华中医学杂志, 2001, 25(6): 318–319. |
| [12] | LEE J Y, LEE B H, KIM G H, et al. Clinical and genetic characteristics of Gaucher disease according to phenotypic subgroups[J]. Korean J Pediatr, 2012, 55(2): 48–53. DOI:10.3345/kjp.2012.55.2.48 |
| [13] | WANG G N, TWIGG G, BUTTERS T D, et al. Synthesis of N-substituted E-hexonolactams as pharmacological chaperones for the treatment of N370S mutant Gaucher disease[J]. Org Biomol Chem, 2012, 10(15): 2923–2927. DOI:10.1039/c2ob06987c |
| [14] | SINGLA M, ARIVARASAN K, DHIR V, et al. Medical image.an unusual cause of massive splenomegaly in an adult.Gaucher's disease[J]. N Z Med J, 2012, 125(1361): 98–101. |
| [15] | SELDEN N R, UZRI A, HUHN S L, et al. Central nervoussystem stem eell transplantation for children with neuronal ceroid lipofuscinosis[J]. J Neurosurg Pediatr, 2013, 11(6): 643–652. DOI:10.3171/2013.3.PEDS12397 |
| [16] | ENQUIST I B, NILSSON E, OOKA A, et al. Effective cell and gene therapy in a murine model of Gaucher disease[J]. Proc Natl Acad Sci USA, 2006, 103(37): 13819–13824. DOI:10.1073/pnas.0606016103 |
| [17] | TISCORNIA G, VIVAS E L, MATALONGA L, et al. Neuronopathic Gaucher's disease:induced pluripotent stem cells for disease modelling and testing chaperone activity of small compounds[J]. Hum Mol Genet, 2013, 22(4): 633–645. |
| [18] | MASSARO G, MATTAR C N Z, WONG A M S, et al. Fetal gene therapy for neurodegenerative disease of infants[J]. Nat Med, 2018. DOI:10.1038/s41591-018-0106-7 |
| [19] | MATTAR C N, ANDREW M S, HOEFER K, et al. Systemic gene delivery following intravenous administration of AAV9 to fetal and neonatal mice and late-gestation nonhuman primates[J]. FASEB J, 2015, 29(9): 3876–3888. DOI:10.1096/fj.14-269092 |
 2019, Vol. 45
2019, Vol. 45


