扩展功能
文章信息
- 刘伽莹, 田畅, 丛珊, 赵敏, 王珂
- LIU Jiaying, TIAN Chang, CONG Shan, ZHAO Min, WANG Ke
- 以双肺肺大泡为肺部影像学表现的干燥综合征1例报告及文献复习
- Sjogren's syndrome with pulmonary bullae in both lungs as lung imaging performance: A case report and literature review
- 吉林大学学报(医学版), 2019, 45(02): 414-417
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 414-417
- 10.13481/j.1671-587x.20190235
-
文章历史
- 收稿日期: 2018-11-20
干燥综合征(Sjogren’s syndrome, SS)是一种慢性炎症性自身免疫病。由于其免疫性炎症反应主要表现在外分泌腺体的上皮细胞,故又名自身免疫性外分泌腺体上皮细胞炎或自身免疫性外分泌病。SS分为原发性和继发性两类。继发性SS是指发生于另一诊断明确的结缔组织病或特殊病毒感染等基础上的SS,如系统性红斑狼疮(SLE)和类风湿关节炎(RA)等继发的SS。原发性SS(primary SS, pSS)属全球性疾病,在我国,人群的患病率为0.29%~0.77%,以中年女性多见[1]。SS累及肺部时,以肺部间质性改变较为常见,但以双肺肺大泡为影像学表现的病例较少,目前国内近10年只有2例类似报道[2-3]。SS因缺乏特异性临床表现,临床上常常被忽视并漏诊。本文作者收治1例以双肺肺大泡为肺部影像学表现的SS患者,搜集其相关临床资料,及时行支气管镜及病理检查,并进行相关文献复习,做到早诊断、早治疗,及时改善了患者症状,进一步提高了临床医生对SS诊治的认识。
1 临床资料 1.1 一般资料患者,女性,23岁,因“呼吸困难1个月,咳血3d”于2017年10月30日收入吉林大学第二医院呼吸与危重症医学科。该患者于入院前1个月前无明显诱因出现呼吸困难,活动后为著,夜间可平躺,无憋醒,因未影响日常生活未进行治疗。入院前3d出现晨起咳血、呈鲜红色,入院时患者间断咳嗽、咳白色泡沫样痰,痰中有血丝。病程中患者有胸闷、气短,偶有头晕,无乏力、低热,无明显关节疼痛、皮疹等,有明显口干、眼干。既往:体健。无吸烟史及大量饮酒史。
1.2 查体体温36.9℃,脉搏80 min-1,呼吸18 min-1,血压120/80mmHg。一般状态尚可,意识清楚,自主体位,全身皮肤及黏膜无黄染、皮疹及出血点,无肝掌及蜘蛛痣。猖獗齿,现存留4枚正常牙齿。全身淋巴结未触及肿大。胸廓对称,肋间隙无增宽或缩窄,两侧呼吸运动对称,触觉语颤无明显减弱或增强,双肺叩诊呈清音,双肺呼吸音粗,双肺未闻及明显的干、湿啰音及胸膜摩擦音。心率80 min-1,律齐,心音正常,各瓣膜区听诊未闻及杂音和额外心音,未闻及心包摩擦音。四肢肌力、肌张力正常,病理征(-)。
1.3 检查资料自带胸部CT(2017-10-25):双肺纹理增多,两肺可见多发类圆形无肺纹理区(图 1)。纤维支气管镜内镜诊断:气管慢性炎症伴毛细血管增生。纤维支气管镜病理诊断:右肺中叶支气管黏膜下灶状淋巴细胞浸润,余未见特异性改变。肺功能检查:肺弥散功能符合中度障碍;一氧化碳弥散量(DLCO%)为55.8%,残气/肺总量百分比轻度升高。肺通气功能正常;支气管舒张实验阴性。唇腺活检:送检唇腺组织内见灶状淋巴细胞浸润,每灶淋巴细胞大于50个。
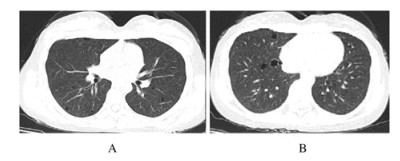
|
| A:Middle lobe of both lungs; B:Inferior lobe of right lung. 图 1 SS患者入院时胸部CT影像 Fig. 1 Chest CT images of a patient with SS at admission |
|
|
血常规:白细胞总数2.8×109L-1,单核细胞百分比11.3%,中性粒细胞计数1.25×109L-1,红细胞计数3.58×1012 L-1,血红蛋白质量浓度89 g·L-1,红细胞压积29.5%。肝功:白蛋白39.8 g·L-1,白球比值1.18,前白蛋白176 mg·L-1;心肌酶:肌酸激酶35U·L-1。ANA谱:SS A抗体阳性(
眼科会诊:干眼症(双侧眼),角膜炎(右侧眼)。
1.6 临床诊断和治疗入院诊断明确为SS、双肺肺大泡、肺部感染、贫血(轻度)。给予醋酸泼尼松片40 mg·d-1、复方环磷酰胺0.2 mg·d-1口服;同时给予头孢米诺、盐酸溴己新和多索茶碱等抗感染、祛痰、平喘及对症支持治疗后,患者呼吸困难和咳嗽等症状明显减轻,患者及家属要求出院。
1.7 随访规律口服醋酸泼尼松片40 mg·d-1和复方环磷酰胺0.2 mg·d-1 2个月后,复查胸部CT(2018-01-08),提示双肺肺大泡改变未见明显变化。见图 2。
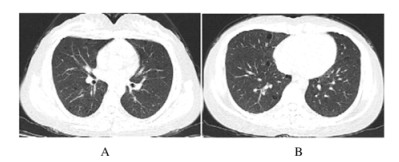
|
| A:Middle lobe of both lungs; B:Inferior lobe of right lung. 图 2 SS患者出院2个月后胸部CT影像 Fig. 2 Chest CT images of a patient with SS 2 months after discharging from hospital |
|
|
pSS主要涉及外分泌腺。大多数pSS患者的症状与泪腺和唾液腺功能减退有关。除了外分泌腺之外,还可能影响多个器官系统,如肺、肾、肝、关节和皮肤等[4],SS累及肺部的发病机制尚不完全明确,现已知的相关因素包括遗传相关性、免疫反应改变、异常组织修复、环境因素和免疫复合物的沉积等[5]。研究[6-7]显示:约20%的SS患者并发有呼吸系统症状,如干咳和呼吸困难等;并发肺部改变的SS患者,其10年后死亡风险增加4倍。
SS累及肺部主要表现:间质性肺炎(主要亚型有非特异性间质性肺炎、淋巴细胞性间质性肺炎和普通型间质性肺炎等)、肺动脉高压、淀粉样变性和肺大泡等[8]。SS累及肺部时以间质性肺炎为主,以非特异性间质性肺炎亚型最为常见,胸部CT的主要特征为胸膜下或基底部的磨玻璃影[9],且预后良好,预后与纤维化的有无及程度有关联。淋巴细胞性间质性肺炎是pSS肺间质改变(pSS-ILD)的典型亚型,胸部CT主要表现为磨玻璃影, 边缘模糊的小叶中心结节影, 小叶间隔增厚,沿淋巴道周围的间质增厚, 较有特点的CT征象为薄壁囊状影[10]。对于初始的激素治疗有较好的反应,但有1/3的患者诊断疾病后数年死亡或因免疫抑制治疗的并发症而出现感染[11]。pSS相关的普通型间质性肺炎在间质性肺病中是一种预后较差且对激素治疗反应较差的病理亚型,肺纤维化病变呈进行性进展,晚期可发生呼吸衰竭而导致死亡[12]。其影像学特征为牵拉性支气管扩张、小叶内间隔与小叶间隔增厚、细支气管扩张、蜂窝及网格状影和肺结构扭曲[13]。
pSS患者中肺动脉高压发生率高达23% [14]。超声心动图检查是pSS患者肺动脉高压的重要诊断方法。pSS相关肺动脉高压的发病机制目前尚不明确,推测与肺部血管炎症促使血管管腔狭窄甚至闭塞、从而形成肺动脉高压有关。免疫抑制剂联合靶向药物治疗能改善pSS并发肺动脉高压患者的预后[15]。
pSS继发支气管肺淀粉样变时其临床表现无特异性。对于SS患者肺部出现多发结节需考虑继发淀粉样变可能。确诊依靠病理检查和刚果红染色, 目前无特效疗法, 多数预后较好[16]。
pSS致肺大泡的病例国内鲜有报道。国内近10年内可检索到的以多发肺大泡为主要胸部影像学表现的SS相关病例报告共2例,该2例患者均为女性,主要临床表现为呼吸困难,肺部影像学表现均为双肺弥漫性肺大泡,其中1例肺功能检查未见异常,1例肺功能检查提示存在弥散功能障碍,上述2例患者均未完善肺活检[2-3]。本例患者因呼吸困难、咳血入院,有口干、眼干和龋齿等临床表现,存在干眼症,下唇腺病理示每病灶淋巴细胞数大于50个,血清免疫学提示抗SSA、抗SSB和类风湿因子均为阳性,根据中华医学会风湿病学分会2010年发布的SS诊断及治疗指南[1]可明确诊断为SS。患者为青年女性,既往否认特殊疾病史,入院后根据临床资料排除其他实质性病变。患者肺功能检查提示存在肺弥散功能障碍,DLCO为55.8%,考虑SS已累及肺部,且纤维支气管镜病理结果提示支气管黏膜下灶状淋巴细胞浸润,与徐东等[17]提出的SS累及肺部时肺活检病理结果为支气管和(或)肺间质内淋巴细胞和浆细胞弥漫性浸润相符合,故综合各项临床资料考虑其双肺多发肺大泡为SS累及所致。SS患者肺大泡的大小与受累气道有关,大者可达10 cm, 有学者[18]认为SS累及肺部形成肺大泡的机制可能是由于细支气管周围大量淋巴细胞浸润导致小气道阻塞, 致通气功能障碍, 尤其在呼气时, 气体被阻塞, 形成“活瓣”作用, 肺泡内压力不断增高, 从而形成肺大泡,另外间质性肺炎和肺纤维变性也可使肺泡的弹性降低, 使肺小泡破裂形成肺大泡。但也有研究[19]显示:SS患者肺大泡的形成可能与“活瓣”机制无关,而与CD4+T细胞和NK细胞介导的炎症反应有关。SS目前尚无确切根治的方法,治疗主要包括替代治疗和系统性治疗两个方面。前者是应用人工泪液、人工唾液、皮肤湿润剂和阴道润滑剂等替代品保持眼、口腔、皮肤和阴道等部位的湿润,以缓解局部症状, 对于存在内脏器官损害的SS(肺间质病变、肾脏损害、神经系统病变及血管炎等), 可能需要糖皮质激素、细胞毒性药物和免疫抑制剂等治疗[20]。本例患者使用糖皮质激素联合环磷酰胺治疗2个月后复查胸部CT,胸部影像学表现未见明显变化,可预判该患者预后欠佳。SS作为一种结缔组织病,其临床表现多样,累及肺部时,肺部的影像学表现也各不相同。当患者胸部CT提示存在双肺不明原因的多发肺大泡时应详细询问患者有无口干和眼干等病史,并进行免疫系统相关检查避免漏诊。同时应完善肺功能及纤维支气管镜活检等检查,确认其肺部影像学改变是否与SS有关,做到早发现、早治疗,以控制病情的进展,提高患者的生活质量和生存率。
| [1] | 中华医学会风湿病学分会. 干燥综合征诊断及治疗指南[J]. 中华风湿病学杂志, 2010, 14(11): 766–768. DOI:10.3760/cma.j.issn.1007-7480.2010.11.011 |
| [2] | 祝家彬, 王雅岩, 朴红梅. 干燥综合征合并多发肺大泡1例[J]. 实用医学杂志, 2014, 30(14): 2327. DOI:10.3969/j.issn.1006-5725.2014.14.055 |
| [3] | 曹小燕, 叶青. 原发性干燥综合征合并肺大疱1例[J]. 西部医学, 2009, 21(7): 1098. DOI:10.3969/j.issn.1672-3511.2009.07.082 |
| [4] | CHEN X, WU H, WEI W. Advances in the diagnosis and treatment of Sjogren's syndrome[J]. Clin Rheumatol, 2018, 37(7): 1743–1749. DOI:10.1007/s10067-018-4153-8 |
| [5] | YAZISIZ V, ARSLAN G, OZBUDAK I H, et al. Lung involvement in patients with primary Sjogren's syndrome:What are the predictors?[J]. Rheumatol Int, 2010, 30(10): 1317–1324. DOI:10.1007/s00296-009-1152-8 |
| [6] | KAMPOLIS C F, FRAGKIOUDAKI S, MAVRAGANI C P, et al. Prevalence and spectrum of symptomatic pulmonary involvement in primary Sjogren's syndrome[J]. Clin Exp Rheumatol, 2018, 36(3): 94–101. |
| [7] | PALM O, GAREN T, BERGE ENGER T, et al. Clinical pulmonary involvement in primary Sjogren's syndrome:prevalence, quality of life and mortality-a retrospective study based on registry data[J]. Rheumatology(Oxford), 2013, 52(1): 173–179. DOI:10.1093/rheumatology/kes311 |
| [8] | DONG X, ZHOU J, GUO X, et al. A retrospective analysis of distinguishing features of chest HRCT and clinical manifestation in primary Sjogren's syndrome-related interstitial lung disease in a Chinese population[J]. Clin Rheumatol, 2018, 37(11): 2981–2988. DOI:10.1007/s10067-018-4289-6 |
| [9] | ELICKER B, PEREIRA C A, WEBB R, et al. High-resolution computed to mography patterns of diffuse interstitial lung disease with clinical and pathological correlation[J]. Bras Pneumol, 2008, 34(9): 715–744. DOI:10.1590/S1806-37132008000900013 |
| [10] | 肖振平, 黎庶, 喻新茹, 等. 原发性干燥综合征肺部病变的HRCT表现[J]. 中国医学影像技术, 2006, 22(2): 254–256. DOI:10.3321/j.issn:1003-3289.2006.02.029 |
| [11] | TIAN X, YI E S, RYU J H. Lymphocytic interstitial pneumonia and other benign lymphoid disorders[J]. Semin Respir Crit Care Med, 2012, 33(5): 450–461. DOI:10.1055/s-00000075 |
| [12] | ROBLES-PEREZ A, MOLINA-MOLINA M. Treatment considerations of lung involvement in rheumatologic disease[J]. Respiration, 2015, 90(4): 265–274. DOI:10.1159/000441238 |
| [13] | 曹孟淑, 蔡后荣, CAOMeng-shu, 等. 原发性干燥综合征继发间质性肺炎患者胸部高分辨CT分析[J]. 临床荟萃, 2010, 25(8): 661–664. |
| [14] | VASSILIOU V A, MOYSSAKIS I, BOKI K A, et al. Is the heart affected in primary Sjogren's syndrome? An echocardiographic study[J]. Clin Exp Rheumatol, 2008, 26(1): 109–112. |
| [15] | LIU Z W, WANG J Y, LAI J Z, et al. Is it possible to apply the treat-to-target strategy in primary Sjogren's syndrome-associated pulmonary arterial hypertension?[J]. Clin Rheumatol, 2018, 37(11): 2989–2998. DOI:10.1007/s10067-018-4184-1 |
| [16] | GÓMEZ CORREA G A, OSORNO SERNA J, CÁCERES ACOSTA M F, et al. Nodular pulmonary amyloidosis:A manifestation of Sjogren's syndrome[J]. Case Rep Pulmonol, 2018, 2018: 9745935. |
| [17] | 徐东, 张奉春, 李景云. 结缔组织病合并肺大泡十例临床分析[J]. 中华风湿病学杂志, 2004, 8(11): 680–682. DOI:10.3760/j:issn:1007-7480.2004.11.011 |
| [18] | 罗日强, 崔阳, 周炜, 等. 原发性干燥综合征合并多发肺大疱五例[J]. 中华结核和呼吸杂志, 2006, 29(7): 501–502. DOI:10.3760/j:issn:1001-0939.2006.07.023 |
| [19] | JAGIRDAR J, CHIKKAMUNIYAPPA S, SIROHI D, et al. Cystic lung lesions in Sjogren syndrome:analysis of lymphocyte subsets in tissue with clinico-radiologic-pathologic correlation[J]. Ann Diagn Pathol, 2013, 17(1): 113–116. |
| [20] | 张风肖. 干燥综合征的治疗现状及进展[J]. 临床荟萃, 2016, 31(5): 482–485. |
 2019, Vol. 45
2019, Vol. 45


