扩展功能
文章信息
- 柳辛墨, 章亚东, 聂振国, 贾海港, 顾东强, 丁云鹏, 陈磊
- LIU Xinmo, ZHANG Yadong, NIE Zhenguo, JIA Haigang, GU Dongqiang, DING Yunpeng, CHEN Lei
- 聚己内酯半月板支架应力-应变特性的有限元分析
- Finite element analysis of stress-strain characteristics of polycaprolactone meniscus scaffold
- 吉林大学学报(医学版), 2019, 45(02): 389-394
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 389-394
- 10.13481/j.1671-587x.20190230
-
文章历史
- 收稿日期: 2018-06-11
2. 解放军总医院第一附属医院骨科, 北京 100048
2. Department of Orthopaedics, First Affiliated Hospital, PLA General Hospital, Beijing 100048, China
半月板损伤是膝部最常见的损伤之一,在美国半月板损伤发病率约为61/10万,据统计在美国每年约进行85万台半月板手术[1]。半月板在生物力学方面的主要作用是在膝关节运动过程中传导自股骨向胫骨的应力。通过应力传导作用保护关节内结构,减少关节面承受的压力。SEEDHOM等[2]研究表明:半月板切除术后关节面承受的压力会达到原有的235%。关节软骨的应力增加,会加速关节软骨出现病变,导致不可逆的关节软骨退变及骨性关节炎(osteoarthritis, OA)的发生。在半月板损伤的治疗中尽可能地保留半月板可以达到更好的预后已经达成共识[3-4]。但由于半月板从内缘向外缘逐渐出现无血供区域,在成人半月板中仅半月板外侧1/3有血供[5],使得半月板的可修复性降低。因此对于半月板损伤严重、不可修复或已经切除半月板的患者,为了提升患者的生活质量,延缓骨性关节炎及关节退化的发生,本文作者采取半月板重建技术进行治疗。半月板重建技术包括同种异体半月板移植术(meniscus allograft transplantation, MAT)和半月板替代物治疗。由于MAT存在供体稀缺、移植物保存技术受限、相对手术费用高昂以及各地区法律法规和伦理的限制等,很难满足患者的需求。因此组织工程半月板是近年来半月板重建技术的热门发展方向[6]。目前针对行半月板部分切除术的患者,已有2种部分半月板移植替代物应用于临床,即胶原半月板移植物(collagen meniscal implant,CMI)和高分子聚合物支架(actifit)[7]。但对于行半月板全切除术的患者目前临床上尚无相应的半月板替代物产品,因为整体半月板替代对植入替代物的力学性能要求更加严格,其受力环境复杂,人工组织工程半月板完全替代物的相关研究也是近年来主要的研究重点和难点[8]。
膝关节半月板生物力学特性的研究是组织工程半月板替换的理论基础,满足组织的力学特性是替换物首要的准则[9]。有限元法(finite element method,FEM)是目前为止理论力学研究最为经济可靠的方法[10-11]。近年来,聚己内酯(polycaprolactone,PCL)等人工合成材料因其良好的生物相容性、可控降解性及较好的生物力学特性在组织工程中应用广泛[12-14]。本研究建立正常膝关节、内侧半月板切除术后和PCL半月板替代后的膝关节三维有限元模型,分析PCL材料半月板对膝关节产生的生物力学影响,评估PCL支架作为人工半月板整体替代物的可能性,旨在为PCL组织工程半月板的研究提供力学理论基础。
1 资料与方法 1.1 实验标本根据国人解剖学数值[15]选取健康成年男性志愿者1人,27岁,身高178 cm,体质量72 kg,既往无膝关节疾病及外伤病史,在签署知情同意书后行膝关节正侧位X射线片排除外伤骨折、肿瘤、退变和畸形等异常,行膝关节磁共振成像(MRI)检查排除膝关节和半月板异常。
1.2 材料、设备和软件医用级PCL材料(深圳光华伟业公司,中国)。3.0T超导性MRI(SIEMENTS SONATA公司,德国),3D打印机MP Bioprint 3.0(广州迈普医学有限公司,中国)。万能材料试验机AG-IS(Shimadu公司,日本)。Mimics17.0软件(Materialise公司,比利时),Geomagic Studio软件(Geomagic公司, 美国),Hpermesh软件(Altair公司, 美国), Abaqus 6.13软件(Simulia公司,美国)。
1.3 影像学数据采集使志愿者保持仰卧位,在膝关节无负重状态,对单侧膝关节冠状位和矢状位进行连续断层扫描。扫描范围:髌骨上10cm至髌骨下10cm。序列:质子密度加权相(proton density weighted,PdWI)及三维毁损梯度回波序列(three-dimensional spoiled gradient-recall imaging,3D-SPGR)。层厚:1.0 mm,分辨率:0.47 mm×0.47 mm。回波时间/重复时间(TE/TR):43/7170ms。扫描获得膝关节二维图像。
1.4 建立膝关节半月板三维有限元模型利用获取的MRI图像,将其导入医学图像处理软件Mimics17.0构建包括股骨、胫骨、腓骨和半月板的膝关节三维几何模型。为了确保模型的精确度以及下一步模型验证的准确性,本文作者根据解剖学的测量统计数据[16-17]对模型进行校正。相关指标包括:内和外侧股骨髁的宽度、高度及前后径,骨髁间窝的宽度及深度;内和外侧胫骨平台的前后径及宽度;内和外侧半月板的前中后宽度、前后径及厚度。将曲面模型导入Geomagic Studio软件中转换为实体模型,并在Hpermesh软件划分网格。最后,将上述膝关节几何模型导入到有限元软件Abaqus 6.13进行仿真模拟(图 1)。由于关节组织为不规则体,故采用一阶四面体单元对股骨、胫骨和半月板进行网格划分。在半月板及关节面附近将单元边长设定为1 mm,而在远离关节面的股骨近端和胫骨远端将单元边长设定为5 mm。由于韧带组织主要在平行于纤维的方向上承受拉力,因此采用只受拉力不受压力的一阶桁架单元束来模拟膝关节中的韧带。
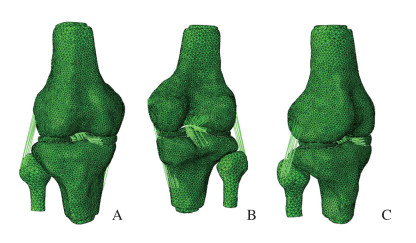
|
| A:Front view;B:Back view;C:Side view. 图 1 膝关节有限元模型 Fig. 1 Finite element model of knee joint |
|
|
为了考虑关节面附近软组织与骨组织之间的相互作用,分别对皮质骨、松质骨、关节软骨、软骨下骨、半月板、半月板前后角和韧带进行材料赋值[18-19],半月板为正交各向异性材料,皮质骨、松质骨、关节软骨和软骨下骨为各向同性线弹性材料,软骨下骨位于软骨之下,平均厚度约2 mm [20],其力学环境与软骨退化有着密切的联系。由于难以在MRI图像中对软骨下骨进行提取,故将软骨以下2 mm的部分假设为软骨下骨。韧带为只受拉不受压的非线性超弹性材料,假设预应力为3%。
本实验主要目的是研究半月板与股骨软骨及胫骨软骨的力学情况,故在建立的膝关节有限元模型中设定6组接触面。外侧:股骨关节软骨-胫骨关节软骨、外侧半月板-股骨关节软骨和外侧半月板-胫骨关节软骨。内侧:股骨关节软骨-胫骨关节软骨、股骨关节软骨-内侧半月板和内侧半月板-胫骨关节软骨。关节接触面的定义为无穿透、无摩擦、有限滑移的硬接触。在股骨经股骨内和外上髁中点施加轴向压缩载荷,保持胫腓骨在6个自由度上完全约束固定,股骨在屈-伸0°固定,其他自由度上不予约束。
1.6 验证模型有效性根据实验设定的载荷与边界条件对膝关节有限元模型进行加载。保持膝关节伸展,对胫骨远端的6个自由度进行约束,在股骨近端施加竖直向下的载荷,大小依次为200、500和1000 N。测量胫骨内、外侧平台上的接触面积。
1.7 测试PCL材料属性使用MP Bioprint 3.0 3D打印机采用熔融法将PCL材料(平均相对分子质量:100000, 熔点:70℃)制备成高度9mm、厚度2mm的圆柱体。使用SHIMADZU公司万能材料测试机对制备出的PCL材料进行测试。压缩速率为0.1mm·min-1,最大压缩体积为35%。测得PCL杨氏模量(E)为17.9MPa, 剪切模量(G)为6MPa,根据G=E/2(1+v),计算得出泊松比(v)为0.49。
1.8 半月板位移分析采用上述验证过的有限元模型,在股骨经股骨上髁轴中点上施加1 400 N的轴向压缩载荷,并保持胫腓骨在6个自由度上完全约束固定,股骨在屈-伸0°固定,其他自由度上不予约束,计算半月板位置情况。然后将内和外侧半月板属性替换为所测得PCL材料属性,其他材料属性保持不变,建立内和外侧半月板为PCL材料的膝关节模型。同样在股骨经股骨上髁轴中点上施加相同条件的轴向载荷,边界条件同前,模拟出PCL材料内侧半月板在膝关节中的受力情况,计算出PCL半月板模型的位移情况。
1.9 关节软骨接触压力分析将建立的天然膝关节模型设置为健康膝关节模型。将该模型内侧半月板材料属性替换为PCL材料属性,建立出内侧半月板为PCL材料的膝关节模型。通过在Abqus软件中将三维有限元模型中内侧半月板所有单元和节点全部删除,建立出内侧半月板全切除模型。分别在上述3组模型的股骨经股骨上髁轴中点上施加1400N的轴向压缩载荷,并保持胫腓骨在6个自由度上完全约束固定,股骨在屈-伸0°固定,其他自由度上不予约束。计算出3组模型中内、外侧胫骨平台关节软骨及内、外侧股骨髁关节软骨接触压力情况。
2 结果 2.1 模型有效性验证将胫骨内、外侧平台上的接触面积与实验结果进行比较,其大小如表 1所示。与FUKUBAYASHI等[21]实验结果比较,模拟的结果始终在实验测量的误差范围内,说明建立的模型有效。
| (S/mm2) | |||||
| Load(N) | Contact area of medial tibial plateau | Contact area of lateral tibial plateau | |||
| Our model | Fukubayashi | Our model | Fukubayashi | ||
| 200 | 394.2 | 420±150 | 220.8 | 270±50 | |
| 500 | 497.7 | 530±150 | 433.9 | 420±60 | |
| 1 000 | 583.8 | 640±180 | 563.1 | 510±70 | |
当内、外侧半月板用具有相同形状的PCL材料置换时,内、外侧半月板在轴向压缩性位移有明显改变,健康膝关节内、外侧半月板在轴向压缩载荷下最大位移分别为0.83和1.76 mm,当被具有相同形状的PCL材料置换时,内、外侧半月板最大位移分别为1.15和2.20 mm,分别较正常增加38.6%和25.0%。可见内侧半月板中后部位移相对较大,而外侧半月板前部和后部位移相对较大。见图 2。
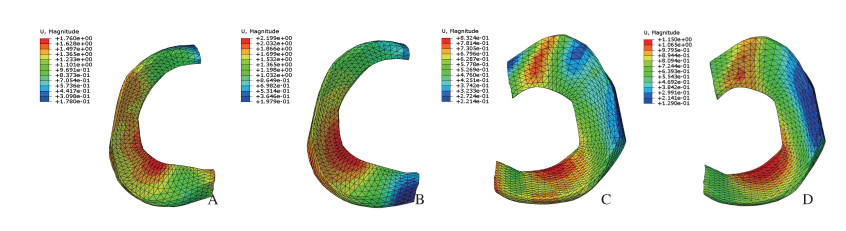
|
| A,C: Natural meniscus; B,D: PCL meniscus. 图 2 在1 400 N轴向压缩载荷下内和外侧半月板位移分布 Fig. 2 Displacement distribution of medial and lateral meniscus under axial compression load of 1 400 N |
|
|
健康模型的内、外侧胫骨平台关节软骨上最大压缩应力分别为2.5和1.7 MPa,在内、外侧股骨髁关节软骨最大压缩应力分别为2.7和2.1MPa。见图 3。在内侧半月板被具有相同形状的PCL支架材料置换时,内、外侧胫骨平台关节软骨上最大压缩应力分别为2.7和1.8 MPa,分别较健康模型增加8.0%和5.9%;在内、外侧股骨髁关节软骨最大压缩应力分别为3.0和2.2 MPa,分别较健康模型增加11.1%和4.8%。见图 4。当内侧半月板完整切除时,内、外侧胫骨平台关节软骨上最大压缩应力分别为9.0和7.0 MPa,分别较健康模型增加260.0%和311.7%;内、外侧股骨髁关节软骨最大压缩应力分别为8.5和7.8 MPa,分别较健康模型增加214.8%和271.4%。见图 5。
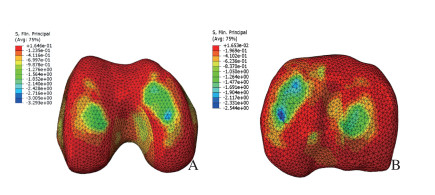
|
| A: Femoral condyle; B: Tibial plateau. 图 3 正常膝关节股骨髁和胫骨平台接触压力 Fig. 3 Normal contact pressure of femoral condyle and tibial plateau of knee joint |
|
|
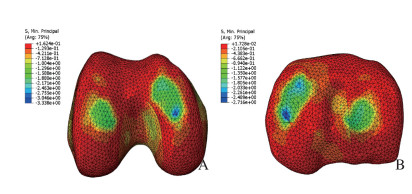
|
| 图 4 内侧半月板为PCL支架膝关节股骨髁和胫骨平台接触压力 Fig. 4 Contact pressure of femoral condyle and tibial plateau of knee joint withmedial meniscus replaced with PCL scaffold |
|
|
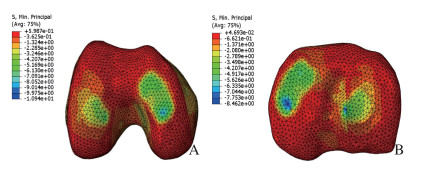
|
| A:Femoral condyle;B:Tibial plateau. 图 5 切除内侧半月板膝关节股骨髁和胫骨平台接触压力 Fig. 5 Contact pressure of femoral condyle and tibial plateau of knee joint without medial meniscus |
|
|
建模结构是决定模型仿真精准程度重要因素之一,为了提高模型精度,本文作者通过层厚为1.00 mm的MRI的二维图像尽可能地接近重构还原各组织几何结构,并通过既往的解剖文献对模型加以进一步校正。因本研究目的在于研究半月板替代物的生物力学效应,而半月板本身最主要的功能之一为对关节软骨的保护作用,故在建模过程中对于关节软骨的建模是后期分析的重要基础。本研究在MRI扫描时采用了3D-SPGR,研究[22-23]表明:3D序列技术可连续获得薄层图像,可减少数据丢失,在关节软骨的扫描上具有较高敏感性。
BOXHEIMER等[24]采用MRI观察22名健康志愿者的膝关节发现:其在直立负重时具有一定的活动度,半月板位移范围为1.2~2.6 mm,且认为正常人膝关节半月板疝出应小于3.0 mm。上述观点与本研究结果一致,在轴向1400N载荷下健康膝关节的内、外半月板位移分别为0.83和1.76 mm,而在PCL模型中内、外侧半月板位移为1.15和2.20 mm。位移形变量与材料属性存在一定的关系,简单可概括为弹性模量越大,在相同载荷下所产生的位移越小。本实验结果显示:在直立状态下,PCL材料人工半月板的变形在正常范围内,即其抗压属性可满足半月板的力学性能要求。
半月板是通过增加膝关节之间的接触面积,使得平均接触压力降低,并通过切面的楔形结构使来自股骨髁的应力呈辐射状向关节外发散,达到保护关节内结构和减少关节面承受压力的作用。在半月板切除后,由于接触面积的减少,关节间接触的应力将集中于相对较小的关节软骨面,导致接触应力增加。BARATZ等[25]对3具尸体膝关节测试结果显示:半月板切除术后关节软骨最大压缩应力会平均增加236%(144%~296%)。PENA等[26]通过膝关节三维有限元模型观察发现:内侧半月板全切除的患者较健康膝关节对比,内、外侧股骨髁关节软骨最大压缩应力分别增加123%和304%,而内、外侧胫骨平台关节软骨最大压缩应力分别增加109%和302%。本研究通过加载1400N轴向载荷得出类似的结果,在内侧半月板完整切除模型,内、外侧胫骨平台关节软骨上最大压缩应力分别较健康模型正常增加260.0%和311.7%;内、外侧股骨髁关节软骨最大压缩应力分别增加214.8%和271.4%。而当将内侧半月板替换为PCL的模型中,内、外侧胫骨平台关节软骨上最大压缩应力分别增加8.0%和5.9%,内、外侧股骨髁关节软骨最大压缩分别增加11.1%和4.8%。本研究结果显示:PCL材料可以明显缓解股骨髁与胫骨平台关节软骨所承受的压缩应力,且与健康膝关节模型中关节软骨所承受的应力相近,说明PCL材料支架可以有效地起到天然半月板在垂直载荷中保护关节软骨的作用。
综上所述,本实验通过膝关节MRI图像,精细地建立了完整膝关节三维有限元模型,并在此基础上,建立了内侧半月板切除术后和PCL半月板支架的膝关节模型。通过对半月板的位移、股骨髁关节软骨和胫骨平台关节软骨的接触压力对比研究证实:PCL材料在垂直压缩载荷下具有与天然半月板类似的力学性能,可有效地缓解半月板切除后关节软骨的应力集中,具有成为组织工程人工半月板材料的可能性。本实验结果不仅为PCL组织工程半月板的研究提供了一定的理论基础,其方法和模型具有一定的普遍适用性,也可广泛应用于其他组织支架力学特性的研究。
| [1] | DANGELMAJER S, FAMILIARI F, SIMONETTA R, et al. Meniscal transplants and scaffolds:A systematic review of the literature[J]. Knee Surg Relat Res, 2017, 29(1): 3–10. DOI:10.5792/ksrr.16.059 |
| [2] | SEEDHOM B B, HARGREAVES D. Transmission of the load in the knee joint with special reference of the role of the menisci[J]. Eng Med, 1979, 8(3): 220–228. |
| [3] | FOX A J, WANIVENHAUS F, BURGE A J, et al. The human meniscus:a review of anatomy, function, injury, and advances in treatment[J]. Clin Anat, 2015, 28(2): 269–287. DOI:10.1002/ca.22456 |
| [4] | ZHANG Y D, HOU S X, ZHONG H B, et al. Meniscal allograft transplantation using a novel all-arthroscopic technique with specifically designed instrumentation[J]. Exp Ther Med, 2018, 15(3): 3020–3027. |
| [5] | XUE C, ZHANG L, SHUANG F, et al. Robust revascularization, despite impaired VEGF production, after meniscus allograft transplantation in rabbits[J]. Am J Sports Med, 2013, 41(11): 2668–2675. DOI:10.1177/0363546513499139 |
| [6] | GUO W, LIU S, ZHU Y, et al. Advances and prospects in tissue-engineered meniscal scaffolds for meniscus regeneration[J]. Stem Cells Int, 2015, 2015: 517–520. |
| [7] | MORAN C J, WITHERS D P, KURZWEIL P R, et al. Clinical application of scaffolds for partial meniscus replacement[J]. Sports Med Arthrosc Rev, 2015, 23(3): 156–161. DOI:10.1097/JSA.0000000000000072 |
| [8] | SUN J, VIJAYAVENKATARAMAN S, LIU H. An overview of scaffold design and fabrication technology for engineered knee meniscus[J]. Materials (Basel), 2017, 10(1): E29. |
| [9] | VRANCKEN A C, EGGERMONT F, van TIENEN T G, et al. Functional biomechanical performance of a novel anatomically shaped polycarbonate urethane total meniscus replacement[J]. Knee Surg Sports Traumatol Arthrosc, 2016, 24(5): 1485–1494. DOI:10.1007/s00167-015-3632-6 |
| [10] | 王宇, 穆尚强, 梅继文, 等. 可膨胀椎间融合器治疗腰椎间盘轻度退变的有限元分析[J]. 吉林大学学报:医学版, 2016, 42(3): 565–569. |
| [11] | JOHANNESDOTTIR F, ALLAIRE B, BOUXSEIN M L. Fracture prediction by computed tomography and finite element analysis:current and future perspectives[J]. Curr Osteoporos Rep, 2018, 16(4): 411–422. DOI:10.1007/s11914-018-0450-z |
| [12] | ZHOU G, JIANG H, YIN Z, et al. In vitro regeneration of patient-specific ear-shaped cartilage and Its first clinical application for auricular reconstruction[J]. EBio Med, 2018, 28: 287–302. |
| [13] | GAO M C, ZHANG H Y, DONG W, et al. Tissue-engineered trachea from a 3D-printed scaffold enhances whole-segment tracheal repair[J]. Sci Rep, 2017, 7(1): 5246. DOI:10.1038/s41598-017-05518-3 |
| [14] | NEUFURTH M, WANG X H, WANG S, et al. 3D printing of hybrid biomaterials for bone tissue engineering:Calcium-polyphosphate microparticles encapsulated by polycaprolactone[J]. Acta Biomater, 2017, 64(3): 377–388. |
| [15] | 黄瀛. 中国人解剖学数值[M]. 北京: 人民卫生出版社,2002: 27. |
| [16] | HAUT TL, HULL M L, HOWELL S M. Use of roentgenography and magnetic resonance imaging to predict meniscal geometry determined with a three-dimensional coordinate digitizing system[J]. J Orthop Res, 2000, 18(2): 228–237. DOI:10.1002/(ISSN)1554-527X |
| [17] | 王岩, 周飞虎, 周勇刚, 等. 国人正常膝关节三维几何形态测量及相关研究[J]. 中国矫形外科杂志, 2004, 12(8): 617–619. DOI:10.3969/j.issn.1005-8478.2004.08.019 |
| [18] | KEDGLEY A E, SAW T H, SEGAL N A, et al. Predicting meniscal tear stability across knee-joint flexion using finite-element analysis[J]. Knee Surg Sports Traumatol Arthrosc, 2018. DOI:10.1007/S00167-018-5090-4 |
| [19] | SHRIRAM D, PRAVEEN KUMAR G, CUI F S. Evaluating the effects of material properties of artificial meniscal implant in the human knee joint using finite element analysis[J]. Sci Rep, 2017, 7(1): 6011–6012. DOI:10.1038/s41598-017-06271-3 |
| [20] | DONG Y F, HU G H, DONG Y H, et al. The effect of meniscal tears and resultant partial meniscectomies on the knee contact stresses:a finite element analysis[J]. Comput Methods Biomech Biomed Engin, 2014, 17(13): 1452–1463. DOI:10.1080/10255842.2012.753063 |
| [21] | FUKUBAYASHI T, KUROSAWA H. The contact area and pressure distribution pattern of the knee.A study of normal and osteoarthrotic knee joints[J]. Acta Orthop Scand, 1980, 51(6): 871–879. |
| [22] | CHA J G, YOO J H, RHEE S J, et al. MR imaging of articular cartilage at 1.5T and 3.0T:comparison of IDEAL 2D FSE and 3D SPGR with fat-saturated 2D FSE and 3D SPGR in a porcine model[J]. Acta Radiol, 2014, 55(4): 462–469. DOI:10.1177/0284185113497711 |
| [23] | LI X, YU C, WU H, et al. Prospective comparison of 3D FIESTA versus fat-suppressed 3D SPGR MRI in evaluating knee cartilage lesions[J]. Clin Radiol, 2009, 64(10): 1000–1008. DOI:10.1016/j.crad.2009.07.008 |
| [24] | BOXHEIMER L, LUTZ A M, TREIBER K, et al. MR Imaging of the knee:Position related changes of the menisci in asymptomatic volunteers[J]. Radiology, 2004, 39(5): 254–263. |
| [25] | BARATZ M E, FU F H, MENQATO R, et al. Meniscal tears:the effect of meniscectomy and of repair on intraarticular contact areas and stress in the human knee.A preliminary report[J]. Am J Sports Med, 1986, 14(4): 270–275. DOI:10.1177/036354658601400405 |
| [26] | PENA E, CALVO B, MARTÍNEZ M A, et al. Finite element analysis of the effect of meniscal tears and meniscectomies on human knee biomechanics[J]. Clin Biomech(Bristol, Avon), 2005, 20(5): 498–507. DOI:10.1016/j.clinbiomech.2005.01.009 |
 2019, Vol. 45
2019, Vol. 45


