扩展功能
文章信息
- 毕红东, 谢亚芹, 崔海鹏, 刘凯, 孙晓旭, 王途, 赵娟
- BI Hongdong, XIE Yaqin, CUI Haipeng, LIU Kai, SUN Xiaoxu, WANG Tu, ZHAO Juan
- 多肽化合物urantide对动脉粥样硬化大鼠胸主动脉和VSMC中Ⅳ型胶原表达的影响
- Effects of urantide on expressions of type Ⅳ collagenin thoracic aorta and VSMC of atherosclerotic rats
- 吉林大学学报(医学版), 2019, 45(02): 342-346
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 342-346
- 10.13481/j.1671-587x.20190222
-
文章历史
- 收稿日期: 2018-06-04
Ⅳ型胶原(type Ⅳ collage, Col Ⅳ)是胶原性氨基酸,是由3条α肽链组成的三聚体结构,每条α链约含1 700个氨基酸残基,呈网状分布在组织中,其在动脉粥样硬化(atherosclerosis, AS)中的作用已成为研究的热点[1-2]。氧化应激导致的AS斑块破裂可促进主动脉平滑肌细胞中Col Ⅳ水平的增加[3]。研究[4-5]发现:在AS斑块形成中,经修饰的Col Ⅳ与低密度脂蛋白的氧化有关,可能导致内皮功能的障碍,参与AS的发生发展。多肽化合物urantide是血管活性物质尾加压素Ⅱ(urotensinⅡ, UⅡ)的受体拮抗剂,其拮抗效应较其他化合物高100倍[6-8]。本文作者前期研究[9]显示:urantide能竞争性拮抗UⅡ对AS大鼠胸主动脉的炎症损伤作用及对血管平滑肌细胞(vascular smooth muscle cells, VSMC)的促丝裂作用,抑制AS的发生发展,但具体作用机制尚未阐明。有关urantide对AS大鼠胸主动脉Col Ⅳ代谢影响的有关研究尚未见报道。本研究通过探讨多肽化合物urantide对AS大鼠Col Ⅳ表达的影响,阐明其防治AS的作用机制,为临床应用urantide治疗AS提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器SPF级雄性Wistar大鼠,体质量180~200 g,北京维通利华实验动物有限公司提供,实验动物使用许可证号:SCXK(京)-2016-0011,生产合格证号:11400700127208。urantide由苏州强耀生物公司提供,氟伐他汀(fluvastatin, Flu)购自北京诺华制药有限公司,DMEM培养基干粉和胎牛血清购自美国Gibco公司,Col Ⅳ(ELISA)试剂盒和羟脯胺酸(hydroxyproline, HYP)试剂盒购自江苏晶美生物科技有限公司,Col Ⅳ(小鼠抗大鼠)单克隆抗体购自美国RD公司,生物素标记二抗IgG、S-ABC试剂盒和DAB试剂盒购自碧云天生物技术有限公司。全自动封闭组织脱水机、包埋机、石蜡切片机、组织恒温烤片机和数码显微镜购自德国莱卡公司。
1.2 AS模型复制和实验分组高脂饲料配方:基础饲料加入3.5%胆固醇、10%猪油、0.2%丙基硫氧嘧啶、0.5%胆酸钠及5%白糖。Wistar大鼠180只随机分为正常对照组(n=30)和AS模型组(n=150)。正常对照组大鼠每日饲以普通饲料;AS模型组大鼠实验开始时腹腔注射维生素D3(vitamin D3, VD3) 150 U·kg-1,连续3 d,每日饲以高脂饲料。实验周期为4周。AS模型复制成功后,AS组大鼠再随机分为AS组(30只)、Flu组(阳性药对照组,30只)和urantide(3、7和14 d)组(每组30只)。正常对照组和AS组大鼠每日尾静脉注射生理盐水30 μg·kg-1,连续14 d;Flu组大鼠每日灌胃给予Flu 5 μg·kg-1,连续14 d;urantide组大鼠每日尾静脉注射urantide 30 μg·kg-1,给药时间分别为3、7和14 d。
1.3 免疫组织化学法检测Col Ⅳ表达采用S-ABC法对大鼠胸主动脉石蜡切片进行免疫组织化学染色,按操作说明进行。Introduction to Image-Proplus 6.0病理图像分析软件对每张切片(随机选取10个视野,×200)的免疫组织化学阳性信号进行图像分析,计算平均吸光度(A)值。以A值表示大鼠胸主动脉中Col Ⅳ的表达水平。
1.4 VSMC原代培养和实验分组Wistar大鼠胸主动脉采用贴块法进行VSMC原代培养。按所加条件培养液分组:正常对照组,用含10%胎牛血清的DMEM培养液培养细胞;UⅡ组,正常组细胞加入UⅡ,终浓度为10-8 mol·L-1;Flu组,UⅡ组细胞加入Flu,终浓度为10-7 mmol·L-1;urantide组,UⅡ组细胞加入urantide,终浓度为10-10~10-6 mol·L-1。
1.5 ELISA法检测HYP和Col Ⅳ水平采用HYP试剂盒检测各组大鼠血清和尿液中HYP水平,于酶联免疫检测仪450 nm波长处测量A值;采用Col Ⅳ(ELISA)试剂盒检测VSMC培养上清中Col Ⅳ水平,于酶联免疫检测仪490 nm波长处测量A值。根据标准曲线求出直线回归方程,计算相应的HYP和Col Ⅳ水平。
1.6 统计学分析采用SPSS 20.0软件进行统计学分析。各组大鼠血清和尿液中HYP水平、胸主动脉和VSMC培养上清液中Col Ⅳ表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用最小显著差法(LSD)。以P < 0.05为差异有统计学意义。
2 结果 2.1 正常对照组和AS模型组大鼠胸主动脉形态表现HE染色结果显示:正常对照组大鼠胸主动脉血管内皮完整,中膜可见梭形平滑肌细胞,弹力纤维层结构清晰完整;AS模型组大鼠胸主动脉内膜明显增厚,血管内皮细胞排列不完整,平滑肌细胞增生,大量泡沫细胞堆积,出现典型AS病理改变。见图 1(插页五)。
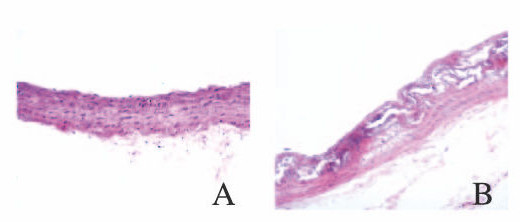
|
| A: Normal control group; B: AS model group. 图 1 2组大鼠胸主动脉形态表现(HE,×200) Fig. 1 Morphology of thoracic aorta of rats in two groups(HE, ×200) |
|
|
各组大鼠胸主动脉内膜下不规则斑块内Col Ⅳ阳性表达水平比较差异有统计学意义(F=35.09, P < 0.01)。正常对照组大鼠胸主动脉中Col Ⅳ阳性颗粒呈微量表达;AS组大鼠胸主动脉内膜下不规则斑块内Col Ⅳ阳性颗粒与正常对照组比较明显增加(P < 0.01);urantide组Col Ⅳ阳性染色强度和范围与AS组比较均减少(P < 0.01),urantide给药14 d时作用最明显,优于Flu组。见图 2(插页五)和3。
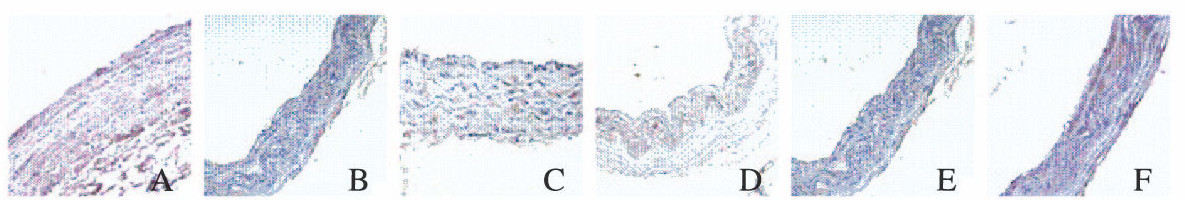
|
| A: Normal control group; B: AS group; C: Flu group; D-F: Urantide group (3, 7, 14 d). 图 2 各组大鼠胸主动脉中Col Ⅳ表达(免疫组织化学,×200) Fig. 2 Expressions of Col Ⅳ in thoracic aorta of rats in various groups (Immunohistochemistry, ×200) |
|
|
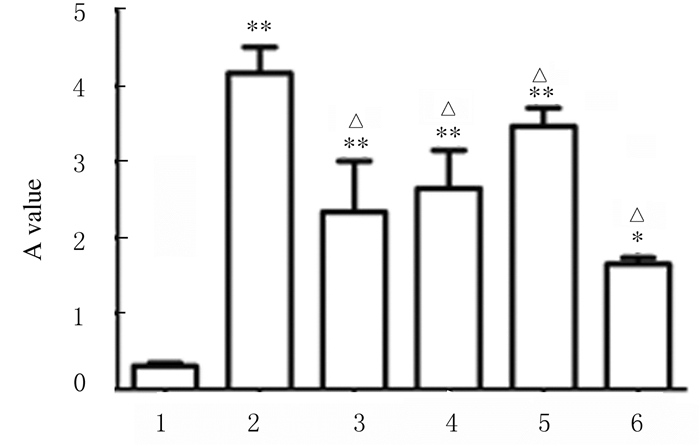
|
| 1:Normal control group; 2:AS group; 3:Flu group; 4-6:Urantide group(3, 7, and 14 d).*P < 0.05, **P < 0.01 compared with normal control group; △P < 0.01 compared with AS group. 图 3 各组大鼠胸主动脉中Col Ⅳ表达 Fig. 3 Expressions of Col Ⅳ in thoracic aorta of rats in various groups |
|
|
HYP试剂盒检测结果显示:各组大鼠血清和尿液中HYP水平比较差异均有统计学意义(F=24.38, P < 0.01; F=26.72, P < 0.01)。与正常对照组比较,AS组大鼠血清中HYP水平明显升高(P < 0.01),而尿液中HYP水平则明显降低(P < 0.01)。与AS组比较,urantide组不同时间大鼠血清中HYP水平均明显降低(P < 0.01),给药7 d时降低作用最明显,接近于Flu组水平;与AS组比较,urantide组尿液中HYP水平明显升高(P < 0.01),给药14 d时增加作用最明显,优于Flu组水平。见表 1。
| [n=5, x±s, cB/(μmol·L-1)] | ||
| Group | Serum | Urine |
| Normal control | 8.00±0.10 | 0.65±0.01 |
| AS | 82.86±0.25* | 0.25±0.02* |
| Flu | 17.07±0.22△ | 4.35±0.03*△ |
| Urantide | ||
| 3 d | 68.42±0.51*△ | 3.45±0.01*△ |
| 7 d | 21.12±0.19*△ | 7.14±0.01* |
| 14 d | 29.46±0.18*△ | 8.96±0.02*△ |
| * P<0.01 compared with normal control group; △ P<0.01 compared with AS group. | ||
各组VSMC培养上清中Col Ⅳ水平差异有统计学意义(F=31.04, P < 0.01)。与正常对照组比较,UⅡ组VSMC培养上清中Col Ⅳ水平明显升高(P < 0.01);与UⅡ组比较,10-9~10-6mol·L-1 urantide组VSMC培养上清中Col Ⅳ水平明显降低(P < 0.05或P < 0.01),其中10-6mol·L-1 urantide组抑制作用接近于阳性药Flu组水平。见图 4。
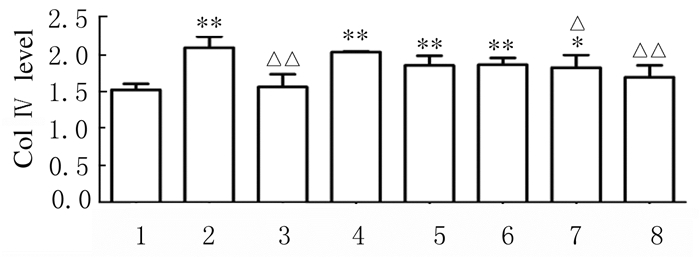
|
| 1:Normal control group; 2:AS group; 3:Flu group; 4-8:10-10, 10-9, 10-8, 10-7, and 10-6 mol·L-1 urantide groups.*P < 0.05, **P < 0.01 compared with normal control group; △ P < 0.05, △△ P < 0.01 compared with AS group. 图 4 ELISA法检测各组大鼠VSMC培养上清中Col Ⅳ表达水平 Fig. 4 Levels of Col Ⅳ in VSMC culture supernatant of rats in various groups detected by ELISA method |
|
|
AS是心血管系统中最常见的疾病,动脉壁胶原代谢紊乱是其发生发展的重要病因[10-11]。国内外研究[4-5]显示:Col Ⅳ是AS时胶原代谢紊乱的主要参与者。Col Ⅳ在AS各期的分布不同,在AS早期Col Ⅳ主要分布在泡沫细胞周围,AS晚期Col Ⅳ主要分布在动脉内膜下不规则斑块内和纤维帽下VSMC周围[12-13]。本研究免疫组织化学结果显示:AS组Col Ⅳ阳性颗粒主要表达在大鼠胸主动脉内膜下不规则斑块内,这一结果与有关Col Ⅳ在AS晚期分布的文献[13]报道一致。因此本文作者推测:腹腔注射VD3联合高脂饲料饲养法可损伤大鼠胸主动脉内膜,促进中膜的VSMC合成和Col Ⅳ大量分泌,当超过机体的代偿能力时,Col Ⅳ就在动脉壁沉积,促进AS的发生发展。如何有效地抑制AS大鼠Col Ⅳ的表达,对于治疗AS具有重要的临床意义。
UⅡ最早是从鱼的脊髓尾部下垂体中分离出的生长抑素样环肽,其与G蛋白偶联受体14(G protein-coupled receptor 14, GPR14)结合后发挥生物学效应。研究[14-15]显示:UⅡ能够促进VSMC增殖和胶原合成,促进巨噬细胞向泡沫细胞转化,与AS的发生发展有密切关系。urantide是UⅡ受体拮抗剂,可以通过阻断UⅡ与其受体GPR14的结合,起到治疗AS的作用,但具体作用机制尚未阐明[16-18]。Col Ⅳ是AS晚期时粥样斑块的主要成分,而urantide可抑制AS的发生发展。本实验通过尾静脉注射分3、7和14 d 3个组别,连续给予urantide 30 μg·kg-1,以观察urantide对AS大鼠Col Ⅳ表达的影响。本研究体内实验结果显示:urantide组Col Ⅳ阳性染色强度和范围与AS组比较均减少。由此表明:urantide对AS大鼠胸主动脉中膜的VSMC合成和分泌的Col Ⅳ有抑制作用。本研究采用ELISA法检测urantide对VSMC培养上清中Col Ⅳ水平的影响,结果显示:在VSMC的培养上清中,UⅡ对Col Ⅳ表达有上调作用,而urantide则对Col Ⅳ表达有下调趋势。动物水平和细胞水平的实验结果均证实urantide可抑制AS大鼠胸主动脉VSMC分泌和合成Col Ⅳ。
Col Ⅳ是由甘氨酸(glycine, Gly)、脯氨酸(proline, Pro)、HYP和羟赖氨酸等组成的胶原性氨基酸[19]。HYP是胶原纤维所特有,占胶原蛋白13.4%,测定动物血清或尿液中HYP水平,可反映机体胶原代谢情况[19-20]。本研究结果显示:与AS组比较,urantide组大鼠血清中HYP水平均明显降低,而尿液中HYP水平则明显升高。本文作者推测:urantide可促进动脉壁的Col Ⅳ降解加速,使血清中Col Ⅳ以HYP形式随尿液排出体外,使大鼠AS症状缓解。
综上所述,在AS发生发展过程中urantide可抑制AS大鼠胸主动脉中Col Ⅳ的分泌和合成,加速动脉壁内Col Ⅳ降解,改善AS病变程度,为临床应用urantide治疗AS提供了理论基础。
| [1] | 刘燕, 刘晓辉, 宋艳玲, 等. 急性脑梗死患者血清Ⅰ型胶原羧基末端肽改变及其与颈动脉粥样硬化斑块的关系[J]. 心肺血管病杂志, 2018, 37(1): 39–45. DOI:10.3969/j.issn.1007-5062.2018.01.010 |
| [2] | 马玉梅, 霍清萍. 基质金属蛋白酶9与动脉粥样硬化及中医药防治[J]. 中西医结合心脑血管病杂志, 2014, 12(9): 1127–1128. DOI:10.3969/j.issn.16721349.2014.09.048 |
| [3] | 郑辉, 刘慧娟, 葛焕琦, 等. 网膜素改善氧化应激对人动脉血管平滑肌细胞Ⅰ、Ⅳ型胶原表达的抑制作用[J]. 中国动脉硬化杂志, 2016, 24(2): 141–144. |
| [4] | DUNÉR P, GONÇALVES I, GRUFMAN H, et al. Increased aldehyde-modification of collagen type Ⅳ in symptomatic plaques:A possible cause of endothelial dysfunction[J]. Atherosclerosis, 2015, 240(1): 26–32. DOI:10.1016/j.atherosclerosis.2015.02.043 |
| [5] | MCLEOD O, DUNÉR P, SAMNEGÅRD A, et al. Autoantibodies against basement membrane collagen type Ⅳ are associated with myocardial infarction[J]. Int J Cardiol Heart Vasc, 2015, 6(1): 42–47. |
| [6] | ZHAO J, ZHANG S F, SHI Y, et al. Effects of urotensin Ⅱ and its specific receptor antagonist urantide on rat vascular smooth muscle cells[J]. Bosn J Basic Med Sci, 2013, 13(2): 78–83. DOI:10.17305/bjbms.2013.2369 |
| [7] | BARKAREV M A, KARPOVA A A, PICHIGIN V I, et al. Involvement of the coronary bed in patients with coronary heart disease against the background of primarily coronary and generalized atherosclerosis[J]. Bull Exp Biol Med, 2016, 162(2): 283–287. DOI:10.1007/s10517-016-3595-8 |
| [8] | 赵娟, 宋成军, 姜菊花, 等. urantide对实验性动脉粥样硬化大鼠肝脏的影响[J]. 中国老年学杂志, 2014, 34(4): 940–942. DOI:10.3969/j.issn.1005-9202.2014.04.038 |
| [9] | ZHAO J, YU QX, KONG W, et al. The urotensin Ⅱ receptor antagonist, urantide, protects against atherosclerosis in rats[J]. Exp Ther Med, 2013, 5(6): 1765–1769. DOI:10.3892/etm.2013.1052 |
| [10] | KONDO T, ENDO I, AIHARA K, et al. Serum carboxy-terminal telopeptide of type Ⅰ collagen levels are associated with carotid atherosclerosis in patients with cardiovascular risk factors[J]. Endocr J, 2016, 63(4): 397–404. |
| [11] | CHUNG E J. Targeting and therapeutic peptides in nanomedicine for atherosclerosis[J]. Exp Biol Med (Maywood), 2016, 241(9): 891–898. DOI:10.1177/1535370216640940 |
| [12] | 田祥全, 万小松, 杨纪才, 等. 血清Ⅰ型胶原羧基末端肽、基质金属蛋白-2水平与冠状动脉病变的关系[J]. 中国循证心血管医学杂志, 2016, 8(5): 553–555. DOI:10.3969/j.issn.1674-4055.2016.05.12 |
| [13] | 刘娜, 资晓宏. 胶原在动脉粥样硬化斑块中的作用研究进展[J]. 浙江临床医学, 2017, 19(2): 377–379. |
| [14] | 赵娟. Urantide抑制动脉粥样硬化大鼠单核细胞趋化蛋白-1的表达[J]. 中国药理学与毒理学杂志, 2011, 25(5): 425–429. DOI:10.3867/j.issn.1000-3002.2011.05.003 |
| [15] | 赵娟, 谢利德, 王红伟, 等. Urantide对实验性动脉粥样硬化大鼠白细胞介素-6表达的影响[J]. 中国老年学杂志, 2013, 33(8): 1823–1824. DOI:10.3969/j.issn.1005-9202.2013.08.041 |
| [16] | ZHAO J, XIE L D, SONG C J, et al. Urantide improves atherosclerosis by controlling C-reactive protein, monocyte chemotactic protein-1and transforming growth factor-Urantide improves atherosclerosis by controlling C reactive protein, monocyte chemotactic protein-1 and transforming growth factor-β expression in rats[J]. Exp Therapeut Med, 2014, 7(10): 1647–1652. |
| [17] | ALBANESE I, DASKALOPOULOU S S, YU B, et al. The urotensin Ⅱ system and carotid atherosclerosis:A role in vascular calcification[J]. Front Pharmacol, 2016, 7: 149–157. |
| [18] | OH K S, LEE J H, YI K Y, et al. A novel urotensin Ⅱ receptor antagonist, KR-36996, improved cardiac function and attenuated cardiac hypertrophy in experimental heart failure[J]. Eur J Pharmacol, 2017, 799: 94–102. DOI:10.1016/j.ejphar.2017.02.003 |
| [19] | CHOW W Y, BIHAN D, FORMAN C J, et al. Hydroxyproline ring pucker causes frustration of helix parameters in the collagen triple helix[J]. Sci Rep, 2015, 5: 12556. DOI:10.1038/srep12556 |
| [20] | 钱进, 邓辰亮, 杨松林, 等. 建立SCID鼠增生性瘢痕模型的实验研究[J]. 组织工程与重建外科杂志, 2018, 14(1): 31–35. DOI:10.3969/j.issn.1673-0364.2018.01.009 |
 2019, Vol. 45
2019, Vol. 45


