扩展功能
文章信息
- 王治国, 刘学明, 周云涛, 佟胜全, 李雅娟, 王茜, 陈南芳
- WANG Zhiguo, LIU Xueming, ZHOU Yuntao, TONG Shengquan, LI Yajuan, WANG Xi, CHEN Nanfang
- 滋阴补肾方联合糖皮质激素对系统性红斑狼疮小鼠T淋巴细胞亚群和炎症细胞因子的影响
- Effects of Nourishing Kidney-Yin Prescription combined with glucocorticoid on T-lymphocyte subsets and inflammatory cytokines in mice with systemic lupus erythematosus
- 吉林大学学报(医学版), 2019, 45(02): 336-341
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 336-341
- 10.13481/j.1671-587x.20190221
-
文章历史
- 收稿日期: 2018-06-10
2. 河北医科大学附属唐山工人医院护理教研室, 河北 唐山 063000;
3. 河北医科大学附属唐山工人医院中心实验室, 河北 唐山 063000
2. Department of Nursing, Tangshan Worker's Hopsital, Heibei Medical University, Tangshan 063000, China;
3. Center Laboratory, Tangshan Worker's Hopsital, Heibei Medical University, Tangshan 063000, China
系统性红斑狼疮(systemiclupus erythematosus, SLE)是一种自身免疫性疾病,严重危害患者的健康,在我国的发病率高达到千分之一[1]。目前SLE的病因以及发病机制尚未明确,普遍认为与免疫功能异常有关。研究[2-3]显示:SLE的免疫性特征为促进T淋巴细胞产生炎症细胞因子,同时刺激B淋巴细胞高度活化,促进机体产生抗体,导致自身炎症反应的发生,且与雌激素水平有关联。临床上采用糖皮质激素(醋酸泼尼松)等免疫抑制剂调节SLE患者免疫系统功能异常,达到预防和控制病程的目的。但该治疗方法在缓解SLE症状的同时,降低患者的自身免疫能力,增加被感染的风险。研究[4-6]显示:通过中药方剂扶正固本的滋补作用,可以弥补免疫抑制剂对机体内环境的损害,能够安全、高效地辅助治疗SLE。滋阴补肾方具有健脾益肾滋阴作用,方中熟地、鳖甲和黄芪等中药起滋阴养血益气作用,薏苡仁和茯苓起健脾作用,弥补了SEL导致的耗气伤津。目前尚未发现滋阴补肾方应用于治疗SEL的报道。因此,本研究比较单用或联合使用滋阴补肾方和糖皮质激素对雌性MRL/lpr小鼠T淋巴细胞亚群和炎症细胞因子水平的影响,为治疗SLE提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器MRL/lpr小鼠50只,由C57BL/6J(H-2b)、C3H/Di(H-2K)、AKR/J(H-2K)和LG/J(H-2b)品系小鼠反复杂交育成,雌性,8周龄,体质量18~22 g,SPF级;C57BL/6小鼠10只,雌性,8周龄,体质量18~22 g,SPF级;购自上海斯莱克实验动物有限责任公司,动物合格证号:SCXK(沪)2017-0005;在SPF级实验动物房适应性饲养1周,饲养温度18℃~22℃,湿度40%~70%,自由摄食饮水。滋阴补肾方(熟地18 g、鳖甲12 g、黄芪12 g、薏苡仁15 g、茯苓9 g、赤芍12 g、柴胡9 g、青蒿9 g和甘草6 g等)水煎浓缩至含生药量1.0 g·mL-1,由广东省中医院提供,-20℃保存;醋酸泼尼松片(天津力士制药股份有限公司);小鼠CD3+、CD4+和CD8+单克隆抗体(FITC/PE标记,美国Ebioscience公司),白细胞介素4 (interleukin-4, IL-4)、白细胞介素6(interleukin-6, IL-6)、γ-干扰素(γ-interferon, IFN-γ) ELISA检测试剂盒(北京莱博生物科技有限公司)。电子分析天平(德国Sartorius公司),高速冷冻离心机(德国Eppendorf公司),-80℃冰箱(日本三洋公司),流式细胞仪(山东莱索科技有限公司),Milli-Q Biocel纯水仪(美国Millipore公司)。
1.2 实验动物分组和给药50只MRL/lpr小鼠分为模型组、西药组、中药组、低和高剂量联合组,每组10只。模型组小鼠采用等量生理盐水灌胃;西药组小鼠灌胃给予糖皮质激素(醋酸泼尼松12.5 mg·kg-1),中药组小鼠灌胃给予补肾滋阴方25.0 g·kg-1,低和高剂量联合组小鼠灌胃给予醋酸泼尼松6.25 mg·kg-1后分别灌胃补肾滋阴方12.5和25.0 g·kg-1;对照组为MRL/lpr的杂交品系C57BL/6小鼠10只,采用等量生理盐水灌胃[7-8]。各组分别连续给药21d,于给药第22天取小鼠血、脾脏和胸腺。
1.3 外周血T淋巴细胞亚群检测取小鼠外周血0.1mL,加入肝素抗凝,加入抗CD3、抗CD4和抗CD8双荧光标记单抗,室温条件下避光孵育20 min,加入1 mL PBS,1500 r·min-1下离心5 min,弃去上清液,加入溶血素溶解红细胞,离心,弃去上清液,加入PBS 1 mL,置于流式细胞仪中检测。
1.4 小鼠血清IL-4、IL-6和IFN-γ水平检测小鼠取血前禁食12 h,眼眶取血后,静置10min,4℃、3500 r·min-1离心15 min,取上清液,于-80℃冰箱保存,小鼠血清IL-4、IL-6和IFN-γ水平的测定严格按照ELISA试剂盒说明书进行。
1.5 病理学观察颈椎脱臼处死小鼠后,迅速取下小鼠肾脏,经肾门切取1/2,于10%甲醛中固定,采用不同梯度的乙醇脱水,浸蜡,石蜡包埋,切片3μm,脱蜡,分别进行苏木精-伊红(HE)染色和PAS染色,采用图像分析系统观察各组小鼠肾小球肿大程度、肾小球基底膜增厚程度、系膜细胞与系膜基质的增生情况和肾炎病变情况等,并记录图像。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组小鼠脏器指数、细胞炎性因子水平和T淋巴细胞亚群水平等均以x±s表示,所有数据均符合正态分布,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠脾脏指数和胸腺指数与对照组比较,模型组小鼠脾脏指数和胸腺指数均明显升高(P < 0.05);与模型组比较,西药组和低及高剂量联合组小鼠脾脏指数及胸腺指数均明显降低(P < 0.05);低和高剂量联合组小鼠脾脏指数及胸腺指数明显低于中药组(P < 0.05)。低和高剂量联合组小鼠脾脏指数及胸腺指数比较差异无统计学意义(P>0.05)。见表 1。
| [n=10, x±s, mB/(mg·g-1)] | ||
| Group | Spleen index | Thymus index |
| Control | 2.68±0.64 | 0.260±0.068 |
| Model | 4.08±0.48* | 0.330±0.048* |
| Western medicine | 2.52±0.55△ | 0.220±0.074△ |
| Chinese medicine | 3.54±0.67 | 0.310±0.051 |
| Combination | ||
| Low dose | 2.75±0.84△# | 0.230±0.048△# |
| High dose | 2.67±0.48△# | 0.250±0.042△# |
| *P < 0.05 compared with control group; △P < 0.05 compared with model group; #P < 0.05 compared with Chinese medicine group. | ||
与对照组比较,模型组小鼠CD3+T淋巴细胞水平、CD4+T淋巴细胞水平和CD4+/CD8+比值明显降低(P < 0.05),CD8+ T淋巴细胞水平明显升高(P < 0.05);与模型组比较,中药组和低及高剂量联合组小鼠CD3+ T淋巴细胞水平、CD4+ T淋巴细胞水平和CD4+/CD8+比值明显升高(P < 0.05),CD8+ T淋巴细胞水平明显降低(P < 0.05);与中药组和西药组比较,低和高剂量联合组小鼠CD3+ T淋巴细胞水平、CD4+ T淋巴细胞水平和CD4+/ CD8+比值明显升高(P < 0.05),CD8+ T淋巴细胞水平明显降低(P < 0.05)。与低剂量联合组比较,高剂量联合组小鼠CD4+ T淋巴细胞水平和CD4+/CD8+比值明显升高(P < 0.05),CD8+T淋巴细胞水平明显降低(P < 0.05),2组间CD3+ T淋巴细胞水平比较差异无统计学意义(P>0.05)。见表 2。
| (n=10, x±s) | ||||
| Group | CD3+(η/%) | CD4+(η/%) | CD8+(η/%) | CD4+/ CD8+ |
| Control | 17.78±3.24 | 19.97±2.64 | 9.56±1.15 | 2.02±0.84 |
| Model | 11.46±1.97* | 10.12±1.35* | 14.26±1.67* | 0.71±0.15* |
| Western medicine | 12.14±1.57 | 11.98±1.25 | 10.64±1.20△ | 1.25±0.54△ |
| Chinese medicine | 14.25±2.27△ | 12.56±2.65△ | 10.47±2.12△ | 1.28±1.24△ |
| Combination | ||||
| Low dose | 16.86±1.54△#○ | 16.14±1.84△#○ | 9.65±0.94△#○ | 1.71±0.87△#○ |
| High dose | 17.22±2.14△#○ | 18.65±2.05△#○▲ | 8.65±1.33△#○▲ | 2.08±0.70△#○▲ |
| *P < 0.05 compared with control group; △P < 0.05 compared with model group; #P < 0.05 compared with Western medicine group; ○P < 0.05 compared with Chinese medicine group; ▲P < 0.05 compared with low dose of combination group. |
||||
与对照组比较, 模型组小鼠血清IL-4和IL-6水平明显升高(P < 0.05),IFN-γ水平明显降低(P < 0.05);与模型组比较,西药组、中药组和低及高剂量联合组小鼠血清IL-4和IL-6水平明显降低(P < 0.05),IFN-γ水平明显升高(P < 0.05);与中药组比较,低和高剂量联合组小鼠血清IL-4和IL-6水平明显降低(P < 0.05);与西药组比较,低和高剂量联合组小鼠血清IFN-γ水平明显升高(P < 0.05);与低剂量联合组比较,高剂量联合组小鼠血清IFN-γ水平明显升高(P < 0.05),IL-4和IL-6水平比较差异无统计学意义(P>0.05)。见表 3。
| [n=10, x±s, ρB/(ng·L-1)] | |||
| Group | IL-4 | IL-6 | IFN-γ |
| Control | 4.24±1.14 | 3.94±1.48 | 26.44±4.17 |
| Model | 16.24±3.65* | 11.24±3.67* | 9.58±1.83* |
| Western medicine | 7.64±1.34△ | 6.65±2.58△ | 14.61±2.25△ |
| Chinese medicine | 8.94±2.62△ | 7.53±2.64△ | 18.34±2.90△ |
| Combination | |||
| Low dose | 7.24±2.85△○ | 5.88±1.84△#○ | 18.64±3.18△# |
| High dose | 6.04±1.58△#○ | 5.34±1.38△#○ | 23.58±3.58△#○▲ |
| *P < 0.05 compared with control group; △P < 0.05 compared with model group; #P < 0.05 compared with Western medicine group; ○P < 0.05 compared with Chinese medicine group; ▲P < 0.05 compared with low dose of combinatin group. |
|||
HE染色结果显示:对照组小鼠肾小球呈球形,无肿胀或萎缩,系膜细胞正常,系膜基质无增生。与对照组比较,模型组小鼠肾小球肿胀,肾小球毛细血管基底膜明显增厚,系膜细胞明显增多,系膜基质明显增生,可见白细胞浸润,肾小管水肿,肾间质可见炎性细胞浸润。与模型组比较,西药组、中药组和低及高剂量联合组小鼠肾小球细胞数毛细血管基底膜增厚程度明显改善,系膜细胞与基质增生病变情况减轻,淋巴细胞浸润程度减少。低和高剂量联合组小鼠病理情况的改善明显优于西药组与中药组。低和高剂量联合组比较无明显差异。见图 1(插页四)。
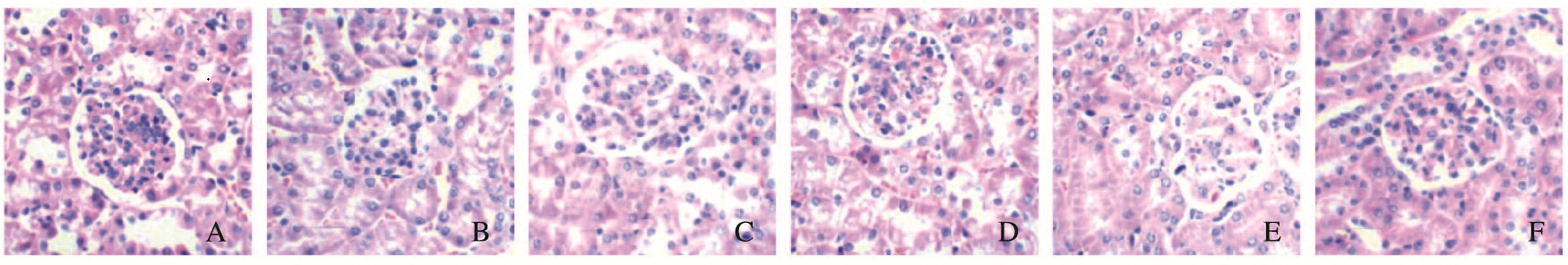
|
| A:Control group; B:Model group; C:Western medicine group; D:Chinese medicine group; E:Low dose of combination group; F:High dose of combination group. 图 1 各组小鼠肾组织HE染色结果(×400) Fig. 1 HE staining results of kidney tissue of mice in various groups(×400) |
|
|
PAS染色结果显示:对照组小鼠肾小球系膜细胞与系膜基质数量正常,肾小球内皮和上皮无沉积。模型组小鼠肾小球系膜细胞与系膜基质增生,肾小球内皮下与上皮下可见大量嗜伊红物质沉积。与模型组小鼠比较,西药组、中药组和低及高剂量联合组小鼠肾小球病变程度明显改善,高剂量联合组小鼠系膜细胞与系膜基质增生程度低于西药组、中药组和低剂量联合组。见图 2(插页四)。
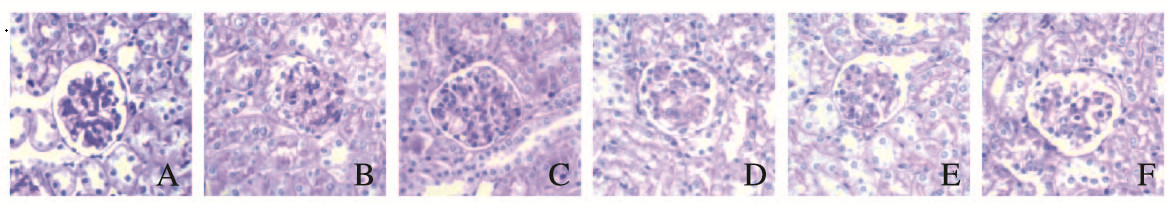
|
| A:Control group; B:Model group; C:Western medicine group; D:Chinese medicine group; E:Low dose of combination group; F:High dose of combination group. 图 2 各组小鼠肾组织PAS染色结果(×400) Fig. 2 PAS staining results of kidney tissue of mice in various groups(×400) |
|
|
目前研究[9]认为:SLE的发病原因与自身遗传物质有关,是由外环境因素引起,导致机体自身免疫功能亢进并产生大量抗体而发生的炎症反应。本研究动物模型选用由LG/J、AKR/J、C3H/D和C57BL/6等品系小鼠杂交至12代产生的MRL/lpr SLE小鼠,具有血管炎症、肾炎、淋巴腺疾病和脾脏水肿等与人类SLE相似的临床特征;对照组采用不具有SEL病征的C57BL/6小鼠作为实验对照。中医认为SLE热毒,耗伤阴气,又因SLE患者体阴,体虚火旺,往往表现为气阴两伤、兼夹瘀热,属“虚劳”[10-11]。滋阴补肾方由熟地、鳖甲、薏苡仁、茯苓、赤芍、柴胡、青蒿和甘草等多味补阴药组成,具有清热解毒、健脾补肾和滋阴养血的功效。
中医认为的“脾胃者,仓禀之官”,脾脏具有运化水谷、产生精微的功能[12]。脾脏和胸腺作为全身免疫器官,能够客观反映机体的免疫能力。本研究结果显示:模型组小鼠脾脏指数和胸腺指数明显升高,反映出MRL/lpr小鼠免疫功能比正常小鼠亢进。滋阴补肾方中对脏器指数的无明显影响,可能与方中薏苡仁和茯苓等中药对脾脏滋补作用有关,在糖皮质激素的作用下,与对照组比较,联合组小鼠脾脏指数和胸腺指数有所改善。B淋巴细胞、T淋巴细胞及相关免疫细胞因子在SLE发病免疫应答过程中发挥着重要的作用[13-15]。其中T淋巴细胞又分为Th效应细胞(Th1和Th2),Th1细胞主要介导细胞免疫,释放IFN-γ等细胞因子,发挥吞噬效应;Th2主要介导体液免疫,释放IL-4和IL-6等细胞因子,介导免疫应答,促进T淋巴细胞等免疫细胞增殖,导致机体免疫功能紊乱,发生自身免疫损伤[16-18]。IFN-γ主要介导细胞免疫反应、迟发型超敏反应和急性移植排斥反应等炎症反应,通常作为SLE的诊断指标[19]。研究[20]显示:在伴有中枢神经系统损害的狼疮患者脑脊液中IL-4、IL-6和IFN-γ的表达异常。本研究结果显示:糖皮质激素和滋阴补肾方均能明显降低SEL模型小鼠血清中IL-4和IL-6水平,升高IFN-γ水平,表明二者具有抗炎作用,糖皮质激素与滋阴补肾方联合使用的抗炎效果更明显。T细胞亚群分为CD4+T淋巴细胞和CD8+T淋巴细胞2个亚群。CD3+T淋巴细胞主要表达于所有成熟细胞表面,共同参与抗原应急的机体免疫反应。CD4+T细胞为调节性细胞,具有免疫调节能力,能够通过细胞接触依赖机制或抑制性细胞因子依赖机制抑制自身免疫细胞的活化,防止自身免疫疾病的发生[21-22]。本研究结果显示:滋阴补肾方能明显提高CD4+T淋巴细胞水平,糖皮质激素和滋阴补肾方均能降低CD8+T淋巴细胞水平,二者联合使用能更有效地调节T淋巴细胞亚群平衡。
综上所述,滋阴补肾方能够扶正SLE发病过程中机体的损耗,联合糖皮质激素使用,能减少糖皮质激素的不良反应,弥补单用糖皮质激素免疫抑制治疗后不能扶正机体内环境的不足,有效调节机体免疫平衡。
| [1] | 游弋. 系统性红斑狼疮2017年研究进展[J]. 皮肤病与性病, 2018, 40(2): 176–177. |
| [2] | ALI M, FIROZ C K, JABIR N R, et al. An insight on the pathogenesis and treatment of systemic lupus erythematosus[J]. Endocr Metab ImmuneDisord Drug Targets, 2018, 18(2): 110–123. DOI:10.2174/1871530318666171207145003 |
| [3] | 王大维, 汪梅姣, 谷焕鹏, 等. 从雌激素受体探讨解毒祛瘀滋阴药对SLE的治疗机制[J]. 中国中医急症, 2017, 26(9): 1505–1508, 1513. DOI:10.3969/j.issn.1004-745X.2017.09.001 |
| [4] | 韩曼, 姜泉. 中医治疗系统性红斑狼疮的思路与实践[J]. 中华中医药杂志, 2017, 32(10): 4537–4539. |
| [5] | 郑虹. 益气养阴法联合糖皮质激素对系统性红斑狼疮患者免疫功能的影响[J]. 时珍国医国药, 2014, 25(4): 894–896. |
| [6] | 林昌松, 李宁, 徐强, 等. "知柏养阴汤"联合糖皮质激素治疗系统性红斑狼疮60例临床研究[J]. 江苏中医药, 2011, 43(11): 13–15. DOI:10.3969/j.issn.1672-397X.2011.11.008 |
| [7] | 林宁, 钟嘉熙, 邱斌, 等. 青蒿鳖甲汤加减对MRL/lpr狼疮鼠Th17细胞及肾脏病理的影响[J]. 广州中医药大学学报, 2014, 31(5): 776–779, 785. |
| [8] | 沈家敏, 吴艮艮, 梁涛. 具有SLE疾病症状的MRL/lpr小鼠体内自噬水平检测[J]. 免疫学杂志, 2017, 33(10): 867–871. |
| [9] | 张青华, 李南, 陈嵘祎, 等. T细胞亚群和白细胞介素36在系统性红斑狼疮发病机制中的研究进展[J]. 国际皮肤性病学杂志, 2016, 42(3): 178–180. DOI:10.3760/cma.j.issn.1673-4173.2016.03.015 |
| [10] | 林丽, 万春平, 李小丝, 等. 益气养阴补肾方联合激素对自发狼疮转基因小鼠增效减毒作用的研究[J]. 时珍国医国药, 2017, 28(5): 1044–1046. |
| [11] | 张颖, 李珍. 狼疮性肾炎的中西医护理研究[J]. 内蒙古中医药, 2014, 33(16): 156–157. |
| [12] | 胡笛, 程丑夫. 程丑夫从胃热论治疑难杂症验案4则[J]. 湖南中医杂志, 2017, 33(3): 96–98. |
| [13] | KARRAR S, CUNNINGHAME GRAHAM D S. Abnormal B-cell development in systemic lupus erythematosus:what the genetics tell us[J]. Arthritis Rheumatol, 2018, 70(4): 496–507. DOI:10.1002/art.40396 |
| [14] | MIZUI M, TSOKOS G C. Targeting regulatory T cells to treat patients with systemic lupus erythematosus[J]. Front Immunol, 2018, 9(4): 1–9. |
| [15] | ZHOU H Y, HU B L, HUANG N W, et al. Aberrant T cell subsets and cytokines expression profile in systemic lupus erythematosus[J]. Clin Rheumatol, 2018, 37(9): 2405–2413. DOI:10.1007/s10067-018-4124-0 |
| [16] | 顾敏, 谢雁鸣. 中药过敏反应中细胞因子的表达[J]. 国际检验医学杂志, 2016, 37(19): 2740–2742. DOI:10.3969/j.issn.1673-4130.2016.19.033 |
| [17] | 甄洪花, 王金良, 单虎, 等. 猪IL-2与IL-6的融合表达及其产物的促淋巴细胞增殖活性[J]. 畜牧兽医学报, 2010, 41(6): 741–745. |
| [18] | FLEISCHER S, RIES S, SHEN P, et al. Anti-interleukin-6 signalling therapy rebalances the disrupted cytokine production of B cells from patients with active rheumatoid arthritis[J]. Eur J Immunol, 2018, 48(1): 194–203. |
| [19] | CHASSET F, ARNAUD L. Targeting interferons and their pathways in systemic lupus erythematosus[J]. Autoimmun Rev, 2018, 17(1): 44–52. DOI:10.1016/j.autrev.2017.11.009 |
| [20] | YAO Y, WANG J B, XIN M M, et al. Balance between inflammatory and regulatory cytokines in systemic lupus erythematosus[J]. Genet Mole Res, 2016, 15(2): 1–8. |
| [21] | 徐毅芳, 寿张飞. 调节性T细胞在移植耐受中的作用[J]. 国际移植与血液净化杂志, 2008, 6(2): 40–43. DOI:10.3760/cma.j.issn.1673-4238.2008.02.013 |
| [22] | 葛宽雪, 高伟华, 向晓星. 辅助性T淋巴细胞17和调节性T淋巴细胞及其平衡改变与自身免疫性肝炎的关系[J]. 临床肝胆病杂志, 2018, 34(7): 1573–1576. DOI:10.3969/j.issn.1001-5256.2018.07.045 |
 2019, Vol. 45
2019, Vol. 45


