扩展功能
文章信息
- 孙晓旭, 王途, 崔海鹏, 刘凯, 高海成, 赵娟
- SUN Xiaoxu, WANG Tu, CUI Haipeng, LIU Kai, GAO Haicheng, ZHAO Juan
- urantide对动脉粥样硬化大鼠血钙、血脂和心肌酶学指标的影响
- Effects of urantide on serum calcium, blood lipids and indexes of myocardial enzymes in rats with atherosclerosis
- 吉林大学学报(医学版), 2019, 45(02): 331-335
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 331-335
- 10.13481/j.1671-587x.20190220
-
文章历史
- 收稿日期: 2018-07-09
2. 吉林大学药学院临床药学教研室, 吉林 长春 130021
2. Department of Clinical Pharmacy, School of Pharmacy, Jilin University, Changchun 130021, China
动脉粥样硬化(atherosclerosis, AS)是心血管系统的常见疾病,其发生时动脉内膜脂质沉积形成粥样斑块,引起血管腔狭窄或阻塞,进而引起机体缺血和缺氧等病理改变[1-3]。检测相关血清学指标及心肌酶学指标的变化对临床诊断和治疗AS具有重要的参考价值。urantide是在人尾加压素Ⅱ(urotensin Ⅱ, UⅡ)基础上衍生的多肽类受体拮抗剂,其可特异性阻断UⅡ与其受体GPR14结合并抑制其进入细胞发挥生物学作用,对治疗AS具有潜在的临床应用价值[4]。国内外研究[5-7]显示:在AS发生发展过程中血钙、血脂和心肌酶学等血清学指标发生异常,其含量变化对评估AS严重程度具有重要的临床意义,但关于urantide对其影响少有报道。本课题组采用多肽类化合物urantide治疗AS大鼠,并监测其体质量和检测血清中Ca2+、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白(low density lipoprotein, LDL)、高密度脂蛋白(high density lipoprotein, HDL)、肌酸激酶(creatine kinase, CK)和乳酸脱氢酶(lactic dehydrogenase, LDH)等血清学指标水平变化,初步探讨urantide对防治AS的作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器SPF级健康雄性Wistar大鼠180只,3周龄,体质量为180~200 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)-2016-0011,生产合格证号:11400700127208。urantide由苏州强耀生物公司提供,辛伐他汀(simvastatin)购于北京诺华制药有限公司,维生素D3(VD3)注射液购自上海通用药业股份有限公司。全自动生化分析仪购自美国贝克曼库尔特公司,全自动封闭脱水机、组织包埋机、石蜡切片机、生物组织恒温摊片烤片机和数码显微镜购自德国莱卡公司。
1.2 大鼠AS模型制备和实验分组高脂饲料的配制:基础饲料,35%胆固醇,10%猪油,0.2%丙硫氧嘧啶,0.5%胆酸钠,5%白糖。Wistar大鼠180只随机分为2组。其中正常对照组30只,饲以普通饲料;模型组150只,在实验开始时饲以高脂饲料,并在此基础上每只大鼠连续3 d给予腹腔注射VD3 150 U·kg-1·d-1,实验周期为4周。AS造模成功后,将150只模型组大鼠随机分为AS模型组(n=30)、阳性药(辛伐他汀)组(n=30)和urantide组(n=90,给药时间分别为3、7和14 d,每个时间点亚组30只)。正常对照组和AS组大鼠每日尾静脉注射生理盐水30 μg·kg-1,连续14 d;辛伐他汀组每只大鼠每日灌胃给予辛伐他汀5 μg·kg-1,连续14 d;urantide组每只大鼠每日尾静脉注射urantide 30 μg·kg-1,给药时间分别为3、7和14 d。
1.3 一般状态观察每周观察各组大鼠的精神状态和饮食,并监测体质量。
1.4 血清标本采集和各指标测定病理取材前,各组大鼠禁食过夜,用0.3%戊巴比妥30 mg·kg-1腹腔注射麻醉后,分离胸主动脉,并用真空采血管采集动脉血。1500g离心15 min后吸取上清分装于Eppendorf管中,全自动生化分析仪检测大鼠血清中Ca2+、TC、TG、LDL、HDL、CK和LDH水平。
1.5 胸主动脉标本采集取血后,立即摘取胸主动脉,4%多聚甲醛固定,大鼠胸主动脉经脱水、透明、浸蜡、包埋后制备成石蜡切片,经二甲苯脱蜡、梯度乙醇水化、常规HE染色后,光镜下观察各组大鼠胸主动脉组织病理学变化。
1.6 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠体质量和血清中Ca2+、TC、TG、LDL、HDL、CK及LDH水平均以x±s表示,在符合正态分布前提下,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 2组大鼠胸主动脉形态学表现HE染色结果显示:正常对照组大鼠胸主动脉三层膜结构完整,内皮细胞清晰,中膜平滑肌细胞排列整齐,外膜由疏松结缔组织构成;AS组大鼠胸主动脉内皮细胞破坏,且中膜有明显的钙化、炎细胞浸润,弹力纤维破坏、变薄,并形成脂质斑块,呈典型的AS病理改变,表明通过腹腔注射VD3和高脂饲料喂养4周成功建立大鼠AS模型。见图 1(插页四)。
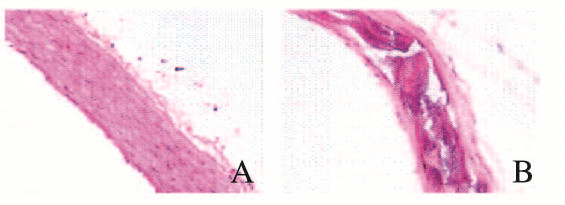
|
| A: Normal control group; B: AS group. 图 1 2组大鼠胸主动脉形态表现(HE,×400) Fig. 1 Morphology of thoracic aorta of rats in two groups(HE, ×400) |
|
|
实验开始时,各组大鼠体质量相近,组间比较差异无统计学意义(P>0.05)。给药前,正常对照组大鼠体质量随着饲养时间的延长而增加;与正常对照组比较,其他各组大鼠体质量明显降低(P < 0.01)。实验结束时,正常对照组大鼠体质量继续增加;与AS组比较,其他各给药组大鼠体质量有不同程度的增加(P < 0.05或P < 0.01)。见表 1。
| (n=30, x±s, m/g) | |||
| Group | Body weight | ||
| Pre-experiment | Pre-administration | End of experiment | |
| Normal control | 180.10±5.48 | 369.58±38.26 | 413.27±23.89 |
| AS | 181.30±9.16 | 194.80±17.19* | 162.36±19.38* |
| Simvastatin | 182.95±6.37 | 193.05±22.47* | 187.23±42.11*△ |
| Urantide | |||
| 3 d | 185.25±6.74 | 203.24±23.12* | 163.88±23.08* |
| 7 d | 181.74±6.72 | 197.28±19.58* | 179.12±24.34*△ |
| 14 d | 180.18±5.32 | 180.98±17.31* | 195.66±20.98*△△ |
| ** P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with AS group. | |||
与正常对照组比较,AS组大鼠血清中Ca2+、TG、TC和LDL水平均明显升高(P < 0.01),HDL水平明显降低(P < 0.01);与AS组比较,辛伐他汀组大鼠血清中Ca2+、TG、TC和LDL水平明显降低(P < 0.05或P < 0.01),HDL水平明显升高(P < 0.05或P < 0.01);与AS组比较,urantide组大鼠血清中Ca2+、TG、TC和LDL水平明显降低(P < 0.05或P < 0.01),HDL水平升高(P < 0.01)。见表 2。
| [n=30, x±s, cB/(mmol·L-1)] | |||||
| Group | Ca2+ | TC | TG | HDL | LDL |
| Normal control | 2.60±0.56 | 2.26±0.71 | 0.28±0.08 | 3.20±0.79 | 0.30±0.08 |
| AS | 3.95±0.42** | 12.25±1.92** | 0.77±0.12** | 0.93±0.23** | 1.70±0.32** |
| Simvastatin | 3.63±0.13**△ | 4.06±1.51**△△ | 0.41±0.12*△△ | 2.16±0.35*△△ | 0.77±0.19**△△ |
| Urantide | |||||
| 3 d | 3.46±0.32**△ | 7.50±1.59**△△ | 0.55±0.20**△ | 1.48±0.37**△△ | 1.05±0.31**△△ |
| 7 d | 3.22±0.29**△△ | 5.28±0.89**△△ | 0.37±0.15△△ | 1.91±0.66**△ | 0.84±0.27**△△ |
| 14 d | 3.68±0.30** | 8.33±1.43**△△ | 0.59±0.21** | 1.02±0.44** | 1.27±0.27**△ |
| *P < 0.05, * * P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with AS group. | |||||
与正常对照组比较,AS组大鼠血清中CK和LDH水平明显升高(P < 0.01);与AS组比较,辛伐他汀组大鼠血清中CK和LDH水平明显降低(P < 0.01);与AS组比较,urantide组大鼠血清CK和LDH水平明显降低(P < 0.05或P < 0.01)。见表 3。
| [n=30, x±s, λB/(U·L-1)] | ||
| Group | CK | LDH |
| Normal control | 323.22±82.67 | 177.77±52.20 |
| AS | 675.25±117.49** | 434.53±72.81** |
| Simvastatin | 396.73±98.10△△ | 214.38±80.75△△ |
| Urantide | ||
| 3 d | 459.96±174.78*△△ | 282.27±85.28**△ |
| 7 d | 437.81±99.07*△△ | 260.63±53.87**△△ |
| 14 d | 534.40±150.46** | 257.09±89.56*△△ |
| *P < 0.05, **P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with AS group. |
||
AS发生发展的机制有很多学说,如炎症学说、内皮损伤学说、脂质浸润学说、血管平滑肌细胞增殖学说和血栓形成学说等,而每个机制均无法完全解释AS的发生。因此,AS发生发展机制和治疗药物的探讨成为医学研究的热点。
UⅡ最早是从鱼的脊髓尾部下垂体中分离出的生长抑素样环肽,其收缩血管作用是内皮素1的10倍以上, 在AS发生发展中具有重要的作用[8]。特异性UⅡ受体拮抗剂的发展,可能使UⅡ成为心血管疾病治疗的新靶点。urantide是目前被认为最有效的UⅡ受体拮抗剂,其拮抗效应较其他化合物高50~100倍。本课题组前期研究[7, 9]显示:urantide可加速AS大鼠胸主动脉的胶原蛋白降解,抑制UⅡ对动脉炎症损伤的促进作用,改善AS病变程度,但其具体的作用机制尚未阐明。
AS的发生不仅伴有血管壁成分的改变及AS斑块的沉积,而且常伴有血清学指标和心肌酶学指标的改变。研究[10-15]显示:AS斑块中富含TC和脂质积聚是AS的一个重要特征。①胆固醇进入到血管内皮下,经巨噬细胞吞噬形成泡沫细胞,标志着AS的形成;②TG被认为是AS的独立危险因素,主要存在于富含TG的LDL中,氧化LDL可引起巨噬细胞对脂质的摄取和泡沫细胞的形成;③LDL在AS中发挥重要作用,能诱导体外培养的血管内皮中形成泡沫细胞;④相反,HDL的升高则可阻止或减轻LDL对内皮细胞的破坏,被称为“抗AS因子”,这与HDL具有转运胆固醇的能力有关。LDH和CK是临床中衡量心脏功能的常用指标。研究[16-17]显示:在AS形成过程中,血清中LDH和CK的活性会逐渐升高,并有可能成为AS早期诊断和监测的一项新的指标。本研究结果显示:与正常对照组比较,AS组大鼠血清中TG、TC、LDL、LDH和CK水平明显升高,HDL水平明显降低;随着给药时间的延长,urantide组大鼠血清中TG、TC、LDL、LDH和CK水平降低,HDL水平升高。且urantide治疗组较AS组大鼠体质量均有所增加,体质量不同程度增加为AS大鼠的治疗与恢复提供生理基础与保障。
动脉内膜钙沉着是AS的一个显著特征,动脉粥样斑块中富含Ca2+,且其含量与AS的病变程度呈正相关关系[18]。多项研究[19-22]结果显示:UⅡ与其受体GPR14结合可通过非电压依赖性Ca2+通道促进Ca2+内流,引发血管收缩效应,进而诱发高血压和冠心病等血管疾病。本研究结果显示:AS组大鼠血清中Ca2+水平明显高于正常对照组,而urantide可明显降低AS大鼠血清中Ca2+水平。由此表明:urantide通过降低血清中Ca2+水平,抑制细胞Ca2+通道的开放及Ca2+内流,可减少心肌兴奋收缩偶联的发生,缓解大鼠AS症状。
综上所述,urantide可通过下调或上调大鼠血清中血脂、血Ca2+及心肌酶水平起到治疗AS大鼠的目的,但其作用机制仍有待于进一步研究。随着研究的深入,urantide在AS发生发展中的病理生理学作用将被进一步阐明,为其临床应用治疗AS提供实验依据。
| [1] | TORRES N, GUEVARA-CRUZ M, VELAZQUEZ-VILLEGAS L A, et al. Nutrition and Atherosclerosis[J]. Arch Med Res, 2015, 46(5): 408–426. DOI:10.1016/j.arcmed.2015.05.010 |
| [2] | MITRA R, ONEIL G L, HARDING I C, et al. Glycocalyx in atherosclerosis-relevant endothelium function and as a therapeutic target[J]. Curr Atheroscler Rep, 2017, 19(12): 63. DOI:10.1007/s11883-017-0691-9 |
| [3] | YAO Z. Frontiers in atherosclerosis, heart disease and diabetes[J]. Cardiovasc Hematol Disord Drug Targets, 2014, 14(2): 87–88. DOI:10.2174/1871529X1402140807142745 |
| [4] | ZHAO J, YU QX, KONG W, et al. The urotensin Ⅱ receptor antagonist, urantide, protects against atherosclerosis in rats[J]. Exp Ther Med, 2013, 5(6): 1765–1769. DOI:10.3892/etm.2013.1052 |
| [5] | LU R, YUAN T, WANG Y, et al. Spontaneous severe hypercholesterolemia and atherosclerosis lesions in rabbits with deficiency of low-density lipoprotein receptor(LDLR) on exon 7[J]. EBioMedicine, 2018, 36: 29–38. DOI:10.1016/j.ebiom.2018.09.020 |
| [6] | MICKIEWICZ A, BOROWIEC-WOLNA J, BACHORSKI W, et al. Long-term lipoprotein apheresis in the treatment of severe familial hypercholesterolemia refractory to high intensity statin therapy:Three year experience at a lipoprotein apheresis centre[J]. Cardiol J, 2018, 9(7): 1–23. |
| [7] | CAO F, ZERVOU S, LYQATE C A. The creatine kinase system as a therapeutic target for myocardial ischaemia-reperfusion injury[J]. Biochem Soc Trans, 2018, 46(5): 1119–1127. DOI:10.1042/BST20170504 |
| [8] | 赵娟, 宋成军, 姜菊花, 等. Urantide对实验性动脉粥样硬化大鼠肝脏的影响[J]. 中国老年学杂志, 2014, 34(4): 940–942. DOI:10.3969/j.issn.1005-9202.2014.04.038 |
| [9] | ZHAO J, XIE L D, SONG C J, et al. Urantide improves atherosclerosis by controlling C-reactive protein, monocyte chemotactic protein-1and transforming growth factor-Urantide improves atherosclerosis by controlling Creactive protein, monocyte chemotactic protein-1 and transforming growth factor-β expression in rats[J]. Therapeut Med, 2014, 7(10): 1647–1652. |
| [10] | GUO Y, YUAN W, YU B, et al. Synthetic high-density lipoprotein-mediated targted delivery of liver x receptors agonist promotes atherosclerosis regression[J]. EBioMedicine, 2018, 28: 225–233. DOI:10.1016/j.ebiom.2017.12.021 |
| [11] | KEYAMURA Y, NAQANO C, KOHASHI M, et al. Dietary cholesterol atherogenic changes in juvenile rabbits[J]. Biol Pharm Bull, 2015, 38(5): 785–788. DOI:10.1248/bpb.b14-00775 |
| [12] | GO G W. Low-density lipoprotein receptor-related protein 6(LRP6) is a novel nutreitional therapeutic target for hyperlipidemia, non-alcohilic, fatty liver disease and atherosclerosis[J]. Nutrients, 2015, 7(6): 4453–4464. DOI:10.3390/nu7064453 |
| [13] | SOBENIN I A, SALONEN J T, ZHELANKIN A V, et al. Low density lipoprotein-containing circulating immune complexes:role in atherosclerosis and diagnostic value[J]. Biomed Res Int, 2014, 2014: 205697. |
| [14] | HU J, XI D, ZHAO J, et al. High-density lipoprotein and inflammation and its significance to atherosclerosis[J]. Am J Med Sci, 2016, 352(4): 408–415. DOI:10.1016/j.amjms.2016.06.014 |
| [15] | FEIQ J E, HEWINQ B, SMITH J D, et al. High-density lipoprotein and atherosclerosis regression:evidence from preclinical and clinical studies[J]. Circ Res, 2014, 114(1): 205–213. DOI:10.1161/CIRCRESAHA.114.300760 |
| [16] | 江志奎, 朱华庆, 周青, 等. 动脉粥样硬化兔模型血液中乳酸脱氢酶和肌酸激酶的动态分析[J]. 安徽医科大学学报, 2004, 39(1): 12–15. DOI:10.3969/j.issn.1000-1492.2004.01.004 |
| [17] | 马宏昆, 张文. 动脉粥样硬化性肾动脉狭窄的评估与干预[J]. 中国实用内科杂志, 2018, 38(12): 1203–1207. |
| [18] | ALEVRIADOU B R, SHANMUGHAPRIYA S, PATEL A, et al. Mitochondrial Ca2+ transport in the endotheliun:regulation by ions, redox signaling and mechanical forces[J]. J R Soc Interface, 2017, 14(137): 1–15. |
| [19] | SADDOUK F Z, GINNAN R, SINQER H A. Ca2+/calmodulin-dependent protein kinase Ⅱ in vascular smooth muscle[J]. Adv Pharmacol, 2017, 78(10): 171–202. |
| [20] | TAYLOR M S, CHOI C S, BAYAZID L, et al. Changes in vascular reactivity and endothelial Ca2+ dynamics with chronic low flow[J]. Microcirculation, 2017, 24(3): 1–24. |
| [21] | SU J, ZHOU H, LIU X, et al. OxLDL antibody inhibits MCP-1 release in monocytes/macrophages by regulating Ca2+/K+ channel flow[J]. J Cell Mol Med, 2017, 21(5): 929–940. DOI:10.1111/jcmm.2017.21.issue-5 |
| [22] | BRYAN R, KATHERINE M, ADEL G. Role of urotensin Ⅱ in health and disease[J]. Am J Physiol Regul Integer Comp Physiol, 2010, 298(5): R1156–R1172. DOI:10.1152/ajpregu.00706.2009 |
 2019, Vol. 45
2019, Vol. 45


