扩展功能
文章信息
- 于涛, 焦雪, 付长峰, 李嵚
- YU Tao, JIAO Xue, FU Changfeng, LI Qin
- 仙客来皂苷对肝癌细胞体外增殖和凋亡的选择性作用及其机制
- Selective effects of cyclamin on proliferation and apoptosis of liver cancer cells and their mechanisms
- 吉林大学学报(医学版), 2019, 45(02): 319-324
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 319-324
- 10.13481/j.1671-587x.20190218
-
文章历史
- 收稿日期: 2018-06-20
2. 吉林大学第一医院脊柱外科, 吉林 长春 130021
2. Department of Spine Surgery, First Hospital, Jilin University, Changchun 130021, China
胆固醇作为主要成分之一的细胞膜脂筏结构已被证实参与多种肿瘤细胞的生物学活性,包括细胞增殖和凋亡[1-2]。以细胞膜胆固醇成分为靶点的抗肿瘤药物开发已成为肿瘤特异治疗重要的研究方向[3-5]。国内外研究[6-8]显示:三萜皂苷类化合物普遍具有与胆固醇分子作用从而改变细胞膜结构和通透性的生物学活性,并对多种肿瘤细胞具有抗肿瘤活性,其机制与破坏细胞膜结构以及激活细胞凋亡相关信号通路有关。本文作者前期研究[9-10]结果显示:紫金牛科植物紫金牛(Ardisia japonica)中分离提取的三萜皂苷类化合物仙客来皂苷(cyclamin)具有对肝癌细胞的选择性增殖抑制和诱导凋亡作用,并特异性地增强5-氟尿嘧啶(5-fluorouracil, 5-Fu)、顺铂和表阿霉素等化疗药物对肝癌细胞的杀伤作用。但其肿瘤选择性增殖抑制和诱导凋亡作用的分子机制尚不完全明确,该活性是否与细胞中胆固醇成分相关尚未见报道。本研究通过比较人肝癌HepG2细胞和正常人HL-7702肝细胞中胆固醇水平差异,利用MTT法、流式细胞术、乳酸脱氢酶(lactate dehydrogenase,LDH)释放法和Western blotting法研究仙客来皂苷对肝癌细胞选择性细胞毒作用的分子机制,阐明仙客来皂苷是否以胆固醇作为其特异性抗肝癌作用的分子靶点,为该药物在临床肝癌化疗上的应用奠定理论和实践基础。
1 材料与方法 1.1 材料、细胞、主要试剂和仪器仙客来皂苷(纯度大于98%)由日本东邦大学药学部提供[11],以DMSO溶解配成2 mmol·L-1的储存液,并置于-20℃长期保存。HepG2细胞和HL-7702细胞购于中科院上海细胞库。高糖DMEM培养基、RPMI 1640培养基,胎牛血清和0.25%胰蛋白酶溶液均购于美国Hyclone公司,胆固醇购自上海鼎国生物技术公司,胆固醇标记物Filipin Ⅲ购自美国Sigma公司,MTT购于美国AMRESCO公司,细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司,LDH释放检测试剂盒、蛋白裂解液和BCA蛋白浓度测定试剂盒均购自杭州碧云天生物技术研究所,Fas、FADD、caspase-8和β-actin抗体购自美国Abcam公司,HRP标记抗兔和抗鼠的二抗均购自北京中杉金桥生物技术有限公司。流式细胞仪(BD FACSCalibur)购自美国BD公司,正置荧光显微镜(Eclipse Ni-U)购自日本尼康公司,酶标仪(2010型)购自奥地利安图斯仪器公司,数码凝胶图像分析系统(Tanon-4200SF)购自上海天能科技有限公司。
1.2 细胞培养条件人肝癌细胞HepG2用含10%胎牛血清的高糖DMEM培养基,人正常肝细胞HL7702用含10%胎牛血清的RPMI1640培养基,置于37℃、5%CO2的培养箱中培养,每2~3 d换液。当细胞密度达培养瓶底面积的80%时,以1:2比例传代继续培养。
1.3 细胞存活率检测和LDH释放实验细胞存活率检测和LDH释放实验方法参照本文作者前期研究[9]。将对数生长期的HepG2或HL-7702细胞按每孔5×103个细胞的密度接种于96孔培养板中,分为对照组(0.5% DMSO)、仙客来皂苷组和胆固醇干预组。仙客来皂苷组加入不同浓度(0、2.5、5.0和10.0 μmol·L-1)仙客来皂苷;胆固醇干预组为不同浓度仙客来皂苷另加20.0 mg·L-1胆固醇;每组设5个复孔。将96孔板置于培养箱内培养24 h。采用MTT法测定各组细胞存活率,于酶标仪492nm处记录吸光度(A)值,计算细胞存活率;使用GraphPad Prism软件计算半数抑制浓度(IC50)。细胞存活率=实验组A值/对照组A值×100%。取各组细胞培养上清液按照LDH释放检测试剂盒说明书操作,采用酶标仪检测492nm处A值,以A值表示LDH释放水平[12]。
1.4 胆固醇水平检测HepG2和HL-7702细胞分别以2%多聚甲醛固定30 min后PBS洗涤2次,加入1.5 g·L-1甘氨酸处理10 min,再加入Filipin Ⅲ(50 mg·L-1)避光室温放置2 h,用PBS洗涤细胞后荧光显微镜下观察并照相,图像转换成灰度格式后,随机选取5个含有8~15个细胞的区域,使用Quantity One图像处理软件(Bio-Rad Laboratories)计算每平方毫米荧光平均灰度值,以荧光平均灰度值表示胆固醇水平。
1.5 流式细胞术检测细胞凋亡率肝癌HepG2细胞按照对照组(0.5% DMSO)、仙客来皂苷组(5.0 μmol·L-1仙客来皂苷)和胆固醇干预组(5.0 μmol·L-1仙客来皂苷+20.0 mg·L-1胆固醇)分为3组,分别处理24 h后,每组收集1×106个细胞,按照细胞凋亡检测试剂盒说明书操作,采用流式细胞仪检测细胞凋亡率。
1.6 Western blotting法检测Fas、FADD和caspase-8蛋白表达水平细胞处理及分组同1.3部分。仙客来皂苷组和胆固醇干预组细胞常规消化,并收集细胞提取蛋白,BCA蛋白浓度测定试剂盒检测蛋白表达水平,SDS-PAGE凝胶电泳分离总蛋白,将蛋白通过电转移印迹转至PVDF膜上,TBST洗涤后脱脂牛奶室温封闭1 h,一抗4℃过夜,TBST洗涤3次,每次10 min,辣根过氧化物酶标记的二抗室温孵育2 h,TBST洗涤3次,每次10 min。加入ECL试剂发光。采用Quantity One软件进行灰度值分析。蛋白表达水平=每个样本条带灰度值/β-actin灰度值。
1.7 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组细胞存活率、Filipin标记荧光强度、LDH释放水平、细胞凋亡率以及Fas、FADD和caspase-8蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
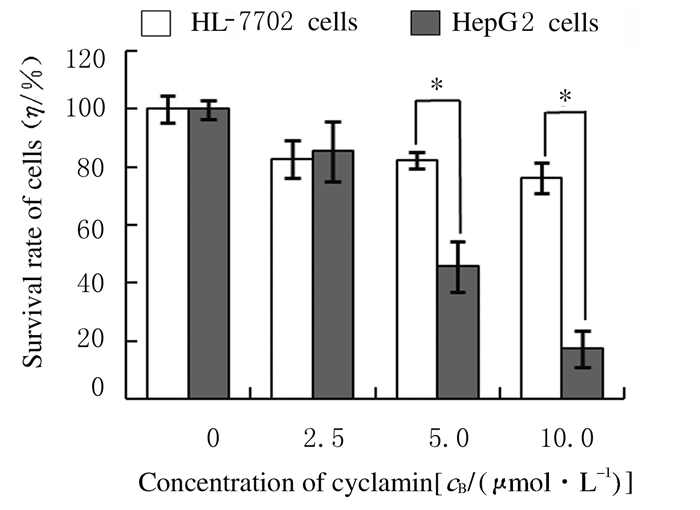
2 结果 2.1 仙客来皂苷处理后HepG2和HL7702细胞存活率不同浓度仙客来皂苷对人肝癌HepG2细胞有剂量依赖性增殖抑制作用,而对人肝细胞HL7702的增殖抑制作用不明显。当仙客来皂苷浓度大于5.0 μmol·L-1时,HepG2细胞存活率明显低于HL7702细胞(P < 0.05)。仙客来皂苷作用于HepG2细胞24 h时IC50值为4.88 mol·L-1,而作用于HL7702细胞的IC50值则大于100.0 μmol·L-1,提示仙客来皂苷对肝癌细胞有选择性增殖抑制作用。见图 1。
|
| *P < 0.05 compared with HL-7702 cells. 图 1 仙客来皂苷处理24 h后HepG2和HL-7702细胞存活率 Fig. 1 Survival rates of HepG2 and HL-7702 cells after treated with cyclamin for 24 h |
|
|
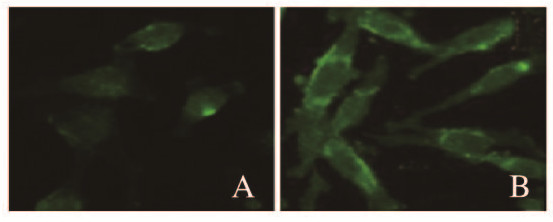
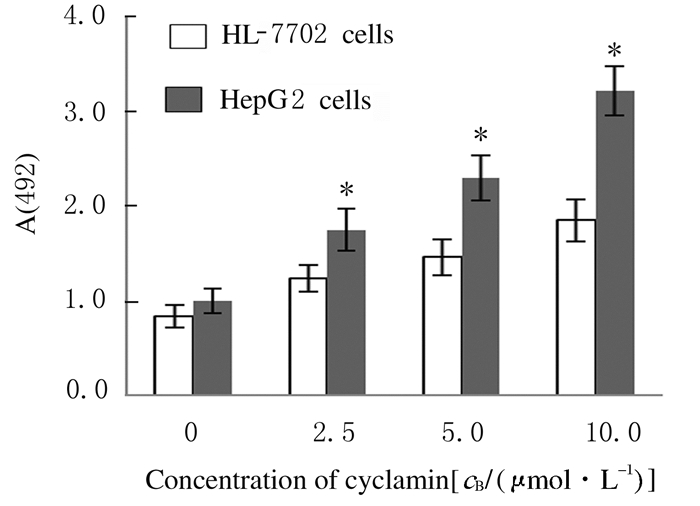
胆固醇特异性荧光标记物Filipin染色结果显示:肝癌HepG2细胞膜中胆固醇水平(485.5±89.3)明显高于人正常HL-7702肝细胞(117.9±28.2)(P < 0.05) (图 2,见插页四)。LDH释放实验检测结果显示:不同浓度仙客来皂苷处理后肝癌细胞HepG2细胞LDH释放水平均明显高于HL-7702细胞(P < 0.05),且该作用呈剂量依赖性。见图 3。
|
| 图 2 Filipin染色后HL-7702(A)和HepG2 (B)细胞荧光强度(×400) Fig. 2 Fluorescence intensities of HL-7702(A) and HepG2 (B) cells after Filipin staining(×400) |
|
|
|
| *P < 0.05 compared with HL-7702 cells. 图 3 仙客来皂苷处理24 h后HL-7702和HepG2细胞LDH释放水平 Fig. 3 LDH release levels of HL-7702 and HepG2 cells after treated with cyclamin for 24 h |
|
|
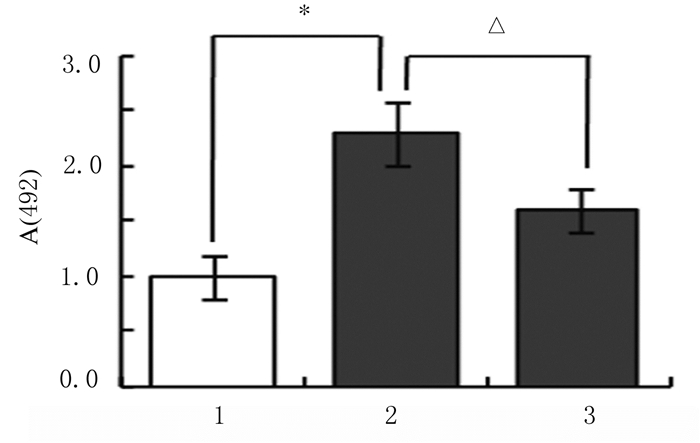
LDH释放实验结果显示:与对照组比较,5.0 μmol·L-1仙客来皂苷组HepG2细胞LDH释放水平明显升高(P < 0.05)。与5.0μmol·L-1仙客来皂苷组比较,胆固醇干预组HepG2细胞LDH释放水平明显降低(P < 0.05)。见图 4。
|
| 1:Control group; 2:5.0 μmol·L-1 cyclamin group; 3:Cholesterol intervention group.* P < 0.05 compared with control group; △ P < 0.05 compared with 5.0 μmol·L-1 cyclamin group. 图 4 胆固醇干预后各组HepG2细胞LDH释放水平 Fig. 4 LDH release levels in HepG2 cells in various groups after interfered with cholesterol |
|
|
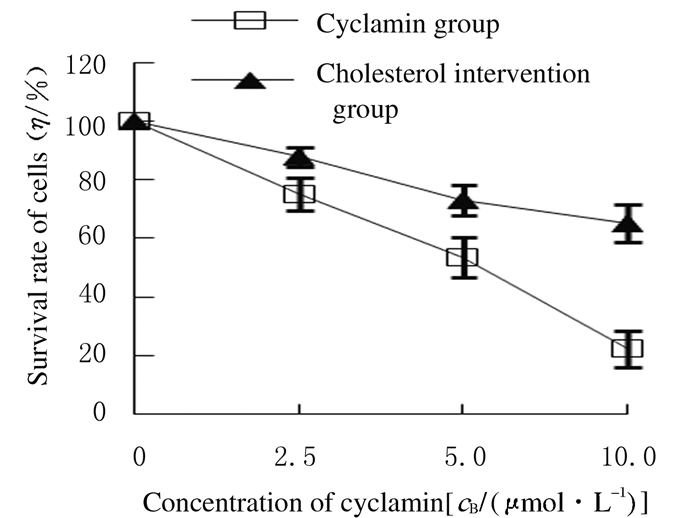
MTT实验检测结果显示:与仙客来皂苷组比较,胆固醇干预组中HepG2细胞存活率均明显升高(P < 0.05)。见图 5。
|
| *P < 0.05 compared with cyclamin group. 图 5 胆固醇干预后各组HepG2细胞存活率 Fig. 5 Survival rates of HepG2 cells in various groups after interfered with cholesteol |
|
|
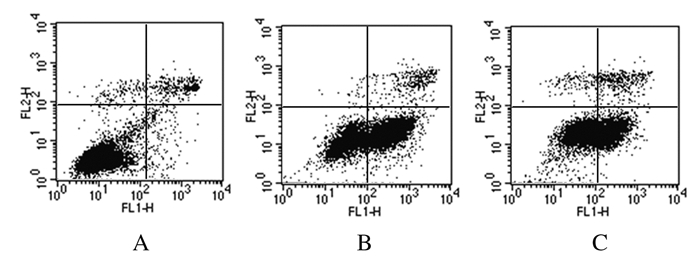
流式细胞术检测结果显示:与对照组(8.3%± 1.5%)比较,5.0μmol·L-1仙客来皂苷组HepG2细胞凋亡率(42.7%±3.3%)明显升高(P < 0.05)。与5.0μmol·L-1仙客来皂苷组比较,胆固醇干预组细胞凋亡率(30.5%±2.6%)明显降低(P < 0.05)。见图 6。
|
| A:Control group; B: 5.0μmol·L-1 cyclamin group; C:Cholesterol intervention group. 图 6 胆固醇干预后各组HepG2细胞凋亡率 Fig. 6 Apoptotic rates of cyclamin HepG2 cells in various groups after interfered with cholesterol |
|
|
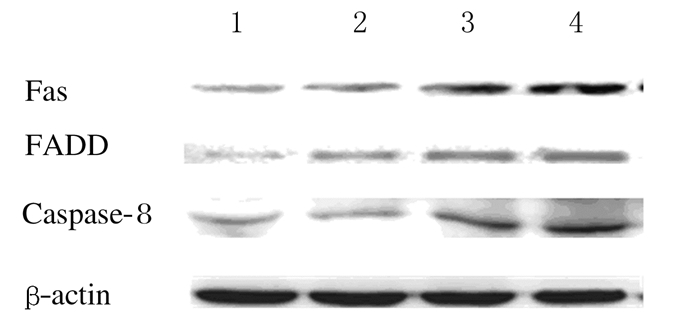
与对照组比较,不同浓度仙客来皂苷组HepG2细胞中Fas和FADD蛋白表达水平均明显升高(P < 0.05),且caspase-8蛋白表达水平也明显升高(P < 0.05),并呈剂量效应关系。见图 7和表 1。
|
| Lane 1: Control group; Lane 2-4: 2.5, 5.0, and 10.0 μmol·L-1 cyclamin groups. 图 7 各组HepG2细胞中Fas、FADD和caspase-8蛋白表达电泳图 Fig. 7 Electrophoregram of expressions of Fas, FADD and caspase-8 proteins in HepG2 cells in various groups |
|
|
| (n=3, x±s) | |||
| Group | Fas | FADD | caspase-8 |
| Control Cyclamin(μmol·L-1) | 0.33±0.02 | 0.22±0.01 | 0.42±0.01 |
| 2.5 | 0.41±0.03* | 0.31±0.02* | 0.44±0.02 |
| 5.0 | 0.54±0.02* | 0.43±0.02* | 0.52±0.02* |
| 10.0 | 0.59±0.01* | 0.45±0.03* | 0.64±0.03* |
| *P < 0.05 compared with control group. | |||
与对照组比较,5.0μmol·L-1仙客来皂苷组HepG2细胞中Fas、FADD和caspase-8蛋白表达水平明显升高(P < 0.05);与5.0μmol·L-1仙客来皂苷组比较,胆固醇干预组HepG2细胞中Fas、FADD和caspase-8蛋白表达水平均明显降低(P < 0.05)。见图 8和表 2。

|
| Lane 1: Control group; Lane 2:5.0 μmol·L-1 cyclamin group; Lane 3: Cholesterol intervention group. 图 8 各组HepG2细胞中Fas、FADD和caspase-8蛋白表达电泳图 Fig. 8 Electrophoregram of expressions of Fas, FADD and caspase-8 proteins in HepG2 cells in various groups |
|
|
| (n=3, x±s) | |||
| Group | Fas | FADD | caspase-8 |
| Control | 0.30±0.02 | 0.24±0.01 | 0.32±0.02 |
| Cyclamin (5.0 μmol·L-1) | 0.57±0.03* | 0.59±0.05* | 0.77±0.03* |
| Cholesterol intervention | 0.44±0.03△ | 0.50±0.02△ | 0.54±0.04△ |
| *P < 0.05 compared with control group; △ P < 0.05 compared with 5.0 μmol·L-1 cyclamin group. | |||
胆固醇是多种生物活性分子的前体,而且也是组成细胞膜结构的重要组成成分。高胆固醇能够强化细胞膜脂筏结构,增强肿瘤细胞增殖侵袭相关信号通路的活性[13]。临床与分子水平研究[14-18]证实:包括乳腺癌、肺癌、肠癌和前列腺癌在内的多种肿瘤均伴随肿瘤细胞或组织中胆固醇水平增高或者胆固醇代谢异常等现象,降胆固醇活性分子能够有效缓解肿瘤的恶性发展,抑制肿瘤细胞增殖,提示胆固醇异常与肿瘤发生发展有关联。目前关于以肿瘤细胞与正常细胞中胆固醇水平的差异为靶点的新型抗肿瘤药物研发及机制研究较少,本研究探讨仙客来皂苷选择性抗肝癌活性作用机制,分析细胞中胆固醇成分在该选择性细胞毒作用中发挥的作用。
体内外研究[19-20]显示:在胰腺癌和乳腺癌细胞中胆固醇水平较正常组织细胞升高,甲基环糊精(methyl-β cyclodextrin,MβCD)以及辛伐他汀等作用于胆固醇的药物具有上述细胞的选择性细胞增殖抑制活性。本研究结果显示:肝癌HepG2细胞与人正常HL-7702肝细胞膜上胆固醇水平存在明显差异;LDH释放实验结果显示:仙客来皂苷对HepG2细胞膜通透性的影响明显高于HL-7702细胞,提示选择性细胞毒作用可能与2种细胞中细胞膜胆固醇水平的差异有关联。而胆固醇干预能够有效降低仙客来皂苷对肝癌细胞膜通透性的影响和细胞增殖抑制活性,抑制仙客来皂苷诱导的HepG2细胞凋亡率,进一步证实了仙客来皂苷的作用靶点是细胞膜上胆固醇。
本研究进一步分析了仙客来皂苷通过作用于细胞膜胆固醇进而对脂筏结构相关Fas/FADD凋亡信号通路的影响。本研究结果显示:仙客来皂苷处理后的肝癌细胞中死亡受体信号通路关键蛋白Fas及其胞内衔接子蛋白FADD的表达水平明显增加,进而激活下游caspase-8导致细胞凋亡。哺乳动物细胞死亡受体蛋白Fas的激活有配体依赖型及非依赖型2种方式,配体依赖型激活中,Fas与其配体FasL结合,启动包括死亡受体分子活化、死亡诱导信号复合物的形成以及caspase家族活化在内的一系列凋亡信号的跨膜传递,最终完成凋亡过程[21],研究[22]显示:三萜皂苷类化合物可以通过该模式诱导肿瘤细胞凋亡;而在配体非依赖型激活中,Fas的活化与细胞膜的通透性和流动性变化有关联,当细胞在降胆固醇药物或分子如MβCD、FilipinⅢ以及他汀类药物作用下,细胞膜通透性及流动性增加所造成的膜表面机械牵张力以及分子扩散速率增加能够激发细胞膜非脂筏结构上Fas蛋白的自发集簇化,进而形成Fas-FADD-caspase-8复合物,导致凋亡[23]。本研究结果显示:仙客来皂苷作用于细胞膜胆固醇成分并激活Fas-FADD-caspase-8信号通路,胆固醇干预能够竞争性地降低仙客来皂苷对细胞膜的作用, 有效降低仙客来皂苷引起的Fas-FADD及caspase-8的活化。这一结果与以往研究[24]报道的人参皂苷类化合物RH2作用类似。
综上所述,肝癌细胞与正常肝细胞中胆固醇成分差异是仙客来皂苷选择性作用于肝癌细胞可能的分子基础,通过作用于细胞膜胆固醇进而以配体非依赖方式激活Fas-FADD-caspase凋亡信号通路,可能是仙客来皂苷选择性细胞毒作用的分子机制。
| [1] | FOSTER L J, DeHOOG C L, MANN M. Unbiased quantitative proteomics of lipid rafts reveals high specificity for signaling factors[J]. Proc Natl Acad Sci USA, 2003, 100(10): 5813–5818. DOI:10.1073/pnas.0631608100 |
| [2] | LI Y C, PARK M J, YE S K, et al. Elevated levels of cholesterol-rich lipid rafts in cancer cells are correlated with apoptosis sensitivity induced by cholesterol-depleting agents[J]. Am J Pathol, 2006, 168(4): 1107–1118. DOI:10.2353/ajpath.2006.050959 |
| [3] | GAJATE C, MOLLINEDO F. Lipid rafts, endoplasmic reticulum and mitochondria in the antitumor action of the alkylphospholipid analog edelfosine[J]. Anticancer Agents Med Chem, 2014, 14(4): 509–527. DOI:10.2174/1871520614666140309222259 |
| [4] | GONYEAU M J, YUEN D W. A clinical review of statins and cancer:helpful or harmful?[J]. Pharmacotherapy, 2010, 30(2): 177–194. DOI:10.1592/phco.30.2.177 |
| [5] | PIRRO M, RICCIUTI B, RADER D J, et al. High density lipoprotein cholesterol andcancer:Marker or causative[J]. Prog Lipid Res, 2018, 71: 54–69. DOI:10.1016/j.plipres.2018.06.001 |
| [6] | LOREN J, Le DUFF C S, QUETIN-LECLERCQ J, et al. Induction of highly curved structures in relation to membrane permeabilization and budding by the triterpenoid saponins, α-and δ-hederin[J]. J Biol Chem, 2013, 288(20): 14000–14017. DOI:10.1074/jbc.M112.407635 |
| [7] | THAKUR M, MELZIG M F, FUCHS H, et al. Chemistry and pharmacology of saponins:special focus on cytotoxic properties[J]. BTAT, 2011: 19. DOI:10.2147/BTAT |
| [8] | LIMTRAKUL P, PITCHAKAN P, SUZUKI S. A triterpenoid from momordica charantia linn:A comprehensive review of anticarcinogenic properties[J]. Carcinogenesis, 2013, 13: 275–296. |
| [9] | LI Q, LI W, HUI L P, et al. 13, 28-Epoxy triterpenoid saponins from Ardisia japonica selectively inhibit proliferation of liver cancer cells without affecting normal liver cells[J]. Bioorg Med Chem Lett, 2012, 22(19): 6120–6125. DOI:10.1016/j.bmcl.2012.08.027 |
| [10] | LI Q, DENG L, LI W, et al. Cyclamin, a natural 13, 28-epoxy triterpenoid saponin, synergistically enhances the cytotoxicity of chemotherapeutic drugs in human liver cancer cells but not non-neoplastic liver cells[J]. Planta Med, 2014, 80(5): 409–414. DOI:10.1055/s-00000058 |
| [11] | CHANG X L, LI W, JIA Z H, et al. Biologically active triterpenoid saponins from Ardisia japonica[J]. J Nat Prod, 2007, 70(2): 179–187. DOI:10.1021/np0604681 |
| [12] | WANG S, WANG Y, LIU J, et al. Silencing B7-H1 enhances the anti-tumor effect of bladder cancer antigen-loaded dendritic cell vaccine in vitro[J]. Onco Targets Ther, 2014, 7: 1389–1396. |
| [13] | RUIZ I ALTABA A, SÁNCHEZ P, DAHMANE N. Gli and hedgehog in cancer:tumours, embryos and stem cells[J]. Nat Rev Cancer, 2002, 2(5): 361–372. DOI:10.1038/nrc796 |
| [14] | BONOVAS S, FILIOUSSI K, TSAVARIS N, et al. Use of statins and breast cancer:A meta-analysis of seven randomized clinical trials and nine observational studies[J]. J Clin Oncol, 2005, 23(34): 8606–8612. DOI:10.1200/JCO.2005.02.7045 |
| [15] | POYNTER J N, GRUBER S B, HIGGINS P D, et al. Statins and the risk of colorectal cancer[J]. N Engl J Med, 2005, 352(21): 2184–2192. DOI:10.1056/NEJMoa043792 |
| [16] | HUANG B Z, CHANG J I, LI E, et al. Influence of statins and cholesterol on mortality among patients with pancreatic cancer[J]. J Natl Cancer Inst, 2017, 109(5). DOI:10.1093/jnci/djw275 |
| [17] | TOSI M R, BOTTURA G, LUCCHI P, et al. Cholesteryl esters in human malignant neoplasms[J]. Int J Mol Med, 2003, 11(1): 95–98. |
| [18] | MURTOLA T J, KASURINEN T V J, TALALA K, et al. Serum cholesterol and prostate cancer risk in the Finnish randomized study of screening for prostate cancer[J]. Prostate Cancer Prostatic Dis, 2019, 22(1): 66–76. DOI:10.1038/s41391-018-0087-0 |
| [19] | ZHUANG L, KIM J, ADAM R M, et al. Cholesterol targeting alters lipid raft composition and cell survival in prostate cancer cells and xenografts[J]. J Clin Invest, 2005, 115(4): 959–968. DOI:10.1172/JCI200519935 |
| [20] | YIN Y F, LIU L, ZHAO Z F, et al. Simvastatin inhibits sonic hedgehog signaling and stemness features of pancreatic cancer[J]. Cancer Lett, 2018, 426: 14–24. DOI:10.1016/j.canlet.2018.04.001 |
| [21] | KRAMMER P H. CD95's deadly mission in the immune system[J]. Nature, 2000, 407(6805): 789–795. DOI:10.1038/35037728 |
| [22] | MU L H, WANG Y N, WANG D X, et al. AG36 inhibits human breast cancer cells proliferation by promotion of apoptosis in vitro and in vivo[J]. Front Pharmacol, 2017, 8: 15. |
| [23] | GNIADECKI R. Depletion of membrane cholesterol causes ligand-independent activation of Fas and apoptosis[J]. Biochem Biophys Res Commun, 2004, 320(1): 165–169. DOI:10.1016/j.bbrc.2004.05.145 |
| [24] | YI J S, CHOO H J, CHO B R, et al. Ginsenoside Rh2 induces ligand-independent Fas activation via lipid raft disruption[J]. Biochem Biophys Res Commun, 2009, 385(2): 154–159. DOI:10.1016/j.bbrc.2009.05.028 |
 2019, Vol. 45
2019, Vol. 45


