扩展功能
文章信息
- 王琦, 都帅, 赵全民, 李庆杰
- WANG Qi, DU Shuai, ZHAO Quanmin, LI Qingjie
- 鹿茸多肽对小鼠胚胎成纤维细胞NIH/3T3增殖和胶原蛋白分泌能力的影响及其机制
- Effects of pilose antler polypeptide on abilities of proliferation and collagen secretion of mouse embryonic fibroblasts NIH/3T3 and their mechanisms
- 吉林大学学报(医学版), 2019, 45(02): 307-312
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 307-312
- 10.13481/j.1671-587x.20190216
-
文章历史
- 收稿日期: 2018-09-26
2. 长春中医药大学附属医院实验研究中心, 吉林 长春 130021
2. Research Center of Traditional Chinese Medicine, Affiliated Hospital, Changchun University of Chinese Medicine, Changchun 130021, China
皮肤主要由于蛋白结构和组成发生变化而导致皮肤损伤进而产生皱纹[1],其修复的生物机制非常复杂[2]。成纤维细胞能够诱导胶原蛋白和细胞因子的分泌[3-4],增强皮肤弹性[5]。胶原蛋白作为皮肤的主要构成部分,具有促进皮肤的弹性、收缩和细胞完整性等功能[6]。转化生长因子β1(transforming growth factor-β1, TGF-β1)则通过聚集成纤维细胞,刺激胶原蛋白的合成来促进纤维化过程。TGF-β1作为细胞增殖和分化等功能的调控因子[7],其表达上调,能增强细胞的灵活性[8],此外,细胞外调节蛋白激酶1/2(extracellular signal-regulated kinase 1/2, ERK 1/2)信号也可以调节胶原生物合成[9]。研究[10-12]显示:丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)/ERK(MAPK/ERK)途径在细胞增殖和胶原蛋白生物合成中起重要作用。鹿茸作为常用的滋补保健类中药,在东亚地区被广泛使用已经超过2 000多年[13],其具有蛋白质、多肽和多胺类等多种活性成分。鹿茸多肽作为一种小分子、活性强的蛋白,抗皱美肤功效显著,在人类皮肤皱纹改善和组织伤口愈合等方面也具有积极的作用[14],胡太超等[15]发现鹿茸多肽对于组织伤口愈合和抗衰老有促进作用。目前对鹿茸多肽抗皱功效机制的研究少见报道。本研究观察鹿茸多肽对成纤维细胞增殖能力和分泌胶原蛋白能力的影响,探讨其抗皱作用的可能机制。
1 材料与方法 1.1 细胞、药品、主要试剂和仪器小鼠胚胎成纤维细胞NIH/3T3购于美国ATCC细胞库。鹿茸由吉林省长春市双阳区长春世鹿鹿业集团有限公司提供,经吉林农业大学赵全民副教授鉴定为鹿科动物马鹿Cervuselaphus Linnaeus的雄鹿未骨化密生茸毛的幼角,经提取纯化,取截留相对分子质量为1~10000的肽段作为本实验鹿茸多肽。二甲基亚砜(DMSO)、MTT、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、青霉素、链霉素、DMEM和新生牛血清(美国Sigma公司),小鼠Ⅰ型胶原蛋白和Ⅲ型胶原蛋白ELISA试剂盒(德国IBL公司),ERK 1/2、ERK1/2的磷酸化蛋白(p-ERK 1/2)和TGFβ1抗体(美国Santa公司),其他试剂均为常规试剂。CO2培养箱(美国Thermo公司),荧光倒置显微镜(日本Olympus公司),酶标仪(日本Sunrise公司),细胞成像的多功能测试系统Cytation 3(美国伯腾公司)。
1.2 细胞分组和给药将NIH/3T3细胞采用含有10%新生牛血清的高糖DMEM培养液、于CO2培养箱(37℃、5% CO2)中培养,隔2~3d传代1次,当细胞融合达60%时更换培养基为含0.4%新生牛血清的完全培养基,同步24h后分10组(0 mg·L-1鹿茸多肽的空白对照组,50.00 μg·L-1阳性对照组,1.56、3.13、6.25、12.50、25.00、50.00、100.00和200.00 mg·L-1鹿茸多肽组),给予刺激后继续培养24h后终止,收集细胞进行检测。
1.3 MTT法测定NIH/3T3细胞存活率将NIH/3T3细胞接种于96孔培养板,每组细胞3个复孔,于培养结束前4 h加入10μL MTT,培养结束后吸去培养基,每孔加入150μL DMSO,震荡混匀15 min,使结晶完全溶解,采用酶联免疫检测仪于490 nm波长处测定其吸光度(A)值[10]。对照组细胞存活率设为100%,计算其余各组细胞存活率。细胞存活率=(实验组平均A值/对照组平均A值)×100%。
1.4 ELISA法测定NIH/3T3细胞胶原蛋白分泌水平将NIH/3T3细胞接种到24孔板中,培养24 h, 更换培养基为含0.4%新生牛血清的完全培养基。分别加入不同剂量(0、1.56、3.13、6.25、12.50、25.00、50.00、100.00和200.00 mg·L-1)鹿茸多肽和50.00 μg·L-1 bFGF于细胞培养基,培养24h后收集培养液,利用ELISA法分别检测培养液中Ⅰ和Ⅲ型胶原蛋白水平。具体方法参考ELISA试剂盒说明书。
1.5 划痕愈合实验测定NIH/3T3细胞迁移能力将NIH/3T3细胞接种于12孔板24 h后,利用200 μL移液器枪头在每孔板中间划痕,随后更换培养基为含0.4%新生牛血清的完全培养基,鹿茸多肽组给予12.50 mg·L-1鹿茸多肽,阳性对照组给予50.00 μg·L-1bFGF,空白对照组给予一定量的PBS,于培养12和24 h后利用细胞成像的多功能测试系统Cytation 3采集空白对照组、阳性对照组和鹿茸多肽组图像,比较划痕的愈合情况,计算划痕愈合率。划痕愈合率=(0 h划痕宽度-12或24 h划痕宽度)/0 h划痕宽度×100%。
1.6 Western blotting法测定NIH/3T3细胞中p-ERK 1/2表达水平收集胰酶消化后的1.5项下细胞,在Triton X-100的裂解缓冲液中溶解30 min,然后以4℃、10000 r·min-1离心10 min,通过Bradford法来测定蛋白质水平。等量蛋白通过12%的SDS-PAGE分离并转移到PVDF膜上,采用5%的脱脂牛奶阻断1 h后,加入合适浓度的一抗4℃过夜,一抗分别为内参Cyclin A、p-ERK 1/2、ERK 1/2和β-actin,然后再与标记有辣根过氧化物酶的二抗室温孵育1h,其过氧化物酶活性采用增强型化学发光检测系统检测。采用凝胶成像系统拍照,计算机扫描并分析处理结果。利用化学发光系统(FluorChem, ProteinSimple, San Jose, 美国)采集空白对照组、阳性对照组和鹿茸多肽组图像及蛋白灰度定量,计算蛋白表达水平。蛋白表达水平=每个样本条带灰度值/β-actin条带灰度值。
1.7 免疫荧光法测定NIH/3T3细胞中TGF-β1表达水平12.50 mg·L-1鹿茸多肽组细胞采用3%甲醛固定,70%乙醇通透后,加入一抗TGF-β1、VEGF和p-ERK 1/2抗体,30min后加入荧光二抗荧光素异硫辛酯,并在显微镜下观察空白对照组、阳性对照组和鹿茸多肽组细胞核被DAPI染色的情况。采用细胞成像的多功能测试系统Cytation 3进行图像的采集和后处理,计算平均荧光强度。平均荧光强度=总荧光强度/像素点数。
1.8 统计学分析采用Graphpad Prism 5.0统计软件进行统计学分析。各组NIH/3T3细胞存活率、细胞中胶原蛋白水平、NIH/3T3细胞划痕愈合率和NIH/3T3细胞中TGF-β1蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组NIH/3T3细胞存活率与空白对照组比较,不同剂量鹿茸多肽作用48 h后,1.56和3.13 mg·L-1鹿茸多肽组细胞成活率虽有上升趋势,但差异无统计学意义(P>0.05);6.25和200.00 mg·L-1鹿茸多肽组细胞存活率升高(P < 0.05),与阳性对照组相近;12.50~100.00 mg·L-1鹿茸多肽组细胞存活率明显升高(P < 0.01)。见图 1。
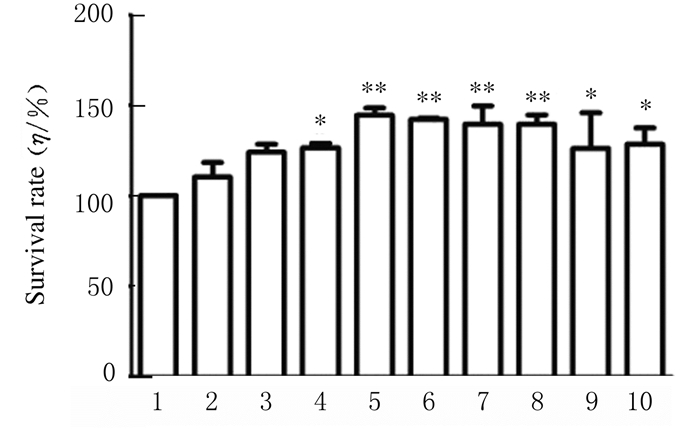
|
| 1:Blank control group; 2-9:1.56, 3.13, 6.25, 12.50, 25.00, 100.00, and 200.00 mg·L-1 pliose antler polypeptide groups; 10:Positive control group.*P < 0.05, * *P < 0.01 vs blank control group. 图 1 各组NIH/3T3细胞存活率 Fig. 1 Survival rates of NIH/3T3 cells in various groups |
|
|
与空白对照组比较,不同剂量鹿茸多肽作用48 h后,12.50 mg·L-1鹿茸多肽组NIH/3T3细胞培养液中Ⅰ型胶原蛋白水平最高(P < 0.01),25.00 mg·L-1鹿茸多肽组NIH/3T3细胞培养液中Ⅲ型胶原蛋白水平最高(P < 0.05)。见表 1。
| (n=3, x±s) | ||
| Group | Type Ⅰ collagen protein | Type Ⅲ collagen protein |
| Blank control | 4.41±1.00 | 7.87±0.80 |
| Positive control | 26.47±6.60** | 17.58±3.00* |
| Pilose antler polypeptide (mg·L-1) |
||
| 1.56 | 6.95±2.20 | 12.00±1.10 |
| 3.13 | 18.96±2.00 | 14.84±2.40 |
| 6.25 | 22.66±2.30* | 16.57±0.90 |
| 12.50 | 25.83±2.70** | 18.47±5.70* |
| 25.00 | 24.70±6.70* | 18.53±4.40* |
| 50.00 | 23.02±9.40* | 18.05±4.00 |
| 100.00 | 21.23±8.00 | 14.38±2.20 |
| 200.00 | 21.47±10.10 | 11.07±3.10 |
| *P < 0.05, **P < 0.01 vs blank control group. | ||
与空白对照组比较,鹿茸多肽作用12 h后鹿茸多肽组NIH/3T3细胞划痕愈合率升高(P < 0.05),24 h后划痕愈合率明显升高(P < 0.01)。见图 2和表 2。

|
| A-C:Blank control group(0, 12, and 24 h); D-F:12.50 mg·L-1 polise antler polypeptide group(0, 12, and 24 h); G-I:Positive control group(0, 12, and 24 h). 图 2 各组NIH/3T3细胞划痕愈合实验结果 Fig. 2 Results of wound healing assay of NIH/3T3 cells in various groups |
|
|
| (n=3, x±s, η/%) | ||||
| Group | Wound healing rate | |||
| (t/h) | 0 | 12 | 24 | |
| Blank control | 0.67±2.08 | 65.00±2.65 | 66.67±2.52 | |
| Positive control | 50.67±2.31 | 75.33±3.51 | 78.00±4.58 | |
| 12.50 mg·L-1pilose antler polypeptide | 51.67±4.16 | 74.33±2.08* | 79.67±3.06** | |
| *P < 0.05, **P < 0.01 vs blank control group. | ||||
与空白对照组(1.00±0.00)比较,12.50 mg·L-1鹿茸多肽组NIH/3T3细胞中p-ERK 1/2蛋白表达水平(5.47±1.50)明显升高(P < 0.01);与空白对照组比较,阳性对照组NIH/3T3细胞中p-ERK 1/2蛋白表达水平(5.40±1.25)明显升高(P < 0.01)。见图 3。

|
| Lane 1:Blank control group; Lane 2:12.50 mg·L-1 polise antler polypeptide group; Lane 3:Positive control group. 图 3 各组NIH/3T3细胞中p-ERK 1/2蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of p-ERK 1/2 in NIH/3T3 cells in various groups |
|
|
与空白对照组(4044.67±661.91)比较,阳性对照组(5332.33±125.24)和12.50 mg·L-1鹿茸多肽组(5951.33±395.71)NIH/3T3细胞中TGF-β1表达水平明显升高(P < 0.05或P < 0.01)。见图 4(插页四)。

|
| A-C: Blank control group; D-F: 12.50 mg·L-1 polise antler polypeptide group; G-I: Positive control group; A, D, G: TGF-β1; B, E, H: DAPI; C, F, I: Merge. 图 4 各组NIH/3T3细胞中TGF-pl蛋白表达(免疫荧光,×20) Fig. 4 Expressions of TGF-pl protein in NIH/3T3 cells in various groups(Immunofluorescene, ×20) |
|
|
NIH/3T3细胞作为构成皮肤真皮的主要细胞,与皮肤皱纹生成与否有密切关系,其增殖能力下降,导致细胞外基质蛋白的胶原蛋白水平降低,合成Ⅰ和Ⅲ型胶原的比例变小,皮肤出现皱纹。本研究旨在验证鹿茸多肽可以促进NIH/3T3细胞增殖及胶原蛋白分泌的假设。本研究结果表明:NIH/3T3细胞在鹿茸多肽的作用下能够进行增殖,且胶原蛋白水平明显升高。据文献[16]报道:TGF-β1在皮肤表皮层、真皮层以及毛囊和汗腺细胞内均有表达,通过增加基质蛋白的合成,如胶原蛋白、糖蛋白的表达和分泌,加强细胞黏附蛋白受体的转录、翻译和处理过程,而TGF-β1作为成纤维细胞的主要趋化因子,与创伤修复和皮肤老化的关系尤为密切,参与介导信号通路。作为皮肤修复与再生的重要内源性调控因子[17],ERK1/2的磷酸化水平和TGF-β1表达进一步证明其机制可能是通过激活细胞外相关激酶信号通路来实现的[18]。本研究结果显示:鹿茸多肽能够显著提高p-ERK1/2化蛋白水平和TGF-β1蛋白的表达,表明鹿茸多肽是通过增加p-ERK1/2蛋白水平及TGF-β1蛋白的表达而在皮肤抗皱过程中发挥作用。
综上所述,随着生命科学的发展,人们对细胞皱缩的相关机制有了更全面深入的认识和了解。本研究探讨了细胞收缩机制,可以为支持具有延缓皮肤皱纹产生的鹿茸多肽产品的开发提供理论依据,并为其他类皮肤抗皱活性组分的筛选提供方法学参考和思路。分析导致皱纹产生的相关机制,以阐明相关的病理生理学过程,可为皮肤皱纹的预防提供重要依据[19-20]。但本研究也存在一定的局限性,关于皮肤皱纹生成、皮肤衰老的机制有很多种学说, 包括抗氧化酶活性和与皮肤衰老相关基因[21]等多方面, 因此需要进一步完善对皮肤皱纹产生相关机制的研究。
| [1] | 陶荣珊, 胡太超, 李金伟, 等. 鹿茸多肽提取分离纯化及药理作用研究进展[J]. 经济动物学报, 2014, 18(4): 238–242. |
| [2] | WERNER S, GROSE R. Regulation of wound healing by growth factors and cytokines[J]. Physiol Rev, 2003, 83(3): 835–870. DOI:10.1152/physrev.2003.83.3.835 |
| [3] | SPIEKSTRA S W, BREETVELD M, RUSTEMEYER T, et al. Wound-healing factors secreted by epidermal keratinocytes and dermal fibroblasts in skin substitutes[J]. Wound Repair Regen, 2007, 15(5): 708–717. DOI:10.1111/wrr.2007.15.issue-5 |
| [4] | HUNT T K, BURKE J, BARBUL A, et al. Wound healing[J]. Science, 1999, 284(5421): 1775–1775. |
| [5] | WITTE M B, BARBUL A. General principles of wound healing[J]. Surg Clin N Am, 1997, 77(3): 509–528. DOI:10.1016/S0039-6109(05)70566-1 |
| [6] | GORDON M K, HAHN R A. Collagens[J]. Cell Tissue Res, 2010, 339(1): 247–257. DOI:10.1007/s00441-009-0844-4 |
| [7] | KANE C J, HEBDA P A, MANSBRIDGE J N, et al. Direct evidence for spatial and temporal regulation of transforming growth factor beta 1 expression during cutaneous wound healing[J]. J Cell Physiol, 1991, 148(1): 157–173. DOI:10.1002/(ISSN)1097-4652 |
| [8] | OLIVER N, STERNLICHT M, GERRITSEN K, et al. Could aging human skin use a connective tissue growth factor boost to increase collagen content?[J]. J Invest Dermatol, 2010, 130(2): 338–341. DOI:10.1038/jid.2009.331 |
| [9] | RAIS B, COMIN B J, PUIGJANER J, et al. Oxythiamine and dehydroepiandrosterone induce a G1 phase cycle arrest in Ehrlich's tumor cells through inhibition of the pentose cycle[J]. FEBS Lett, 1999, 456(1): 113–118. DOI:10.1016/S0014-5793(99)00924-2 |
| [10] | LAI C F, CHAUDHARY L, FAUSTO A, et al. Erk is essential for growth, differentiation, in tegrin expression, and cell function in human osteoblastic cells[J]. J Biol Chem, 2001, 276(17): 14443. DOI:10.1074/jbc.M010021200 |
| [11] | JURETIC N, SANTIBANEZ J F, HURTADO C, et al. ERK1, 2 and p38 pathways are in volved in the proliferation stimuli mediated by urokinase in osteoblastic SaOs-2 cells line[J]. J Cell Biochem, 2001, 83(1): 92. DOI:10.1002/jcb.v83:1 |
| [12] | CRAXTON A, SHU G, GRAVES J D, et al. p38 MAPK is reguired for CD40-induced gene expression and proliferation in B lympho cytes[J]. J Immounol, 1998, 161(7): 3225–3236. |
| [13] | 刘佳, 赵海平, 李春义. 鹿茸成分研究进展[J]. 特产研究, 2016, 38(4): 50–54. |
| [14] | 宣敏, 程飚. 皮肤衰老的分子机制[J]. 中国老年学杂志, 2015, 35(15): 4375–4380. DOI:10.3969/j.issn.1005-9202.2015.15.128 |
| [15] | 胡太超, 刘玉敏, 陶荣珊, 等. 鹿茸的化学成分及药理作用研究概述[J]. 经济动物学报, 2015, 19(3): 156–162. |
| [16] | HONG N Y, CUI Z G, KANG H K, et al. p-Synephrine stimulates glucose consumption via AMPK in L6 skeletal muscle cells[J]. Biochem Biophys Res Commun, 2012, 418(4): 720–724. DOI:10.1016/j.bbrc.2012.01.085 |
| [17] | 王露萍, 陈炜, 余丕军, 等. 皮肤衰老过程中TGF-β1, 2, 3的表达差异[J]. 组织工程与重建外科杂志, 2014, 10(3): 149–151. DOI:10.3969/j.issn.1673-0364.2014.03.007 |
| [18] | 阚默, 石晓征, 曲晓波. 鹿茸Ⅰ型胶原对MC3T3-E1细胞TGF-β1/Smad基因蛋白表达的影响[J]. 长春中医药大学学报, 2018, 34(5): 857–860, 1030. |
| [19] | 沈翌轩, 田瑞娟, 胡璐, 等. 细胞衰老机制与临床表现的相关研究进展[J]. 数理医药学杂志, 2018, 31(11): 1692–1694. DOI:10.3969/j.issn.1004-4337.2018.11.051 |
| [20] | 周海文, 周曾同. 细胞衰老机制的研究进展[J]. 中国临床康复, 2004, 8(10): 1934–1935. DOI:10.3321/j.issn:1673-8225.2004.10.086 |
| [21] | 高冬雪, 刘杉杉, 宋丽兵, 等. 延缓皮肤衰老机制的研究现状[J]. 世界最新医学信息文摘, 2018(94): 36–37. |
 2019, Vol. 45
2019, Vol. 45


