扩展功能
文章信息
- 梁爽, 陶雪, 潘炎, 苑荣爽, 李贺, 孙靖辉, 鞠文博, 陈建光, 王春梅
- LIANG Shuang, TAO Xue, PAN Yan, YUAN Rongshuang, LI He, SUN Jinghui, JU Wenbo, CHEN Jianguang, WANG Chunmei
- 4种品系五味子木脂素类成分的含量及功效比较
- Comparison of contents and effects of lignans from 4 strains of Schisandra chinensis
- 吉林大学学报(医学版), 2019, 45(02): 300-306
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 300-306
- 10.13481/j.1671-587x.20190215
-
文章历史
- 收稿日期: 2018-04-18
2. 北华大学基础医学院组织胚胎学教研室, 吉林 吉林 132013
2. Department of Histology and Embryology, College of BasicMedical Sciences, Beihua University, Jilin 132013, China
五味子(Schisandra chinensis)是我国著名的传统中药,长白山道地药材,具有收敛固涩、益气生津和补肾宁心的功效,可用于肝病、盗汗、失眠和心悸等[1-2]。近年来,由于掠夺式采收,五味子的野生资源已近枯竭,市场上的五味子药材主要来源于人工栽培。人工培育的五味子多为实生苗,种植地区广泛,不同性状存在广泛变异,产量不一,药材质量差别很大。五味子的品种或品系较多,但相关的基础研究工作严重不足,特别是关于不同品种五味子所含活性成分及含量的相关性、药理功效有无差别的研究相对缺乏,极大地影响了五味子品质评价方法的科学性,严重地制约了五味子的规模化生产和精准靶向应用。五味子中含有木脂素类、多糖和挥发油等成分[3-6],其中木脂素类成分与其抗肝损伤和抗氧化等作用明显相关[7-10]。木脂素的含量直接影响五味子的质量及临床应用。因此本研究以中国科学院特产研究所自行培育的4种五味子嫣红(YH,采集地为吉林省吉林市)、SH(采集地为吉林省柳河县)、156-5-2(采集地为吉林省通化县)和50-1-5(采集地为吉林省集安市)为研究对象,采用《药典》记载的方法提取五味子有效成分,分析其木脂素单体含量,并进行药效学对比研究,以期为科学、准确地评价五味子产品质量和精准靶向应用提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康清洁级雄性小鼠,体质量为18~22g,购于长春亿斯实验动物技术有限公司,动物许可证号:SCXK-(吉)2016-0003,动物合格证号:00016320。小鼠以常规饲料喂养5d,饲养温度为19℃~23℃,湿度为40%~50%。小鼠自由饮食和饮水。4种品系五味子干果五味子嫣红(YH)、SH、156-5-2和50-1-5均由中国科学院特产研究所提供;五味子醇甲(Schizandrol A, 批号:160319)、五味子醇乙(Schizandrol B, 批号:160509)、五味子酯甲(批号:161021)、五味子甲素(Schizandrin A, 批号:151113)、五味子乙素(Schizandrin B, 批号:151113)、五味子丙素(Schizandrin C, 批号:151113)和五味子酚(Schisandenol, 批号:151116)对照品均购于成都普菲德生物技术有限公司;超氧化物歧化酶(superoxide dismutase, SOD)(批号:20161130)、甘油三酯(triglyceride, TG)(批号:20161018)、丙二醛(malondial dehyde, MDA)(批号:20161127)、丙氨酸氨基转移酶(aspartate amirotransferase, AST)(批号:20161227)和天门冬氨酸氨基转移酶(alamine aminotransferase, ALT)(批号:20161023)检测试剂盒均购于南京建成生物工程研究所,甲醇(色谱醇)、亚油酸、吐温20、无水乙醇、浓盐酸、磷酸二氢健、硫氰酸铵和二氯化铁均购于沈阳化学试剂厂。Infinite M200TECAN酶标仪(瑞士TECAN集团公司),JY92-IID超声波细胞粉碎机(宁波新生生物科技股份有限公司),高效液相色谱仪(E2695, 美国Waters公司),旋转蒸发仪(上海予华生化仪器厂),粉碎机(江阴雨晨机械有限公司)。
1.2 五味子提取物制备采用《药典》(2015版)[11]中五味子醇提取物的方法,将五味子干果(YH、SH、156-5-2和50-1-5)用粉碎机粉碎,过40目筛,精密称定100 g,置于圆底烧瓶(2 000 mL)中。加入8倍量的80%乙醇溶液,加热回流2 h,提取2次。合并滤液,抽滤,收集滤液,用旋转蒸发仪使滤液中的乙醇挥发。收集提取物,彻底挥干,称质量,计算提取率。4种品系五味子的提取率:YH 11.0%、SH 14.4%、156-5-2 21.2%、50-1-5 12.2%。
1.3 4种五味子木脂素单体含量测定采用高效液相色谱法(HPLC)同时测定4种五味子中五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素、五味子乙素、五味子丙素和五味子酚的含量。
1.3.1 对照品溶液配制分别精密称取五味子醇甲对照品1.50 mg、五味子醇乙对照品1.50 mg、五味子酯甲对照品1.50 mg、五味子甲素对照品1.50 mg和五味子乙素对照品1.50 mg, 称取五味子酚对照品1.00 mg和五味子丙素对照品1.00 mg,以适量甲醇超声溶解后定容于5mL容量瓶中,摇匀,制成五味子7种单体成分的混合对照品溶液。其中五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素和五味子乙素对照品质量浓度均为0.3 g·L-1,五味子酚和五味子丙素对照品质量浓度为0.2 g·L-1。
1.3.2 供试品溶液配制分别将4种五味子粉碎,过40目筛。称取干燥的样品粉末10.0g,加入300mL甲醇超声提取20min,提取3次,合并滤液,减压蒸干,将所得提取物用甲醇溶解,过滤,并定容至100 mL,过0.45μm滤膜后制得供试品溶液。
1.3.3 HPLC分析条件色谱柱:Waters ODS(250 mm×4.6 mm, 5 μm);岛津GVP保护柱(4.6 mm);流动相:甲醇(A),水(B),梯度洗脱;柱温:30℃;流速:0.5 mL·min-1;检测波长:230 nm;进样量:10 μL。
1.4 4种五味子体外抗氧化作用 1.4.1 4种五味子还原性测定配制0.25、0.50、1.00、2.50和5.00 g·L-14种五味子提取物溶液,分别加入0.2 mol·L-1磷酸盐缓冲液(PBS, pH=6.6)2.5 mL及1%铁氰化钾1.0 mL,于50℃水浴中反应20 min后急速冷却;加入10%三氯乙酸2.5 mL,加蒸馏水定容至10 mL,加入0.1%三氯化铁溶液0.5 mL,混匀,10 min后于700 nm处测定其吸光度(A)值,A值越大表明还原能力越强。
1.4.2 4种五味子抗氧化能力测定取4种五味子提取物溶液(0.50 g·L-1)200 μL,空白组加入等体积蒸馏水,分别加入PBS 2.5 mL混合,亚油酸乳状液2.5 mL混合。置于37℃培养箱中培养96 h,每隔24 h对培养的供试液进行取样,每次200 μL,加入75%乙醇4.5 mL,30%硫氰酸铵200 μL,充分混匀后,加入氯化亚铁-盐酸溶液(2g氯化亚铁溶于50 mL3.5%HCl中)300μL,反应3 min后在500 nm处测定A值。采用蒸馏水代替作为阴性对照的样品溶液,并且重复该程序3次。A值越大表明抗氧化能力越弱。
1.4.3 4种五味子对1, 1-二苯基-2-三硝基苯肼(DPPH)自由基的清除率采用无水乙醇将1 mL样品进行稀释,得到25 mg·L-1的待测溶液,向其中加入0.004%DPPH乙醇溶液5 mL。剧烈振摇混合物并使其在黑暗中静置30 min,以无水乙醇作为参比。酶标仪测定517 nm处的A值。在上述检测过程中,采用蒸馏水代替作为阴性对照的样品溶液,并且重复该程序3次,计算清除率。清除率=[1-(Ai-Aj)×A0-1]×100%,A0为DPPH溶液与无水乙醇混合液的A值,Ai为DPPH溶液与待测试液混合液的A值,Aj为无水乙醇与待测试液混合液的A值。
1.5 4种五味子对小鼠急性酒精性肝损伤的影响 1.5.1 实验动物分组及处理60只小鼠随机分为6组,分别为正常对照组、酒精性肝损伤模型组(模型组)、YH组、50-1-5组、SH组和156-5-2组,每组10只。小鼠适应性饲养5 d后,各给药组小鼠分别灌胃给予五味子提取物溶液,剂量为300 mg·kg-1。正常对照组和模型组小鼠给予同体积蒸馏水灌胃,每天1次,连续15 d。末次给药1 h后,模型组和各给药组小鼠灌胃给予50%酒精(12 mL·kg-1),正常对照组小鼠给予同体积蒸馏水,禁食不禁水。12 h后,各组小鼠分别摘取眼球取血,分离血清,分装入EP管,-80℃冻存。断髓处死小鼠,迅速剖腹取出肝脏,于冷的生理盐水中洗净血液,滤纸吸干,称取肝脏质量,计算肝脏指数。肝脏指数=脏脏质量/体质量×100%。
1.5.2 指标检测各组小鼠眼球取血,以3500 r·min-1离心10 min,分离血清,采用酶法测定血清AST和ALT水平。取肝右叶组织块,称质量,以1:9的比例量取冰冷的生理盐水,肝组织与生理盐水一起倒入匀浆器的玻璃容器中,匀浆,制成10%的组织匀浆,以3000 r·min-1离心15 min后取上清液,WST-1法检测肝组织中SOD活性,TBA法检测MDA水平,氧化酶法检测TG水平,具体方法参照试剂盒说明书。
1.6 统计学分析采用SPSS 18.0统计软件进行统计学分析。五味子还原性、抗氧化性和DPPH自由基清除率,各组小鼠体质量、肝质量、肝脏指数、血清AST和ALT水平,肝组织中SOD活性及MDA、TG水平等均以x±s表示,对于符合正态分布且总体方差齐的数据多组间样本均数比较采用单因素方差分析,不符合正态分布且总体方差不齐的数据多组间比较采用Krusal-WallisH检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 方法学研究 2.1.1 线性关系考察分别精密量取1.3.1和1.3.2项下制备的对照品及供试品溶液,按1.3.3所述色谱条件,取10 μL注入液相色谱仪,记录色谱峰面积。以对照品质量浓度X(mg·L-1)为横坐标,峰面积Y为纵坐标,进行线性回归,得到各组分的回归方程、线性范围和相关系数。各组分在实验范围内线性关系良好,见表 1。
| Group | Regression equation | r2 | Linear range |
| Schizandrol A | Y=88 612X-29334 | 0.997 8 | 2.00-300.00 |
| Schizandrol B | Y=85 262X-45229 | 0.999 8 | 2.00-300.00 |
| Wuweizieste A | Y=93 724X-34661 | 0.997 7 | 2.00-300.00 |
| Schisanhenol | Y=56 830X-10257 | 0.999 6 | 1.33-200.00 |
| Schizandrin A | Y=72 695X-56173 | 0.999 1 | 2.00-300.00 |
| Schizandrin B | Y=93 772X +30563 | 0.996 2 | 2.00-300.00 |
| Schizandrin C | Y=58962X-20860 | 0.9979 | 1.33-200.00 |
取混合对照品溶液,按1.3.2项下方法制备供试品溶液,连续进样6次,按1.3.3项下的色谱条件测定,测定峰面积。7种木脂素单体的相对峰面积相对标准偏差(RSD)分别为0.02%、0.03%、0.03%、0.04%、0.02%、0.05%和0.03%,表明仪器稳定,精密度良好。
2.1.3 稳定性实验取1种五味子药材(五味子YH)供试品,按1.3.2项下方法制备供试品溶液,分别于制备后0、2、4、8、12和24 h测定6次。7种木脂素单体的相对峰面积的RSD为0.58%、0.77%、0.65%、1.28%、2.57%、1.58%和0.77%,表明供试品溶液在24 h内稳定。
2.1.4 重复性实验取1种五味子药材(五味子YH)供试品,按1.3.2项下方法平行制备6份供试品溶液,进样测定。7种木脂素单体的相对峰面积的RSD为1.96%、1.87%、2.34%、1.77%、3.43%、2.55%和3.23%,表明提取和检测方法重复性好。
2.2 4种五味子木脂素单体含量 2.2.1 对照品溶液的HPLC检测结果采用同时定量方法一次性检测7种木脂素单体含量,色谱图见图 1。由左至右依次为五味子醇甲、五味子醇乙、五味子酯甲、五味子酚、五味子甲素、五味子乙素和五味子丙素。
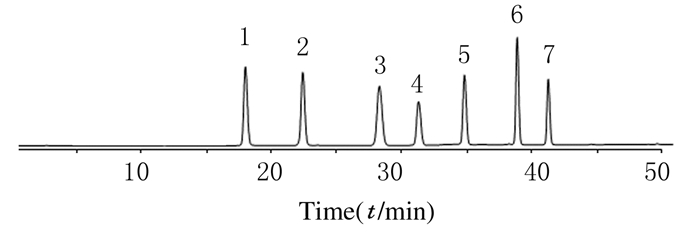
|
| 1: Schizandrol A; 2: Schizandrol B; 3:WuweiziesteA; 4: Schisanhenol; 5: Schizandrin A; 6: Schizandrin B; 7: Schizandrin C. 图 1 对照品溶液的HPLC检测结果 Fig. 1 HPLC results of reference sobution |
|
|
4种品系五味子HPLC图见图 2。对比对照品色谱图可见:4种品系五味子均含有7种木脂素单体。
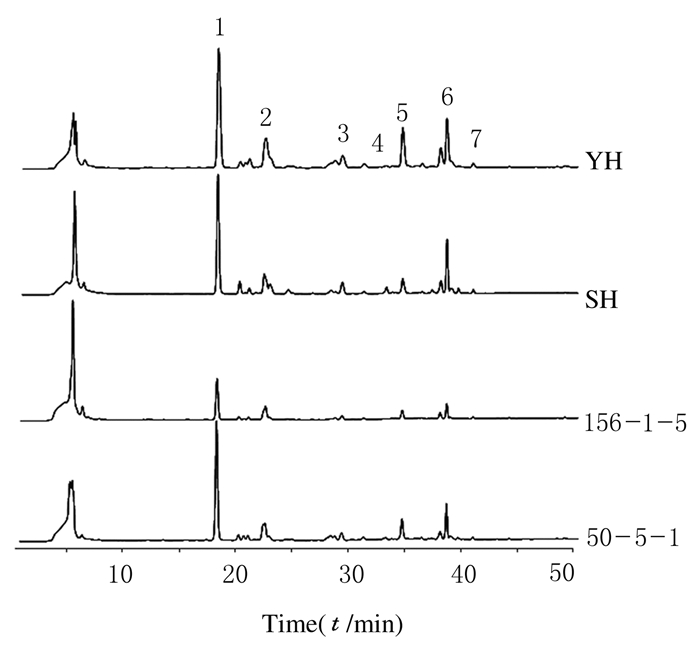
|
| 图 2 供试品溶液的HPLC检测结果 Fig. 2 HPLC results of test solution |
|
|
以外标法计算样品中五味子木脂素单体的含量,结果见表 2。其中YH品系的五味子醇甲、醇乙、五味子酚、甲素和丙素含量最高,SH品系次之。SH品系的五味子酯甲和五味子乙素含量最高,50-5-1品系次之。
| [ρB/(mg·L-1)] | |||||||
| Group | Schizandrol A | Schizandrol B | Wuweiziester A | Schisandol | Schizandrin A | Schizandrin B | Schizandrin C |
| YH | 152.50 | 65.40 | 1.81 | 10.46 | 57.84 | 41.65 | 6.40 |
| SH | 142.29 | 27.61 | 4.41 | 5.71 | 25.30 | 42.73 | 5.55 |
| 156-5-2 | 26.65 | 15.65 | 0.66 | 2.07 | 6.76 | 6.50 | 1.86 |
| 50-1-5 | 92.71 | 10.46 | 2.57 | 5.00 | 19.89 | 42.72 | 5.55 |
五味子还原能力随着浓度的增加呈线性上升趋势,表明4种五味子具有还原性,各品系的还原能力依次为YH>50-5-1> SH>156-5-2。见图 3。
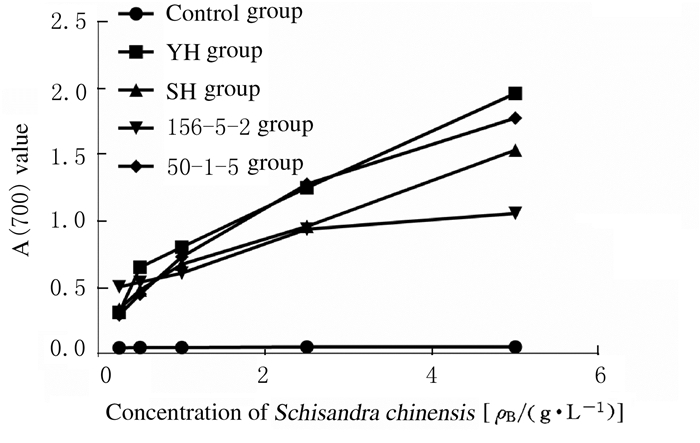
|
| 图 3 4种五味子的还原能力 Fig. 3 Reducing capacities of 4 kinds of Schisandra chinensis |
|
|
亚油酸在37℃时会发生自身氧化,将Fe2+氧化成为血红色的Fe3+络合物。五味子可以抑制亚油酸自氧化,从而起到抗氧化的作用。4种五味子均具有较强的抗氧化能力,并且各品系五味子对亚油酸氧化的抑制作用顺序为YH>SH>50-1-5>156-5-2。见图 4。
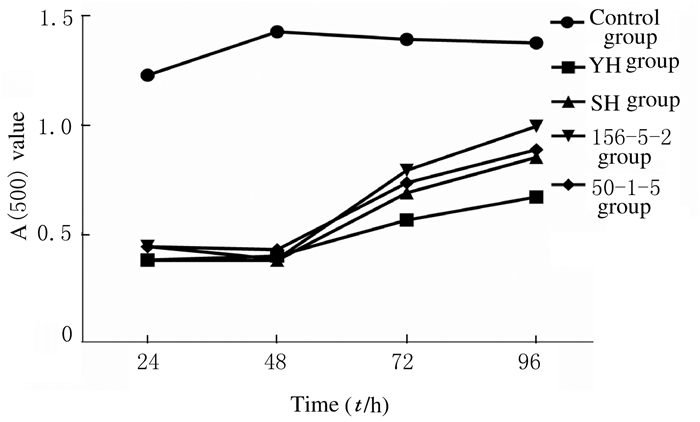
|
| 图 4 4种五味子的抗氧化能力 Fig. 4 Antioxidant abilities of 4 kinds of Schisandra chinensis |
|
|
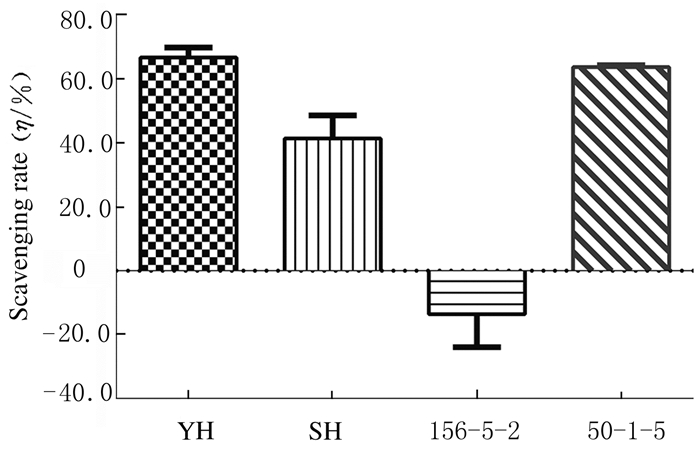
DPPH是一种稳定的自由基,DPPH溶液中加入自由基清除剂时,溶液颜色变浅,因此,可用来检测自由基的清除情况,从而评价某种物质的抗氧化能力,其能力用清除率来表示,清除率越大,抗氧化能力越强。除156-5-2外其余品系五味子对DPPH自由基具有一定清除能力。其中五味子YH清除能力最强,清除率为66.5%,五味子50-1-5的自由基清除率为63.6%,156-5-2对DPPH自由基无清除作用。见图 5。
|
| 图 5 4种五味子对DPPH自由基的清除率 Fig. 5 Scavenging rates of 4 kinds of Schisandra chinensis for DPPH free radicals |
|
|
与正常对照组比较,各组小鼠体质量比较差异无统计学意义(P>0.05),而模型组小鼠肝质量和肝脏指数明显升高(P < 0.05或P < 0.01),说明造模成功。与模型组小鼠比较,YH组小鼠肝质量降低(P < 0.05),肝脏指数明显降低(P < 0.01);50-1-5组小鼠肝质量和肝脏指数均降低,但差异无统计学意义(P>0.05);SH和156-5-2组小鼠肝质量和肝脏指数无明显变化(P>0.05)。见表 3。
| (n=10, x±s) | |||
| Group | Body weight (m/g) |
Liver weight (m/g) |
Liver index (η/%) |
| Normal control | 30.40±2.58 | 1.41±0.10 | 0.047±0.07 |
| Model | 32.60±2.80 | 1.95±0.14** | 0.061±0.006* |
| YH | 33.80±2.04 | 1.69±0.16△ | 0.050±0.003△△ |
| SH | 30.25±2.17 | 1.84±0.29 | 0.060±0.007 |
| 156-5-2 | 33.00±1.22 | 1.88±0.21 | 0.058±0.006 |
| 50-1-5 | 33.75±1.09 | 1.77±0.18 | 0.053±0.006 |
| *P < 0.05, * *P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with model group. |
|||
与正常对照组比较,模型组小鼠血清AST和ALT水平均明显升高(P < 0.01)。与模型组比较,各给药组小鼠血清AST及ALT水平均有不同程度降低,其中YH组小鼠血清AST和ALT水平降低最明显(P < 0.05),156-5-2组小鼠血清ALT水平亦降低(P < 0.05)。YH组小鼠血清AST水平低于50-1-5组(P < 0.05),ALT水平低于SH组和50-1-5组(P < 0.05)。见表 4。
| [n=10, x±s, λB/(U·L-1)] | ||
| Group | AST | ALT |
| Normal control | 7.57±1.86 | 27.49±2.80 |
| Model | 21.06±4.46* | 66.41±7.54* |
| YH | 16.52±2.68△ | 35.86±3.14△ |
| SH | 17.38±3.70 | 43.22±4.18# |
| 156-5-2 | 17.90±1.90# | 39.64±3.82△# |
| 50-1-5 | 19.82±1.85# | 43.92±5.09# |
| *P < 0.01 compared with normal control group; △P < 0.01 compared with model group;#P < 0.05 compared with YH group. | ||
与正常对照组比较,模型组小鼠肝组织中MDA和TG水平明显升高(P < 0.01),SOD活性略有降低(P>0.05)。与模型组比较,YH组、156-5-2组和50-1-5组小鼠肝组织中MDA水平下降,且YH组差异有统计学意义(P < 0.01);YH组和SH组小鼠TG水平明显降低(P < 0.05);YH、SH和50-1-5组小鼠SOD活性升高,但差异无统计学意义(P>0.05)。YH组小鼠肝组织中MDA水平明显低于SH组(P < 0.01)和156-5-2组(P < 0.05),TG水平低于156-5-2组和50-1-5组(P < 0.05)。见表 5。
| (n=10, x±s) | |||
| Group | MDA [cB/(μmol·g -1)] |
SOD [λB/(U·mg -1)] |
TG [cB/(μmol·g -1)] |
| Nomral control | 0.20±0.12 | 870.32±343.66 | 0.18±0.04 |
| Model | 0.46±0.07* | 719.95±124.25 | 0.31±0.03* |
| YH | 0.27±0.05△△ | 924.88±228.65 | 0.19±0.10△ |
| SH | 0.48±0.11# | 917.01±307.48 | 0.21±0.08# |
| 156-5-2 | 0.42±0.07# | 676.52±378.42 | 0.32±0.19# |
| 50-1-5 | 0.37±0.13 | 767.79±234.10 | 0.31±0.08# |
| *P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with model group; #P < 0.01 compared with YH group. |
|||
本研究所用的4种五味子(YH、SH、156-5-2和50-1-5)是由中科院特产研究所自主研发培育。目前,关于4种五味子所含活性成分及其含量是否一致、药理功效有无差别、生产过程中各因素对药材药效有无影响等研究比较缺乏,严重地影响五味子品质评价方法的进步并制约五味子的规模化生产。本研究采用《药典》记载方法,提取4种五味子的有效成分,分析木脂素单体成分的含量,并进行体外抗氧化和保肝效应的对比研究,分析4种五味子成分和功效的差别。
木脂素类成分为五味子的主要活性成分,现已分离鉴定出150多种,主要包括五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙和五味子酚等[12-14]。本研究采用HPLC法建立五味子中7种木脂素成分的同时定量方法,并以此方法对4种五味子药材中的木脂素成分含量进行测定分析,结果表明五味子YH的五味子醇甲、五味子醇乙、五味子酚、五味子甲素和五味子丙素含量最高,五味子SH的五味子酯甲和五味子乙素含量最高,156-5-2最低。
为了对比研究4种五味子的功效,本文作者观察了4种五味子的还原能力、抑制亚油酸氧化能力、清除DPPH自由基能力及其对小鼠急性酒精性肝损伤的保护作用。皮子凤等[15]通过化学计量学方法研发发现:五味子中与抗氧化活性密切相关的是五味子醇甲、五味子醇乙和五味子甲素的含量,其中五味子醇乙的抗氧化能力最强,五味子甲素的抗氧化能力最弱,也有研究[16-20]显示五味子乙素和五味子酚具有明显的清除自由基作用和抑制脂质过氧化作用。本研究结果显示:在4种五味子中,YH品系的五味子醇甲、五味子醇乙和五味子酚的含量均最高,并且对亚油酸自氧化体系具有抑制作用,对Fe3+的还原能力最强,保护小鼠肝损伤能力也最强;五味子SH的各成分含量及体内体外活性次之;而156-5-2品系的各成分含量均较低,且不具备清除DPPH自由基能力,还原能力和抑制亚油酸氧化能力也最弱,提示4种五味子的药效学活性与其木脂素类成分含量可能具有相关性。本研究还发现156-5-2品系虽然抗氧化能力最弱,但其可降低酒精性肝损伤小鼠血清中ALT水平,有关该品系保护肝细胞损伤的具体机制有待进一步研究。
综上所述,4种五味子木脂素类成分含量与其药效学活性具有相关性,本研究所用的4种品系中YH木脂素类成分含量最高,且其抗氧化能力及保护肝损伤能力也最强。上述数据能为精确选用五味子品种提供理论依据。
| [1] | 曲中原, 王一横, 邹翔, 等. 中药五味子研究进展[J]. 食品与药品, 2018, 20(1): 71–75. DOI:10.3969/j.issn.1672-979X.2018.01.017 |
| [2] | 许方敏.五味子及含五味子复方中药的抗抑郁作用与机制研究[D].南宁: 广西医科大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10598-1017202627.htm |
| [3] | LI Z J, HE X, LIU F, et al. A review of polysaccharides from Schisandra chinensis and Schisandra sphenanthera:Properties, functions and applications[J]. Carbohydr Polym, 2018, 184: 178–190. DOI:10.1016/j.carbpol.2017.12.058 |
| [4] | 李洁, 顾伟鹰, 时扣荣, 等. 五味子木脂素类有效成分的药动学及药效学研究进展[J]. 世界临床药物, 2017, 38(5): 348–352. |
| [5] | 刘华, 郭江涛, 王知斌, 等. 五味子挥发油中萜类、芳香族和脂肪族化合物的成分分析[J]. 化学工程师, 2016, 30(8): 27–29, 32. |
| [6] | WANG X, YU J, LI W, et al. Characteristics and antioxidant activity of lignans in Schisandra chinensis and Schisandra sphenanthera from different locations[J]. Chem Biodivers, 2018, 15(6): e1800030. DOI:10.1002/cbdv.v15.6 |
| [7] | ZHANG R, WANG Y, ZHU D, et al. The protective effect of North Schisandra Lignans on vascular endothelial cell oxidation injuries[J]. Technol Health Care, 2016, 24(s2): S651–S657. DOI:10.3233/THC-161192 |
| [8] | 田双, 严铭铭, 邵帅, 等. 五味子醇提物的提取工艺优化及其体外抗氧化作用评价[J]. 中国药房, 2016, 27(28): 3976–3978. DOI:10.6039/j.issn.1001-0408.2016.28.27 |
| [9] | 王春梅, 李贺, 李生, 等. 北五味子木脂素对小鼠酒精性肝损伤的保护作用[J]. 食品科学, 2014, 35(13): 262–265. DOI:10.7506/spkx1002-6630-201413052 |
| [10] | 刘群.五味子藤茎木脂素和多糖的提取及对实验性肝损伤保护作用研究[D].长春: 吉林农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10193-1013310183.htm |
| [11] | 国家药典委员会. 中华人民共和国药典(一部)[M]. 化学工业出版社,2015: 66. |
| [12] | LU T L, WU X Y, SONG Y, et al. Effect of acupuncture on target tissue distribution of Schisandra lignans[J]. Acupunct Med, 2013, 31(2): 207–213. DOI:10.1136/acupmed-2012-010266 |
| [13] | 李洁, 顾伟鹰, 时扣荣, 等. 五味子木脂素类有效成分的药动学及药效学研究进展[J]. 世界临床药物, 2017, 38(5): 348–352. |
| [14] | 于晓礼.五味子优良品种筛选及木脂素类成分的制备研究[D].长春: 吉林大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10183-1013194173.htm |
| [15] | 皮子凤, 侯广月, 艾军, 等. 化学计量学方法研究北五味子中木脂素含量与抗氧化活性的相关性[J]. 中国中药杂志, 2012, 37(8): 1133–1139. |
| [16] | CHOI Y H. Schisandrin A prevents oxidative stress-induced DNA damage and apoptosis by attenuating ROS generation in C2C12 cells[J]. Biomed Pharmacother, 2018, 160: 902–909. |
| [17] | 梁婧, 侯海燕, 兰晓霞, 等. 五味子乙素的药理作用及其分子机制的研究进展[J]. 中国现代应用药学, 2014, 31(4): 506–510. |
| [18] | 李斌, 孟宪军, 薛雪, 等. 北五味子乙素清除自由基及体外抑菌作用的研究[J]. 食品科学, 2011, 32(5): 79–82. |
| [19] | 李莉. 五味子酚等三种抗氧化剂对氧化应激损伤中枢神经细胞的保护作用及其作用机理研究[J]. 生理科学进展, 1998(1): 37–40. |
| [20] | 韩云峰, 田三春, 杨宏艳, 等. 五味子酚对H2O2诱导SH-SY5Y细胞氧化损伤的保护作用[J]. 中国药学杂志, 2018, 53(4): 273–277. |
 2019, Vol. 45
2019, Vol. 45


