扩展功能
文章信息
- 李薇, 于佳卉, 王新婷, 王春梅, 李贺, 陈建光, 孙靖辉
- LI Wei, YU Jiahui, WANG Xinting, WANG Chunmei, LI He, CHEN Jianguang, SUN Jinghui
- 北五味子总木脂素对环磷酰胺诱导的免疫功能低下小鼠的调节作用
- Immunomodulatory effect of Schisandra chinensis lignans in cyclophosphamide-induced immunodeficiency mice
- 吉林大学学报(医学版), 2019, 45(02): 294-299
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 294-299
- 10.13481/j.1671-587x.20190214
-
文章历史
- 收稿日期: 2018-06-08
2. 吉林省吉林市妇产医院药剂科, 吉林 吉林 132011
2. Department of Pharmacy, Hospital of Gynecology and Obstetrics, Jilin City, Jilin Province, Jilin 132011, China
环磷酰胺(cyclophosphamide,Cyp)是临床上常用的抗肿瘤药物之一,其在杀伤肿瘤细胞方面表现出明显免疫抑制作用,限制了其在临床上的应用,因此开发具有针对性免疫调节功能的辅助药物显得尤为重要[1-2]。免疫功能的增强与祖国传统医学的补益扶正功效具有许多相似之处,近年来大量研究[3-4]报道了补益类中药对免疫功能的调节作用。五味子是来源于木兰科植物五味子[Schisandra chinensis (Turcz.) Baill.]的干燥成熟果实,具有补肾和益气等功效,已有多年的应用历史,并被列入保健食品的名单[5-6]。研究[7-8]显示:北五味子多糖有免疫调节作用,但五味子中的标志性成分是木脂素类物质,目前对于北五味子总木脂素(Schisandra chinensis lignans,SCL)免疫调节作用的相关研究报道较少,且作用机制尚未明确。本研究采用Cyp制备免疫抑制小鼠动物模型,观察SCL对其免疫功能的调节作用并探讨其作用机制,为北五味子的开发利用提供实验依据。
1 材料与方法 1.1 SCL的制备北五味子,吉林省集安市五味子种植基地提供,由北华大学药学院李凤丽教授鉴定为木兰科植物五味子的成熟干燥果实。将五味子进行粉碎,过40目筛,采用CO2超临界流体萃取法进行萃取,再通过AB-8大孔树脂,之后采用硅胶柱层析法,最终得到木脂素类成分,采用高效液相色谱法测定其中木脂素类物质的提取率为19.33%[9]。
1.2 实验动物、主要试剂和仪器75只SPF级雄性ICR小鼠,体质量18~22g,由长春亿斯实验动物技术有限公司提供,动物许可证号:SCXK(吉)2016-0003。Cyp注射液(江苏盛迪药业有限公司),印度墨汁(上海锐永生物科技有限公司),刀豆蛋白(Con A,德国Sigma公司),RPMI-1640培养基(美国Thermo Fisher公司),MTT测试盒(德国Sigma公司),γ干扰素(IFN-γ)ELISA试剂盒(上海朗顿生物科技有限公司),Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒(美国eBioscience公司)。酶标仪(Infinite M200,瑞士Tecan公司),分光光度计(UV2550,日本Shimadzu公司),Epics-XL流式细胞仪(美国Beckman Coulter公司)。
1.3 实验动物分组和给药ICR小鼠随机分为对照组,模型组,低、中和高剂量SCL组;每组15只。实验前小鼠适应实验室环境3d。低、中和高剂量SCL组小鼠灌胃给予相应剂量SCL(50、100和200 mg·kg-1),对照组和模型组小鼠灌胃给予相同体积的蒸馏水,连续21d。在给药第17天,模型组和各剂量SCL组小鼠腹腔注射Cyp(20 mg·kg-1),连续5d;对照组小鼠注射相同体积的生理盐水。
1.4 各组小鼠脾脏指数和胸腺指数检测及病理形态表现观察末次给药1 h后,将小鼠处死,分离小鼠的胸腺和脾脏,剔除筋膜等组织后称质量。根据以下公式计算脾脏指数和胸腺指数:脏器指数=脏器质量/动物体质量。采用10%甲醛溶液固定胸腺和脾脏,固定24h后用石蜡包埋,切片后置于载玻片上,HE染色,在光学显微镜(放大倍数为100倍)下观察其病理形态表现。
1.5 各组小鼠巨噬细胞吞噬作用测定在末次给药1 h后,通过尾部静脉注射50%的印度墨汁(0.1 mL·10g-1),在注射后3和11 min时,在小鼠目内眦静脉丛中分别取血25 μL,并立即加入0.1% Na2CO3溶液2 mL。在3和11 min时测定采集样品的吸光度(A)值(分别为A3和A11),以Na2CO3溶液作为空白对照。计算碳粒廓清指数(K)和吞噬指数(α):K =(logA3-logA11)/(t11-t3);α=体质量/(肝质量+脾质量)×K1/3。
1.6 各组小鼠血清IFN-γ水平测定在末次给药1 h后摘除眼球收集血液样品,以3500 r·min-1离心10 min,获得血清,根据ELISA试剂盒说明书测定小鼠血清IFN-γ水平。
1.7 各组小鼠脾淋巴细胞增殖能力测定在末次给药1 h后,处死小鼠,在无菌条件下分离小鼠的脾脏。将脾脏研磨以制备脾淋巴细胞悬液。将细胞悬浮液以1500 r·min-1离心10 min后弃去上清液。重复离心2次后,将2.5 mL RPMI-1640培养基加入到细胞悬液中,取0.1 mL细胞悬液溶于小离心管中并加入台盼蓝染色,1 min后,将10 μL细胞悬液加入计数板中,在细胞计数仪下计数细胞。将细胞密度调整至1×106mL-1。将1 mL细胞悬液加入到24孔培养板中,并设2个复孔,向其中1个孔中加入50 μL Con A,另一个孔用作空白对照。将培养板置于CO2培养箱中培养72 h,在孵育结束前4 h,加入0.7 mL培养液和20 μLMTT溶液(5 g·L-1)。在培养结束时,弃去上清液,向每个孔中加入1 mL酸性异丙醇,随后摇匀以完全溶解至紫色晶体。采用紫外分光光度计在570 nm的波长下测定A值。以加入Con A和不加入Con A孵育的样品间A值的差值代表脾淋巴细胞增殖能力。
1.8 各组小鼠脾淋巴细胞凋亡率测定取1 mL脾淋巴细胞悬浮液,以1000 r·min-1离心10 min,弃去上清液,将沉淀物悬浮于含有200 μL Annexin Ⅴ-FITC的结合缓冲液中,混匀。将细胞悬浮液在室温下静止10 min,然后以1000 r·min-1离心10 min,弃去上清液。将沉淀物置于195 μL Annexin Ⅴ-FITC结合缓冲液中,加入10 μL碘化丙啶(PI)染色溶液,在避光的情况下轻轻混合溶液,然后用Epics-XL流式细胞仪检测,其中Annexin Ⅴ-FITC显示绿色荧光,PI显示红色荧光。
1.9 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组小鼠脏器指数、巨噬细胞吞噬指数、血清IFN-γ水平、脾淋巴细胞增殖能力和脾淋巴细胞凋亡率均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠脾脏指数和胸腺指数与对照组比较,模型组小鼠脾脏指数和胸腺指数明显降低(P < 0.05);与模型组比较,各剂量SCL组小鼠脾脏指数和胸腺指数均明显升高(P < 0.01)。见图 1。

|
| 1:Control group; 2:Model group; 3-5:Low, middle, and high doses of SCL groups.* P < 0.05 compared with control group; △P < 0.01 compared with model group. 图 1 各组小鼠脾脏指数(A)和胸腺指数(B)的直条图 Fig. 1 Histograms of spleen indexes (A) and thymus indexes (B) of mice in various groups |
|
|
对照组小鼠胸腺内可见小叶内梁,胸腺皮质大小和形态正常,每个皮质内可见髓质,髓质结构清晰。与对照组比较,模型组小鼠胸腺皮质淋巴细胞减少,未聚集成结节状,髓质与皮质分界不清,髓质数量减少。与模型组比较,中和高剂量SCL组小鼠皮质与髓质分界清晰,皮质形态和大小恢复正常;低剂量SCL组小鼠皮层和髓质分界不清晰,但略好于模型组。见图 2A~E(插页四)。对照组小鼠脾小体形态和数量正常,红髓和白髓分界清晰。与对照组比较,模型组小鼠脾小体数量明显减少,体积明显缩小,呈萎缩状态,红髓与白髓分界不清。低剂量SCL组小鼠被膜区附近的脾小体数量略有减少,中和高剂量SCL组小鼠脾小体数量接近对照组,脾小体数量恢复正常,红髓与白髓之间分界清晰。见图 2F~J(插页四)。

|
| A—E:Spleen tissue; F — J: Thymus tissue; A, F: Control group; B, G: Model group; C, H: Low dose of SCL group; D, I: Middle dose of SCL group; E, J: High dose of SCL group(ca:Capsule area; sc:Splenic corpuscle; wm: White medulla; rm:Red medulla; lb:Lobular beam; m:Medulla; c: Cortex). 图 2 各组小鼠脾脏和胸腺组织形态表现(HE,×100) Fig. 2 Morphology of spleen and thymus tissues of mice in various groups(HE, ×100) |
|
|
与对照组比较,模型组小鼠巨噬细胞吞噬指数明显降低(P < 0.01)。与模型组比较,各剂量SCL组小鼠巨噬细胞吞噬指数明显升高(P < 0.05或P < 0.01)。见表 1。
| (n=15, x±s) | ||
| Group | Dose(mg·kg-1) | Phagocytic index(α) |
| Control | 0 | 0.46±0.06 |
| Model | 0 | 0.26±0.10* |
| SCL | ||
| Low dose | 50 | 0.36±0.08 △ |
| Middle dose | 100 | 0.36±0.09△ |
| High dose | 200 | 0.39±0.09△△ |
| *P < 0.01 compared with control group;△P < 0.05,△△P < 0.01 compared with model group. | ||
与对照组比较,模型组小鼠血清IFN-γ水平明显降低(P < 0.01)。与模型组比较,各剂量SCL组小鼠血清IFN-γ水平明显升高(P < 0.05或P < 0.01)。见表 2。
| (n=15, x±s) | |||
| Group | Dose(mg·kg-1) | IFN-γ [ρB/(ng·L-1)] | Prolifetration ability of spleen lymphocytes (A value) |
| Control | 0 | 0.91±0.07 | 0.17±0.04 |
| Model | 0 | 0.78±0.08* | 0.08±0.03* |
| SCL | |||
| Low dose | 50 | 0.92±0.14△ | 0.09±0.03 |
| Middle dose | 100 | 1.04±0.16△△ | 0.11±0.03△ |
| High dose | 200 | 0.96±0.22△ | 0.13±0.03△△ |
| *P < 0.01 compared with control group;△P < 0.05,△△P < 0.01 compared with model group. | |||
与对照组比较,模型组小鼠脾淋巴细胞增殖能力明显降低(P < 0.01)。与模型组比较,中和高剂量SCL组小鼠脾淋巴细胞增殖能力明显升高(P < 0.05或P < 0.01)。见表 2。
2.6 各组小鼠脾淋巴细胞凋亡率与对照组比较,模型组小鼠脾淋巴细胞早期、晚期和总凋亡率明显升高(P < 0.01)。与模型组比较,各剂量SCL组小鼠脾淋巴细胞早期、晚期和总凋亡率均明显升高(P < 0.01)。见图 3和表 3。
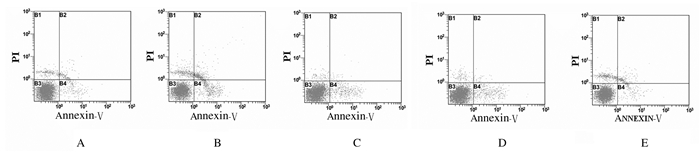
|
| A: Control group; B: Model group; C: Low dose of SCL group; D: Middle dose of SCL group; E: High dose of SCL group(B1: Necrotic cells; B2: Late apoptotic cells; B3: Normal cells; B4: Early apoptotic cells). 图 3 流式细胞术检测各组小鼠脾淋巴细胞凋亡率 Fig. 3 Apoptotic rates of spleen lymphocytes of mice in various groups detected by flow cytometry |
|
|
| (n=15, x±s, η/%) | ||||
| Group | Dose (mg·kg-1) |
Apoptic rate | ||
| Early | Late | Total | ||
| Control | 0 | 3.92±0.24 | 2.91±0.18 | 6.81±0.54 |
| Model | 0 | 10.38±1.35* | 8.60±0.84* | 18.98±1.69* |
| SCL | ||||
| Low dose | 50 | 8.46±1.08△ | 0.74±0.66△ | 9.20±1.48△ |
| Middle dose | 100 | 8.20±1.07△ | 0.82±0.89△ | 9.02±1.29△ |
| High dose | 200 | 3.24±0.97△ | 4.04±0.45△ | 7.28±0.81△ |
| *P < 0.01 compared with control group;△P < 0.01 compared with model group. | ||||
机体的免疫应答过程受到各层次调节机制的严密控制,许多疾病的发生均由免疫调节功能异常引起[10]。胸腺和脾脏是体内主要的淋巴器官,组织炎症可以通过胸腺和脾脏的组织形态学变化来检测,并且这些组织的形态异常可能反映免疫器官的病变并伴随着免疫功能的降低[11]。本研究进行的组织形态学观察结果表明SCL明显改善了Cyp导致的小鼠胸腺和脾脏组织的形态异常。
巨噬细胞是一种重要的免疫细胞,通过吞噬作用介导非特异性免疫炎症,在免疫反应和宿主防御中起到关键作用,从而杀死、清除病原体和异物[12-14]。IFN-γ是活化T细胞和自然杀伤细胞等产生的细胞因子,其水平下降可能引起免疫因子紊乱,导致免疫功能下降[15-16]。本研究结果显示:SCL增强了Cyp诱导的小鼠巨噬细胞的吞噬功能,并增加了小鼠血清IFN-γ水平。
淋巴细胞增殖能力是评估体内T淋巴细胞功能的重要指标。Con A是促细胞有丝分裂素,主要对T淋巴细胞有激发作用,当Con A刺激T淋巴细胞发生细胞增殖反应时,增殖细胞通过线粒体水解酶代谢MTT并产生紫色甲瓒结晶,其A值反映淋巴细胞增殖能力[17-18]。淋巴细胞凋亡与自身免疫系统及免疫相关疾病的发生有关,因此淋巴细胞凋亡的调控已成为目前免疫学研究的热点[14, 18-22]。本研究通过测定脾淋巴细胞增殖能力和凋亡率以评估免疫功能的变化,结果表明:不同剂量SCL能够增强脾脏淋巴细胞的增殖能力,并有效地缓解脾脏T淋巴细胞凋亡。结合脾脏指数和组织学检查结果,表明脾脏萎缩及形态学变化可能是由于Cyp诱导的淋巴细胞凋亡所致,SCL可能通过抑制脾淋巴细胞凋亡而改善脾脏的免疫功能。
综上所述,SCL具有免疫增强作用,其作用机制可能与调节免疫因子IFN-γ水平、增强巨噬细胞吞噬功能和抑制脾淋巴细胞凋亡有关。每日摄入一定量SCL可能是抑制Cyp诱导的免疫功能低下的有效方法,本研究结果可能为北五味子作为一种有效的辅助免疫增强剂的研究和开发提供了理论依据。
| [1] | CHENG D, WAN Z D, ZHANG X Y, et al. Dietary chlorella vulgaris ameliorates altered immunomodulatory functions in cyclophosphamide-induced immunosuppressive mice[J]. Nutrients, 2017, 9(7): E708. DOI:10.3390/nu9070708 |
| [2] | 史晶晶, 时博, 苗明三. 黄芪多糖对环磷酰胺致免疫抑制小鼠免疫功能的影响[J]. 中医学报, 2016, 31(2): 243–246. |
| [3] | 张海玉, 朴惠顺, 金在久, 等. 参芪合剂对环磷酰胺所致免疫抑制小鼠免疫和抗氧化功能的影响[J]. 吉林大学学报:医学版, 2009, 35(5): 857–861. |
| [4] | BO R N, SUN Y Q, ZHOU S Z, et al. Simple nanoliposomes encapsulating Lycium barbarum polysaccharides as adjuvants improve humoral and cellular immunity in mice[J]. Int J Nanomedicine, 2017, 12: 6289–6301. DOI:10.2147/IJN |
| [5] | 张旻昱, 吴宏伟, 许利平, 等. 五味子及其活性成分治疗心脑血管疾病药理作用的研究进展[J]. 中国中药杂志, 2018, 43(8): 1536–1546. |
| [6] | PANOSSIAN A, WIKMAN G. Pharmacology of Schisandra chinensis Bail.:An overview of Russian research and uses in medicine[J]. J Ethnopharmacol, 2008, 118(2): 183–212. DOI:10.1016/j.jep.2008.04.020 |
| [7] | 郭志欣, 朱俊义, 顾地周, 等. 五味子药渣多糖的提取及其免疫活性[J]. 东北林业大学学报, 2016, 44(12): 80–82. DOI:10.3969/j.issn.1000-5382.2016.12.017 |
| [8] | 张琨琨. 五味子多糖免疫调节及抗氧化功能研究[J]. 职业卫生与病伤, 2016, 31(1): 54–57. |
| [9] | SUN J H, JING S, JIANG R, et al. Metabolomics study of the therapeutic mechanism of Schisandra chinensis lignans on aging rats induced by d-galactose[J]. Clin Interv Aging, 2018, 13: 829–841. DOI:10.2147/CIA |
| [10] | 于雷, 王蕴龙, 陈志深, 等. 鹿角脱盘对辐射诱发小鼠胸腺淋巴瘤Notch2基因表达和免疫功能的影响[J]. 吉林大学学报:医学版, 2016, 42(5): 887–891. |
| [11] | LIU J, QI Y J, ZHENG L, et al. Xinfeng capsule improves pulmonary function in ankylosing spondylitis patients via NF-κB-iNOS-NO signaling pathway[J]. J Tradit Chin Med, 2014, 34(6): 657–665. DOI:10.1016/S0254-6272(15)30079-0 |
| [12] | WANG E L, CHEN X, WANG K Y, et al. Plant polysaccharides used as immunostimulants enhance innate immune response and disease resistance against Aeromonas hydrophila infection in fish[J]. Fish Shellfish Immunol, 2016, 59: 196–202. DOI:10.1016/j.fsi.2016.10.039 |
| [13] | ZHAO T, FENG Y, LI J, et al. Schisandra polysaccharide evokes immunomodulatory activity through TLR 4-mediated activation of macrophages[J]. Int J Biol Macromol, 2014, 65: 33–40. DOI:10.1016/j.ijbiomac.2014.01.018 |
| [14] | SHENG X T, YAN J M, MENG Y, et al. Immunomodulatory effects of Hericium erinaceus derived polysaccharides are mediated by intestinal immunology[J]. Food Funct, 2017, 8(3): 1020–1027. DOI:10.1039/C7FO00071E |
| [15] | YANG L C, LU T J, HSIEH C C, et al. Characterization and immunomodulatory activity of polysaccharides derived from Dendrobium tosaense[J]. Carbohydr Polym, 2014, 111: 856–863. DOI:10.1016/j.carbpol.2014.05.007 |
| [16] | CAO Q F, QU M J, YANG W Q, et al. Ischemia postconditioning preventing lung ischemia-reperfusion injury[J]. Gene, 2015, 554(1): 120–124. DOI:10.1016/j.gene.2014.10.009 |
| [17] | ABDUR RAHMAN K, BINABDULHAK A A, ALASTAL Y, et al. Cardioprotective role of ischemic postconditioning in acute myocardialinfarction:A systematic review and meta-analysis[J]. Am Heart, 2014, 168(4): 512–521. DOI:10.1016/j.ahj.2014.06.021 |
| [18] | XING J, XIAO Y E, TANG X Q, et al. Inhibition of Cyclosporine A or rapamycin on T lymphocyte counts and the influence on the immune responses of B lymphocytes in flounder (Paralichthys olivaceus)[J]. Fish Shellfish Immunol, 2017, 66: 78–85. DOI:10.1016/j.fsi.2017.05.017 |
| [19] | HUANG C, SONG K K, MA W W, et al. Immunomodulatory mechanism of Bushen Huoxue Recipe alleviates cyclophosphamide-induced diminished ovarian reserve in mouse model[J]. J Ethnopharmacol, 2017, 208: 44–56. DOI:10.1016/j.jep.2017.06.022 |
| [20] | 奚小土, 刘云涛, 曾瑞峰, 等. 益气温阳对脓毒症内质网应激途径淋巴细胞凋亡的作用[J]. 暨南大学学报:自然科学与医学版, 2017, 38(6): 475–480. |
| [21] | 陈斌, 张涛, 朱文芳, 等. 清温并用法对慢加急性肝衰竭大鼠调节性T淋巴细胞/辅助性T淋巴细胞17表达的影响[J]. 临床肝胆病杂志, 2018, 34(12): 2642–2647. |
| [22] | 吴田田, 姚咏明. 脓毒症免疫紊乱及其临床意义[J]. 解放军医学杂志, 2017, 42(2): 95–102. |
 2019, Vol. 45
2019, Vol. 45


