扩展功能
文章信息
- 胡婧婷, 邱智东, 朱迪夫, 陈英红, 姜瑞芝, 贺明, 罗浩铭
- HU Jingting, QIU Zhidong, ZHU Difu, CHEN Yinghong, JIANG Ruizhi, HE Ming, LUO Haoming
- 人参糖肽的结构及其对Aβ25-35处理PC12细胞的抗凋亡作用
- Structures of ginseng glycopeptides and anti-apoptotic effect on PC12 cells treated with Aβ25-35
- 吉林大学学报(医学版), 2019, 45(02): 286-293
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 286-293
- 10.13481/j.1671-587x.20190213
-
文章历史
- 收稿日期: 2018-11-06
2. 长春中医药大学药学院 中药有效成分教育部重点实验室, 吉林 长春 130117;
3. 吉林省吉测检测技术有限公司研发部, 吉林 长春 130117;
4. 吉林省中医药科学院中医药基础所, 吉林 长春 130012;
5. 河北中医学院中西医结合学院 河北省中西医结合肝肾病证研究重点实验室, 河北 石家庄 050200
2. Key Laboratory of Effective Components of Traditional Chinese Medicine, Ministry of Education, School of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China;
3. Department Research and Development, Jilin Jice Inspection Technology Co., Ltd., Changchun 130117, China;
4. Institute of Traditional Chinese Medicine, Jilin Academy of Chinese Medicine and Material Medicaly Sciences, Changchun 130117, China;
5. Hebei Key Laboratory of Integrated Traditional Chinese and Western Medicine for Hepatorenal Diseases, College of Integrated Traditional Chinese and Western Medicine, Hebei University of Traditional Chinese Medicine, Shijiazhuang 050200, China
中枢神经退行性疾病是严重影响人类健康和生活质量的一类疾病,严重时甚至危及生命。阿尔茨海默病(Alzheimer’ s disease, AD)是一种典型的渐进式、与年龄密切相关的神经退行性疾病,主要表现为记忆损伤和认知功能障碍[1]。AD的发病原因尚不明确,β淀粉样蛋白(amyloid beta, Aβ)斑块、神经元纤维缠结(neurofbrillary tangle, NFT)、神经元炎症和代谢紊乱等多种因素在AD发病过程中均有影响[2-5]。研究[6]显示:细胞外Aβ的聚集是AD最直接的病理学改变。研究[7-8]显示:Aβ聚集可能是开启神经元凋亡的开关,同时凋亡相关蛋白或即早基因(immediate early genes, IEGs)的表达水平明显升高,神经元进入快速死亡程序。人参作为传统滋补中药,已有超过2000年的使用历史,其安神益智的功效一直被临床认可并被广泛应用。人参皂苷和多糖是人参中主要的药效物质,被证明具有抗肿瘤、降血糖、改善心脑血管功能和调节免疫力等作用[9-10]。本课题组前期研究[11]得到人参糖肽组分并研究了其理化性质和抗AD活性,其相对分子质量为200~50000,糖部分由甘露糖、鼠李糖、半乳糖、葡萄糖、N-乙酰葡糖糖胺、N-乙酰半乳糖胺和岩藻糖组成,其中N-乙酰葡糖糖胺和N-乙酰半乳糖胺在人参糖肽研究中尚未见报道;肽部分由甘氨酸、苏氨酸和丝氨酸等17种氨基酸组成。本课题组[12-14]通过行为学实验证实了人参糖肽具有显著增强学习记忆能力的生物活性,且有良好的量效关系。为进一步明确人参糖肽的结构,本研究利用反相高效液相色谱法与质谱联用技术对其结构进行解析。同时,建立β淀粉样蛋白25-35(amyloid beta25-35, Aβ25-35)处理的PC12细胞凋亡模型,在此基础上给予人参糖肽,在细胞水平探讨其神经细胞保护作用,旨在进一步研究人参糖肽抗AD的作用机制,为人参的深度开发提供理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器PC12细胞(武汉普诺赛生命科技有限公司)。人参糖肽为长春中医药大学中药药剂实验室自制,RPMI-1640培养基、特级胎牛血清和马血清(美国Hyclone公司),链霉素-青霉素溶液(美国Gibco公司),Aβ25-35(美国Sigma-Aldrich公司),细胞计数试剂盒-8(CCK-8,上海碧云天生物技术公司),Annexin Ⅴ-FITC/PI细胞凋亡试剂盒(美国BD公司)。Q Exactive、AcclaimTMPepMapTM 100 C18分析柱和CO2细胞培养箱(美国赛默飞世尔科技公司),Infinite M200 Pro全自动酶标仪(瑞士TECAN公司)。Byonic软件(版本:2.3.5,美国Protein Metrics股份有限公司)。
1.2 人参糖肽的制备按文献[14]方法制备具有明显增强学习记忆能力的人参糖蛋白成分,人参糖蛋白经Sephadex G-15纯化,部分收集器收集,每管10 mL。分别于波长280 nm处检测肽类吸光度(A)值;苯酚硫酸法处理后于490 nm处检测糖类A值,以A值为纵坐标,管数为横坐标,绘制折线图。
1.3 液相色谱-质谱联用(LC-MS/MS)分析 1.3.1 样品制备经1.2制备得到的样品加入5 mmol·L-1二硫苏糖醇使其终浓度为20 mmol·L-1,于室温下反应40 min,然后加入15 mmol·L-1碘乙酰胺使其终浓度为40 mmol·L-1,室温下避光反应40 min。反应液加入1%三氟乙酸酸化后使用C18固相萃取(SPE)柱除盐。真空干燥后用0.5%甲酸配置成0.1 g·L-1,取10 μL进行质谱分析。
1.3.2 质谱分析条件使用纳升级反相液相色谱-串联质谱Q Exactive质谱正离子模样品进行分析。分析柱为AcclaimTMPepMapTM 100 C18。所用流动相A为0.1%甲酸溶液,流动相B为乙腈(含0.1%甲酸),流速为300 nL·min-1。洗脱程序:0~2.00 min(5.00% B);2.01~50.00 min (5.01%~30.00% B);50.01~52.00 min (30.01%~100.00% B);52.01~61.00 min (100.00% B)。微电喷雾电压为2.2 kV,扫描模式为全扫描(300~30 000),使用Orbitrap捕获全扫描模式MS数据,然后利用高能碰撞解离(HCD)进行全扫描中丰度最高的5个离子峰的LC-MS/MS扫描。
1.3.3 肽段的分析鉴定利用Byonic分析软件在Uniprot人参蛋白序列数据库中比对实验得到的质谱数据。固定化蛋白修饰包括脲甲基修饰(C)、氧化修饰(M)和糖基化修饰(包括O-连接和N-连接)。所有肽段设置胰蛋白酶全酶切,最高允许2个漏切位点。前体离子质量容忍度设置为10 ppm,LC-MS/MS容忍度为600。肽段鉴定的假阳性率控制在1%以下,以验证获得结果的可靠性。
1.4 CCK-8法检测不同浓度Aβ25-35处理PC12细胞的存活率选择生长期的PC12细胞接种于96孔板上,培养过夜,弃去培养基,分别加入100 μL含不同浓度Aβ25-35(Aβ25-35用双蒸水配成浓度为1 mmol·L-1的溶液,预先老化7 d)的完全培养基(0、6.25、12.50、25.00、50.00和100.00 μmol·L-1),每组设3个复孔,置培养箱中培养48h。按照CCK-8试剂盒说明书处理后,用酶标仪记录450 nm波长各孔的A值,按以下公式计算各组细胞存活率:细胞存活率=处理组A值/对照组A值×100%。重复3次后进行统计分析,最终确定本实验中Aβ25-35处理PC12细胞的造模浓度。
1.5 CCK-8法检测不同浓度人参糖肽与Aβ25-35处理PC12细胞的存活率将PC12细胞分为空白对照组(不加人参糖肽与Aβ25-35)、模型组(只加入50.00 μmol·L-1Aβ25-35)和给药组(0.03、0.10、0.30和1.00 g·L-1人参糖肽)。选择对数生长期的PC12细胞接种于96孔板上,培养过夜,弃去培养基,除空白对照组与模型组外,给药组分别加入100 μL含有不同浓度人参糖肽组分的完全培养基,培养4h,除空白对照组外,其他各组再分别加入100 μL含有50 μmol·L-1Aβ25-35的完全培养基,每组设3个复孔,置培养箱中培养48 h,按1.4中的方法计算各组细胞存活率。
1.6 流式细胞术检测人参糖肽与Aβ25-35处理PC12细胞的凋亡率PC12细胞以1×105L-1的密度接种于12孔培养板中,培养过夜,弃去培养基。除空白对照组和模型组外,给药组分别加入100 μL含有不同浓度(0.03、0.10、0.30和1.00 g·L-1)人参糖肽的完全培养基,培养4 h。然后,除空白对照组外,模型组和给药组再分别加入100 μL含有50 μmol·L-1Aβ25-35的完全培养基,置培养箱中培养48 h,各组细胞用胰酶常规消化,收集细胞,离心,按照AnnexinⅤ-FITC/PI细胞凋亡试剂盒方法处理细胞,采用流式细胞术测定各组PC12细胞的凋亡百分比,右下象限表示早期凋亡(AnnexinⅤ-FITC+/PI+),右上象限表示晚期凋亡和坏死细胞(AnnexinⅤ-FITC+/PI-)。细胞凋亡率=右下象限细胞所占百分比+右上象限细胞所占百分比。
1.7 流式细胞术检测人参糖肽与Aβ25-35处理PC12细胞的细胞周期PC12细胞以1×105L-1的密度接种于12孔培养板中,培养过夜。弃去培养基。除空白对照组和模型组外,给药组分别加入100 μL含有不同浓度(0.10和0.30 g·L-1)人参糖肽的完全培养基,培养4 h。然后,除空白对照组外,模型组和给药组再分别加入100 μL含有50 μmol·L-1Aβ25-35的完全培养基,置培养箱中培养48 h。各组细胞用胰酶常规消化,1000 r·min-1离心5 min后弃去上清液。PBS洗后离心,弃去上清液,用少量PBS悬浮细胞。细胞采用0.5 mL(-20℃预冻)70%乙醇、于4℃下孵育48 h。染色前,于1000 r·min-1离心5 min后弃去固定液,PBS洗涤2次。每孔用100μL PBS重新悬浮细胞,在37℃避光条件,用含有3μL RNase和20 mg·L-1PI的溶液孵育30 min后,采用流式细胞术进行测定,每个样本检测10 000个细胞。
1.8 统计学分析采用SPSS11.0统计软件进行统计学分析。各组PC12细胞存活率、凋亡率和各细胞周期中细胞所占百分比进行正态分布检验,正态分布数据以x±s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 人参糖肽的制备人参糖肽蛋白经Sephadex G-15纯化,利用苯酚硫酸法和蛋白含量测定法隔管检测,以管数为横坐标、A值为纵坐标。见图 1。第10~24管多糖和蛋白含量均较高,第25管后,两者含量均出现明显下降。因此,收集第10~25管组分,合并后浓缩、真空干燥,得到人参糖肽样品。
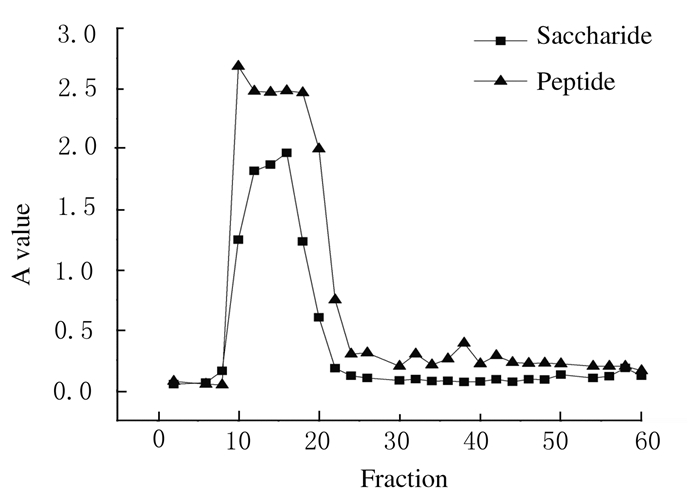
|
| 图 1 Sephadex G15洗脱曲线图 Fig. 1 Sephadex G15 elution profile |
|
|
利用LC-MS/MS能够实现更深层次的位点特异性结构表征分析。将质谱原始数据输入程序,在Byonic数据库中检索以确定多肽序列,并通过分析碎片的质核比确定糖肽结构。第一级质谱得到的糖肽分子离子作为母离子,其与惰性气体碰撞,肽键断裂,形成N端碎片b离子和C端碎片y离子。主要包含了带有1+和2+2种电荷的质谱峰。其中,[M+2H]2+母离子的m/z为429.18,说明该糖肽片段的相对分子质量为856.36。y42+-H2O碎片离子的m/z为210.09,说明y4碎片的相对分子质量为456.1;而y52+-NH3碎片离子的m/z为369.15,说明y5碎片的相对分子质量为772.30。y4碎片与y5碎片的相对分子质量相差316.12,因此推测该位置为糖基化位点,并且应为单糖修饰的氨基酸。通过比对数据库,计算出该糖肽的糖基化位点为天冬酰胺N2,修饰单糖是HexNAc(N-乙酰氨基葡萄糖或N-乙酰氨基半乳糖)。一般而言,N糖链的骨架结构为连接在天冬酰胺上的Man α1→ 6 (Man α1→3) Man β1→4 GlcNAc β1→4 GlcNAc链,被称作N糖链的“核心五糖”结构。以此为基础,糖基转移酶进一步将糖残基连接到“核心五糖”结构上,得到3种主要类型的聚糖:高甘露糖型、复杂型和混合型。而O糖链的结构则比较简单,无复杂的骨架,通常为连接在丝氨酸或者苏氨酸上的Gal β1→3 GalNAc链。因此,推断该糖肽的结构为CN (GlcNAc) TICT,糖基化位点为天冬酰胺N2,修饰单糖为N-乙酰氨基葡萄糖。见图 2。

|
| 图 2 人参糖肽CNTICT骨架结构的质谱分析图 Fig. 2 Mass spectrometric analysis of skeleton structure of ginseng glycopeptide CNTICT |
|
|
通过上述策略对人参糖肽样品中的20个主要成分进行了分析。人参糖肽片段存在相同肽链和相同糖链、但不同糖基化位点的情况,例如肽链“STCDLYSA”分别在S1和T2修饰Hex(1) HexNAc(1)的2种结构;还存在相同肽链和相同糖基化位点、不同糖链修饰的,例如肽链“GSGSACR”在S4分别修饰了HexNAc(1)Hex(1)NeuAc(1)和S4-HexNAc(2)的2种结构。
| Peptide | Glycan | Molecular weight | GRAVY |
| NLSHYHSGSS | N1-HexNAc | 1 291.55 | -1.100 |
| SGSSSSSSSEDDGMGR | S6-HexNAc | 1 735.65 | -1.294 |
| GASDRE | S3-HexNAc | 837.35 | -1.817 |
| CGSSGRCHCSK | S10-HexNAc(1)Hex(1)NeuAc(1) | 1 780.67 | -0.664 |
| GSSDQSR | S3-HexNAc(1)Hex(1)NeuAc(1) | 1 392.51 | -2.043 |
| ETLLGK | T2-HexNAc(1) | 863.47 | -0.150 |
| ISTDYGFEGHPLR | S2-HexNAc(2)Hex(1) T3-HexNAc(1)Hex(1)NeuAc(1) | 905.09 | -0.677 |
| SGMSVR | S4-HexNAc(1)Hex(1) | 1 001.43 | -0.067 |
| IENSTNR | N3-HexNAc(3)Hex(5) S4-HexNAc(1)Hex(1)NeuAc(2) | 801.33 | -1.714 |
| GSGSACR | S4-HexNAc(1)Hex(1)NeuAc(1) | 1 293.47 | -0.371 |
| GSGSACR | S4-HexNAc(2) | 1 100.40 | -0.371 |
| GSEEGK | S2-HexNAc(1)Hex(1)NeuAc(2) | 1 553.57 | -2.083 |
| DEENSR | S5-HexNAc(1)Hex(1) | 1 114.43 | -3.217 |
| EYFEDNSAE | S7-Hex(1)HexNAc(1) | 1 468.54 | -1.667 |
| CNTICT | N2-HexNAc | 857.34 | 0.767 |
| CNTICT | T3-HexNAc | 857.33 | 0.767 |
| STCDLYSA | T2-Hex(1)HexNAc(1) | 1 281.49 | 0.125 |
| STCDLYSA | S1-Hex(1)HexNAc(1) | 1 281.49 | 0.125 |
| VTAQDAMMST | T2-HexNAc | 1 257.52 | 0.240 |
| IVDQCSNGGLDLDVGVFR | S6-HexNAc(1)Hex(1) | 910.37 | 0.333 |
随着Aβ25-35浓度的增加,与空白对照组比较,Aβ25-35处理组PC12细胞存活率明显下降(P < 0.01),并呈现量效关系。当Aβ25-35的浓度达到50 μmol·L-1时,PC12细胞存活率为(55.45±2.34)%,低于空白对照组(P < 0.01)。因此确定实验中Aβ25-35造模浓度为50μmol·L-1。见图 3。
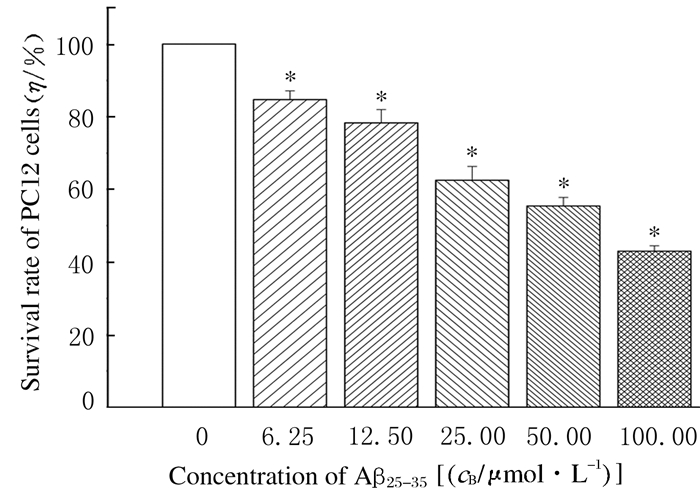
|
| *P < 0.01compared with blank control group (0 μmol·L-1 Aβ25-35group). 图 3 不同浓度Aβ25-35处理后PC12细胞存活率 Fig. 3 Survival rates of PC12 cells after treated with different concentrations of Aβ25-35 |
|
|
与空白对照组比较,模型组PC12细胞存活率明显下降(P < 0.01)。与模型组比较,给药组PC12细胞存活率明显升高(P < 0.05),并呈现出良好的量效关系。见图 4。
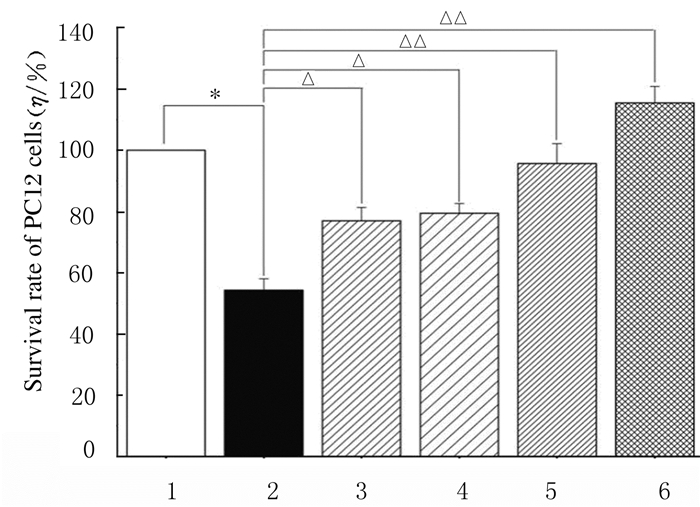
|
| 1:Blank control group; 2:Model group; 3-6:Administration groups(0.03, 0.10, 0.30, and 1.00 g·L-1 ginseng glycopeptides).*P < 0.01 compared with blank control group; △P < 0.01, △△P < 0.05 compared with model group. 图 4 人参糖肽与Aβ25-35处理后各组PC12细胞的存活率 Fig. 4 Survival rates of PC12 cells in various groups after treated with ginseng glycopeptides and Aβ25-35 |
|
|
与空白对照组比较,模型组PC12细胞凋亡率明显升高(P < 0.01);与模型组比较,给药组PC12细胞凋亡率明显下降(P < 0.05)。见图 5和6。
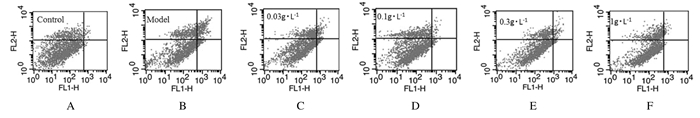
|
| A:Blank control group; B: Model group; C-F:Administration groups(0.03, 0.10, 0.30, and 1.00 g·L-1 ginseng glycopeptides). 图 5 流式细胞术检测人参糖肽和Aβ25-35处理后各组PC12细胞的凋亡率 Fig. 5 Apoptotic rates of PC12 cells in various groups after treated with ginseng glycopeptides and Aβ25-35 detected by flow cytometry |
|
|

|
| 1:Blank control group; 2:Model group; 3-6:Administration groups(0.10, 0.30, and 1.00 g·L-1 ginseng glycopeptides).*P < 0.01 compared with blank control group; △P < 0.05, △△P < 0.01 compared with model group. 图 6 人参糖肽和Aβ25-35处理后各组PC12细胞凋亡率直条图 Fig. 6 Histogram of apoptotic rates of PC12 cells in various groups after treated with ginseng glycopeptides and Aβ25-35 |
|
|
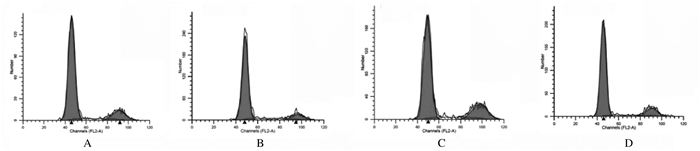
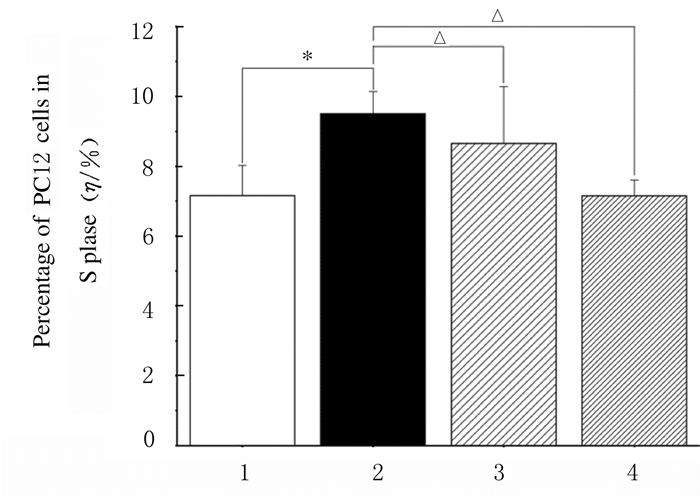
与空白对照组比较,模型组PC12细胞经50μmol·L-1Aβ25-35处理后48 h时细胞周期出现明显变化,主要表现为G2/M期PC12细胞百分比减少(P < 0.05)和S期PC12细胞百分比升高(P < 0.05)。与模型组比较,给药组(0.10和0.30 g·L-1人参糖肽) S期PC12细胞百分比明显降低(P < 0.05),呈一定的量效关系。见图 7和8。
|
| A:Blank control group; B: Model group; C, D:Administration groups (0.10 and 0.30 g·L-1ginseng glycopeptides). 图 7 人参糖肽和Aβ25-35处理后各组PC12细胞的细胞周期 Fig. 7 Cell cycles of PC12 cells in various groups after treated with ginseng glycopeptide and Aβ25-35 |
|
|
|
| 1:Blank control group; 2:Model group; 3, 4:Administration groups(0.10and 0.30 ginseng glycopeptides).*P < 0.01 compared with blank control group; △P < 0.05 compared with model group. 图 8 人参糖肽和Aβ25-35处理后各组S期PC12细胞百分比 Fig. 8 Percentages of PC12 cells in S phase in various groups after treated with ginseng glycopeptides and Aβ25-35 |
|
|
研究[15]证实:神经元细胞凋亡与AD直接相关。Aβ介导神经细胞凋亡的确切机制目前尚未完全阐明,但有文献[16-18]显示:氧化应激在该过程中起关键作用,在AD患者大脑中发现了蛋白过氧化、DNA过氧化和脂质过氧化的升高。本课题组前期研究[19]显示:从人参中分离得到人参糖肽组分,经体内实验证实其具有改善大鼠学习记忆能力的药理活性。本研究结果显示:PC12细胞经Aβ25-35处理后,细胞存活率明显下降,细胞凋亡率明显上升;PC12细胞经人参糖肽处理后,细胞存活率明显高于模型组,当人参糖肽浓度为1 g·L-1时,细胞存活率达到(114.84±6.23)%,细胞凋亡率明显低于模型组,表明人参糖肽不仅能够抑制细胞凋亡,还能促进细胞增殖,而人参糖肽改善学习记忆功能的作用可能与保护神经元、减少细胞凋亡有直接关联。细胞周期和细胞凋亡是两个完全不同的过程,研究[20]表明两者间存在着许多内在联系,例如成视网膜细胞瘤基因(retinoblastoma gene)、转录因子E2F1和p53基因均参与了两个进程。细胞周期调控在AD进展中起到重要的作用,因此参与细胞周期调节的分子也成为治疗干预AD的潜在靶点[21-22]。真核细胞周期包括4个连续阶段,即G1、S、G2和M期,其中S和M期是DNA复制和细胞产生最关键的2个阶段。本研究结果显示:PC12细胞经Aβ25-35处理后,与空白对照组比较,S期细胞占总细胞数比例明显升高;经人参糖肽处理后,S期细胞所占比例明显下降。有研究[23-24]显示:氧化应激后发生细胞凋亡,引起的蛋白过氧化可通过β-catenin-CDK2通路引起细胞S期阻滞,提示人参糖肽可能通过抑制此通路调节细胞周期,起到神经细胞保护作用。
研究[25]显示:蛋白质和肽类化合物对中枢神经系统疾病和神经退行性疾病,如AD、帕金森病和疼痛等具有很强的药理活性。但该类化合物通常具有化学不稳定性和难以透过血脑屏障的问题。研究[26-27]显示:肽的糖基化可以提高其亲水性、稳定性以及生物利用度,非特异性糖基化可以增强其渗透进入神经系统的能力。为下一步对人参糖肽的构效关系进行深入研究,本课题组利用LC-MS/MS对人参糖肽结构进行了解析,该方法可以帮助解析肽段结构,且提供了推测糖基化位点和解析配糖体结构的有效手段,结合前期工作[6]中的甲基化分析结果,可以初步推测N-糖和O-糖可能存在的结构。通过LC-MS/MS分析可知:在肽骨架IENSTNR上连接了2个糖基,分别是天冬酰胺上的N-糖N3-HexNAc(3)Hex(5)和丝氨酸上的O-糖S4-HexNAc(1)Hex(1)NeuAc(2)。已知N糖链的“核心五糖”结构由2个N-乙酰氨基葡萄糖和3个甘露糖组成,即HexNAc(2)Hex(3)。核心结构通过进一步的修饰得到多种复杂结构,故推断该N糖链为混合型结构。而O-糖常是通过N-乙酰半乳糖氨基转移酶将N-乙酰氨基半乳糖连接到丝氨酸或者苏氨酸上,再继续添加其他糖类,如半乳糖。一般情况下,2个唾液酸之间的糖苷键是α2→8以形成稳定的内酯,因此本课题组最终推断的糖基结构为IEN[HexNAc(3)Hex(5)]S[HexNAc(1)Hex(1)NeuAc(2)]TNR。这种推测得到的结构与本课题组前期工作中甲基化的结果相吻合,进一步证实了推测的准确性,也为研究构效关系奠定了有力的理论依据。本研究结果为探讨人参糖肽改善学习记忆的构效关系提供了科学依据的同时,拓展了人参研发范围,促进了以人参为基础的抗AD药物的研发。
| [1] | LANE C A, HARDY J, SCHOTT J M. Alzheimer's disease[J]. Eur J Neurol, 2017, 25(1): 59–70. |
| [2] | GRAHAM W V, BONITOOLIVA A, SAKMAR T P. Update on Alzheimer's disease therapy and prevention strategies[J]. Annu Rev Med, 2017, 68: 413–430. DOI:10.1146/annurev-med-042915-103753 |
| [3] | THEOFILAS P, EHRENBERG A J, NGUY A, et al. Probing the correlation of neuronal loss, neurofibrillary tangles, and cell death markers across the Alzheimer's disease Braak stages:a quantitative study in humans[J]. Neurobiol Aging, 2018, 61: 1–12. DOI:10.1016/j.neurobiolaging.2017.09.007 |
| [4] | MINTER M R, TAYLOR J M, CRACK P J. The contribution of neuroinflammation to amyloid toxicity in Alzheimer's disease[J]. J Neurochem, 2016, 136(3): 457–474. DOI:10.1111/jnc.2016.136.issue-3 |
| [5] | TAGA M, MINETT T, CLASSEY J, et al. Metaflammasome components in the human brain:a role in dementia with Alzheimer's pathology?[J]. Brain Pathol, 2017, 27(3): 266–275. DOI:10.1111/bpa.2017.27.issue-3 |
| [6] | AWASTHI M, SINGH S, PANDEY V P, et al. Alzheimer's disease:An overview of amyloid beta dependent pathogenesis and its therapeutic implications along with in silico approaches emphasizing the role of natural products[J]. J Neurol Sci, 2016, 361: 256–271. DOI:10.1016/j.jns.2016.01.008 |
| [7] | ONUKI R, BANDO Y, SUYAMA E, et al. An RNA-dependent protein kinase is involved in tunicamycin-induced apoptosis and Alzheimer's disease[J]. EMBO J, 2004, 23(4): 959–968. DOI:10.1038/sj.emboj.7600049 |
| [8] | HALAWA A A, DAMBORSKY J C, SLATON G S, et al. Activation of immediate early genes by nicotine after chronic neonatal nicotine exposure in brain areas involved in stress and anxiety responses[J]. Brain Res, 2018, 1687: 32–40. DOI:10.1016/j.brainres.2018.02.027 |
| [9] | MAJEED F, MALIK F Z, AHMED Z, et al. Ginseng phytochemicals as therapeutics in oncology:Recent perspectives[J]. Biomed Pharmacother, 2018, 100: 52–63. DOI:10.1016/j.biopha.2018.01.155 |
| [10] | 陈文学, 杨铭, 于德伟, 等. 人参糖肽对糖尿病气阴两虚证大鼠降血糖作用及其机制研究[J]. 中国药学杂志, 2014, 49(21): 1903–1907. |
| [11] | 罗浩铭, 王颖, 陈英红, 等. 人参糖蛋白对Aβ25~35诱导SH-SY5Y细胞凋亡的影响[J]. 中国老年学杂志, 2016, 36(24): 6077–6080. DOI:10.3969/j.issn.1005-9202.2016.24.014 |
| [12] | 王颖, 白珺, 宋伍, 等. 人参糖蛋白降低Aβ25-35诱导SH-SY5Y细胞凋亡中一氧化氮释放的保护作用[J]. 吉林中医药, 2017(5): 497–500. |
| [13] | 罗浩铭, 陈英红, 周婷婷, 等. 人参糖蛋白对小鼠学习和记忆能力的影响[J]. 吉林大学学报:医学版, 2016, 42(3): 439–445. |
| [14] | LUO H M, HU J T, WANG Y, et al. In vivo and in vitro neuroprotective effects of Panax ginseng glycoproteins[J]. Int J Biol Macromol, 2018, 113: 607–615. DOI:10.1016/j.ijbiomac.2018.02.015 |
| [15] | DEAN D N, PATE K M, MOSS M A, et al. Conformational dynamics of specific Aβ oligomers govern their ability to replicate and induce neuronal apoptosis[J]. Biochemistry, 2016, 55(15): 2238–2250. DOI:10.1021/acs.biochem.6b00161 |
| [16] | ALTUNOGLU E, GUNTAS G, ERDENEN F, et al. Ischemia-modified albumin and advanced oxidation protein products as potential biomarkers of protein oxidation in Alzheimer's disease[J]. Geriatr Gerontol Int, 2015, 15(7): 872–880. DOI:10.1111/ggi.2015.15.issue-7 |
| [17] | AKKAYA Ç, YAVUZER S S, YAVUZER H, et al. DNA damage, DNA susceptibility to oxidation and glutathione redox status in patients with Alzheimer's disease treated with and without memantine[J]. J Neurol Sci, 2017, 378: 158–162. DOI:10.1016/j.jns.2017.04.051 |
| [18] | BRADLEYWHITMAN M A, LOVELL M A. Biomarkers of lipid peroxidation in Alzheimer disease (AD):an update[J]. Arch Toxicol, 2015, 89(7): 1035–1044. DOI:10.1007/s00204-015-1517-6 |
| [19] | 吕京南, 罗浩铭, 陈英红, 等. 人参非皂苷成分中具有治疗老年痴呆作用的活性成分筛选及其结构表征[J]. 时珍国医国药, 2015, 26(11): 2561–2563. |
| [20] | QI S, CALVI B R. Different cell cycle modifications repress apoptosis at different steps independent of developmental signaling in Drosophila[J]. Mol Biol Cell, 2016, 27(12): 1885–1897. DOI:10.1091/mbc.e16-03-0139 |
| [21] | COUNTS S E, MUFSON E J. Regulator of cell cycle (RGCC) expression during the progression of Alzheimer's disease[J]. Cell Transplant, 2016, 26(4): 693–702. |
| [22] | KUHLA A, LUDWIG S C, KUHLA B, et al. Advanced glycation end products are mitogenic signals and trigger cell cycle reentry of neurons in Alzheimer's disease brain[J]. Neurobiol Aging, 2015, 36(2): 753–761. DOI:10.1016/j.neurobiolaging.2014.09.025 |
| [23] | SUN S, XIE F, XU X, et al. Advanced oxidation protein products induce S-phase arrest of hepatocytes via the ROS-dependent, β-catenin-CDK2-mediated pathway[J]. Redox Biol, 2018, 14: 338–353. DOI:10.1016/j.redox.2017.09.011 |
| [24] | JI X J, HUMENIK J, YANG D, et al. PolyC-binding proteins enhance expression of the CDK2 cell cycle regulatory protein via alternative splicing[J]. Nucleic Acids Res, 2018, 46(4): 2030–2044. DOI:10.1093/nar/gkx1255 |
| [25] | 安明, 赵国君, 韦新成, 等. 人参皂苷Rg1保护心血管和中枢神经系统的药理活性研究进展[J]. 中国临床药理学杂志, 2012, 28(1): 75–77. DOI:10.3969/j.issn.1001-6821.2012.01.024 |
| [26] | LUO J H, WARMLANDER S K, GRASLUND A, et al. Non-chaperone proteins can inhibit aggregation and cytotoxicity of Alzheimer amyloid β peptide[J]. J Biol Chem, 2014, 289(40): 27766–27775. DOI:10.1074/jbc.M114.574947 |
| [27] | MCCLEAN P L, PARTHSARATHY V, FAIVRE E, et al. The diabetes drug liraglutide prevents degenerative processes in a mouse model of Alzheimer's disease[J]. J Neurosci, 2011, 31(17): 6587–6594. DOI:10.1523/JNEUROSCI.0529-11.2011 |
 2019, Vol. 45
2019, Vol. 45


