扩展功能
文章信息
- 王艳蕾, 贾雨涵, 赵嘉涵, 汤雅婷, 林艺鑫, 陈默, 姜泓
- WANG Yanlei, JIA Yuhan, ZHAO Jiahan, TANG Yating, LIN Yixin, CHEN Mo, JIANG Hong
- 甘草次酸对雄黄致小鼠海马突触超微结构损伤的改善作用
- Improvement of glycyrrhetinic acid on damage of synaptic ultrastructures of hippocampus induced by realgar in mice
- 吉林大学学报(医学版), 2019, 45(02): 268-272
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 268-272
- 10.13481/j.1671-587x.20190210
-
文章历史
- 收稿日期: 2018-05-21
2. 中国医科大学公共卫生学院卫生检验学教研室, 辽宁 沈阳 110122
2. Department of Health Laboratory Technology, School of Public Health, China Medical University, Shenyang 110122, China
雄黄是一种含砷矿物类中药,作为中药在我国已有上千年的历史。雄黄中的砷可通过血脑屏障积聚于脑组织中,引起学习记忆障碍[1-2],但是雄黄引起学习记忆障碍的机制尚不完全清楚。海马是学习记忆等高级神经活动的重要中枢,而突触是神经元之间传递和加工信息的部位,突触结构改变可引起突触传递效能的降低。雄黄引起的学习记忆障碍是否与突触结构损伤有关,目前尚未见文献报道。配伍减毒是中医药在长期发展过程中形成的优势。甘草是中国传统中药,因其具有调和药性和解毒作用,常作为佐使药存在于多种含雄黄的中成药中。研究[3-5]显示:牛黄解毒片中甘草对雄黄存在配伍减毒效应。甘草次酸(glycyrrhetinic acid, GA)是甘草发挥药效的主要成分,具有抗炎、抗氧化等药理作用。在体内GA减低雄黄毒性的机制,目前未见文献报道。本研究通过观察海马突触间隙宽度、活性带长度及突触后致密物厚度、突触界面曲率等突触结构参数的变化,探讨雄黄致学习记忆损伤的可能机制及GA对其的作用,为砷中毒防治提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂与仪器SPF级雄性ICR小鼠60只,体质量(18±22)g,由中国医科大学实验动物中心提供(动物合格证号:SCXK(辽)2013-0001)。雄黄(>90 % As4S4)(甘肃省甘南藏族自治州药材公司),羧甲基纤维素钠(CMC-Na)(国药集团化学试剂有限公司),GA(>98 %)(上海源叶生物科技有限公司),谷胱甘肽(GSH)标准品(美国Aladdin工业公司)。1260型高效液相色谱仪(美国Agilent公司),透射电镜(HITACHI H-7650,日本HITACH公司)。
1.2 实验动物分组和处理ICR小鼠按体质量随机分为对照组、雄黄组和GA干预组,每组20只。对照组小鼠灌胃给予质量浓度0.5% CMC-Na水溶液;雄黄组小鼠连续灌胃给予雄黄混悬液1.35 g·kg-1,以0.5 % CMC-Na水溶液为混悬介质;GA干预组小鼠灌胃给予GA 48 mg·kg-1和雄黄1.35 g·kg-1,以0.5% CMC-Na水溶液为混悬介质,每日1次,连续灌胃8周。雄黄的炮制方法参照姜泓等[6]的方法进行。实验期间,小鼠自由摄食、饮水。每周记录小鼠体质量2次,调节灌胃容量。实验过程完全符合实验伦理学要求,尽量减少动物的使用量,并最低限度减少动物的痛苦。
1.3 小鼠新事物识别实验参照HEYSER等[7]的方法记录实验阶段各组小鼠探索新物体和熟悉物体的时间,利用实验阶段新物体优先指数(preferential index, PI)反映小鼠的记忆能力和认知功能。新物体PI是小鼠探索新物体时间占总探索时间的百分比。同时记录实验阶段小鼠运动速度。通过新物体PI观察GA对小鼠记忆能力和认知功能的影响。
1.4 计算海马系数各组小鼠经腹腔麻醉后断头处死,冰浴下取海马组织。采用1/10 000分析天平称海马质量,计算海马系数。海马系数=海马质量/体质量×100 %。通过测定海马系数观察雄黄对海马质量的影响。
1.5 小鼠海马组织中GSH水平测定采用HPLC法检测各组小鼠海马组织中GSH水平。取各组小鼠海马组织,按100:1加入去离子水,冰浴超声破碎1 min,制成匀浆液。参照ZHANG等[8]的方法进行检测。通过检测海马组织中GSH水平,观察GA对海马组织抗氧化能力的影响。
1.6 小鼠海马组织超微结构观察各组随机选取2只小鼠,经腹腔麻醉后,断头,在冰上快速分离海马,切取1 mm×1 mm×1 mm海马CA1区组织块,2.5%戊二醛溶液4℃固定24 h。0.1 mol·L-1磷酸盐缓冲液漂洗,1%锇酸后固定,丙酮梯度脱水,环氧树脂-618包埋。半薄切片(片厚1 μm)定位,超薄切片,饱和醋酸铀电子染色,置于电子显微镜下观察。通过观察海马组织突触超微结构研究GA改善雄黄致学习记忆损伤的机制。每只小鼠观察2张铜网,每张铜网随机拍摄5张图片,采用Image-pro plus 6.0图像分析系统对突触间隙宽度、突触活性带长度、突触后致密物(post synaptic density, PSD)厚度和突触界面曲率等突触结构参数进行测量分析。突触间隙宽度采用多点平均法测定。PSD厚度和突触活性带长度参照GULDNER等[9]的方法测量。突触界面曲率以突触界面弧长与弦长之比表示,参照JONES等[10]的方法测量。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组小鼠PI、运动速度、海马系数、GSH水平、突触间隙宽度、突触活性带长度、PSD厚度和突触界面曲率以x±s表示,对于符合正态分布且总体方差齐的数据组间比较采用单因素方差分析,不符合正态分布且总体方差不齐的数据组间比较采用Kruskal-wallis H检验,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠新物体PI和运动速度在实验阶段,对照组小鼠新物体PI为54.19%,略高于机会水平(50.00%)。与对照组比较,雄黄组小鼠新物体PI明显降低(P < 0.05),小鼠运动速度无明显变化(P>0.05);与雄黄组比较,GA干预组小鼠新物体PI虽有所升高,但差异无统计学意义(P>0.05),小鼠运动速度也无明显变化(P>0.05)。见表 1。
| (n=20, x±s) | ||
| Group | PI (η/%) | Velocity(m·s-1) |
| Control | 54.19±8.43 | 0.056±0.015 |
| Realgar | 41.65±12.01* | 0.060±0.017 |
| GA | 45.92±11.22 | 0.060±0.016 |
| * P < 0.05 vs control group. | ||
各组小鼠海马系数比较差异无统计学意义(P>0.05)。见表 2。与对照组比较,雄黄组小鼠海马组织中GSH水平明显降低(P < 0.05);与雄黄组比较,GA干预组小鼠海马组织中GSH水平明显升高(P < 0.01)。见表 2。
| (n=20, x±s) | ||
| Group | Hippocampal coefficient(η/%) | GSH [wB/(μmol·g-1)] |
| Control | 0.099±0.008 | 0.46±0.16 |
| Realgar | 0.098±0.008 | 0.24±0.07* |
| GA | 0.107±0.012 | 0.49±0.22△ |
| * P < 0.05 vs control group; △ P < 0.01 vs realgar group. | ||
对照组小鼠海马突触结构完整、清晰,突触前膜内突触小泡丰富,突触后致密带密度高;雄黄组小鼠突触结构模糊,突触前膜内突触小泡减少,突触后致密带密度降低;GA干预组小鼠突触结构较清晰、完整,突触前膜内突触小泡增多,分布较密集,突触后致密物密度较高。见图 1。
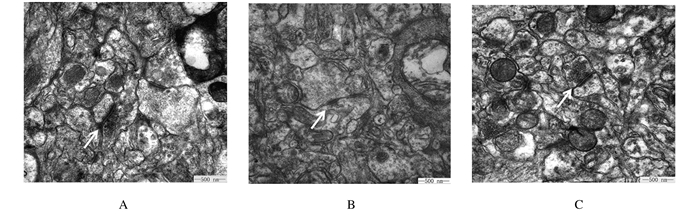
|
| A:Control group; B:Realgar group; C:GA group. White arrows indicated synapses. 图 1 透射电镜下各组小鼠海马CA1区突触的超微结构(Bar=500 nm) Fig. 1 Ultrastructures of synapses in hippocampal CA1 region of mice in various groupsunder transmission electron microscope (Bar= 500 nm) |
|
|
与对照组比较,雄黄组小鼠海马CA1区突触间隙宽度明显增加(P < 0.01),突触活性带长度变短(P < 0.01),PSD厚度明显变薄(P < 0.01), 突触界面曲率减小(P < 0.01)。与雄黄组比较,GA干预组小鼠海马CA1区突触间隙宽度变小(P < 0.05),突触活性带长度变大(P < 0.05),PSD厚度增加(P < 0.05);突触界面曲率虽有所增大,但差异无统计学意义(P>0.05)。见表 3。
| (n=20, x±s, l/nm) | ||||
| Group | Width of synaptic cleft | Length of active zone | Thickness of PSD | Synaptic interface curvature |
| Control | 20.69±2.72 | 390.22±72.74 | 81.82±12.72 | 1.05±0.02 |
| Realgar | 24.33±4.24* | 249.42±50.29* | 61.77±13.29* | 1.03±0.02* |
| GA | 20.41±3.12△ | 321.39±65.91△ | 73.54±14.52△ | 1.04±0.03 |
| * P < 0.01 vs control group; △ P < 0.05 vs realgar group. | ||||
突触是神经元与神经元之间进行信息传递的关键部位,突触形态的完整对于维持神经元的信息传递功能至关重要。突触形态异常可影响神经信息传递的有效性,导致学习记忆能力下降[11]。本研究结果显示:雄黄组小鼠海马突触结构模糊,突触前膜内突触小泡减少,突触后致密带密度降低。同时,本研究采用新事物识别实验检测小鼠的记忆能力和认知功能,结果显示:雄黄组小鼠记忆能力和认知功能受损。因此推测雄黄引起记忆能力和认知功能下降可能与突触形态异常改变有关。
突触的可塑性与学习记忆等高级神经活动密切关联,是学习记忆的生理学基础[12-13]。突触的可塑性表现为突触传递效能的改变和突触结构参数的变化,而突触结构参数是反映突触可塑性改变的敏感指标[14-15],主要表现为突触间隙宽度、突触活性带长度、PSD厚度和突触界面曲率的改变。突触间隙是突触前后膜之间的间隙,是两个神经元间进行信息传递的部位;突触间隙宽度增大,神经递质传递时间就会延长,信息传递速度降低。突触界面曲率是突触连接界面的弯曲度,突触界面曲率越大,保证递质准确定位到靶部位,提高突触信息传递效率[16]。突触活性带长度反映突触的接触面积,代表递质释放的有效面积[17]。PSD是神经递质受体、细胞骨架和信号分子等组成的特殊结构,是突触结构参数中较易发生改变的参数,其厚度的改变可反映突触功能的改变[18]。本研究结果显示:雄黄组小鼠海马突触间隙宽度明显增加,PSD厚度明显变薄,突触活性带长度变短,突触界面曲率减小,表明雄黄可降低突触信息传递的有效性,导致学习记忆能力下降。本研究同时还测定了海马组织中GSH水平,雄黄组GSH水平明显降低,而GSH是脑内主要的抗氧化剂,提示氧化应激损伤可能是导致突触结构发生改变的原因,具体机制有待于进一步探讨。
GA是甘草酸及其盐(甘草甜素)经胃酸分解后的产物,是甘草发挥药效的主要成分。有研究[19]显示:GA能通过血脑屏障进入脑组织中,缓解脑缺血再灌注损伤引起的GSH及自由基清除酶的降低;体外研究[20]显示:GA能保护PC12细胞免受谷氨酸兴奋性毒性。本研究结果显示:GA能提高海马组织中GSH水平,改善海马组织超微结构的变化,同时突触结构参数中PSD厚度增加,突触活性带长度变长,突触间隙宽度变窄,提示GA能改善突触结构参数的异常变化。新事物识别实验结果显示:GA干预后,小鼠记忆能力及认知功能虽有所提高,但与雄黄组比较差异无统计学意义,推测可能是因为突触可塑性改变除了与突触结构参数改变有关之外,还取决于突触传递效能的变化;而GA虽然能改善突触结构部分参数的变化,但可能对突触传递的效能影响不大,具体机制有待于进一步研究。此外,GA干预组小鼠海马突触界面曲率与雄黄组比较变化不明显,但有增大趋势,这可能与GA的靶向作用有关。
综上所述,雄黄可致小鼠海马突触结构参数改变,导致记忆能力和认知功能降低,GA能改善小鼠海马突触超微结构的病理改变,有助于提高小鼠认知功能。
| [1] | WANG Y, CHEN M, ZHANG Y, et al. Effects of realgar on GSH synthesis in the mouse hippocampus:Involvement of system XAG(-), system XC(-), MRP-1 and Nrf2[J]. Toxicol Appl Pharmacol, 2016, 308: 91–101. DOI:10.1016/j.taap.2016.07.006 |
| [2] | HUO TG, LI W K, ZHANG Y H, et al. Excitotoxicity induced by realgar in the rat hippocampus:the involvement of learning memory injury, dysfunction of glutamate metabolism and NMDA receptors[J]. Mol Neurobiol, 2015, 51(3): 980–994. DOI:10.1007/s12035-014-8753-2 |
| [3] | 董菊, 项馨立, 王子妤, 等. 牛黄解毒片配伍对雄黄肝毒性的影响及其与凋亡调控的关系[J]. 中国实验方剂学杂志, 2015, 21(24): 79–83. |
| [4] | XU C L, LIANG C H, SUN W X, et al. Glycyrrhizic acid ameliorates myocardial ischemic injury by the regulation of inflammation and oxidative state[J]. Drug Des Devel Ther, 2018, 12: 1311–1319. DOI:10.2147/DDDT |
| [5] | 尤丽丽, 曹东慧, 姜晶, 等. 18β-甘草次酸对K19-C2mE转基因鼠胃肿瘤的抑制作用及其机制[J]. 吉林大学学报:医学版, 2016, 42(2): 221–225. |
| [6] | 姜泓, 丁敬华, 张颖花, 等. 雄黄水飞法炮制工艺探讨[J]. 中药材, 2009, 32(1): 26–28. DOI:10.3321/j.issn:1001-4454.2009.01.009 |
| [7] | HEYSER C J, FERRIS J S. Object exploration in the developing rat:Methodological considerations[J]. Dev Psychobiol, 2013, 55(4): 373–381. DOI:10.1002/dev.v55.4 |
| [8] | ZHANG W B, LI P L, GENG Q Q, et al. Simultaneous determination of glutathione, cysteine, homocys-teine, and cysteinylglycine in biological fluids by ion-pairing high-performance liquid chromatography coupled with precolumn derivatization[J]. J Agric Food Chem, 2014, 62(25): 5845–5852. DOI:10.1021/jf5014007 |
| [9] | GULDNER FH, INGHAM CA. Increase in postsynaptic density material in optic target neurons of the rat suprachiasmatic nucleus after bilateral enucleation[J]. Neurosci Lett, 1980, 17(1/2): 27–31. |
| [10] | JONES DG, DEVON RM. An ultrastructural study into the effects of pentobarbitone on synaptic organization[J]. Brain Res, 1978, 147(1): 47–63. |
| [11] | EAVRI R, SHEPHERD J, WELSH CA, et al. Interneuron simplification and loss of structural plasticity as markers of aging-related functional decline[J]. J Neurosci, 2018, 38(39): 8421–8432. DOI:10.1523/JNEUROSCI.0808-18.2018 |
| [12] | PALACIOS-FILARDO J, MELLOR JR. Neuromodulation of hippocampal long-term synaptic plasticity[J]. Curr Opin Neurobiol, 2018, 54: 37–43. DOI:10.1016/j.ceb.2018.04.010 |
| [13] | 安思训, 陈晓丽, 何欣, 等. 多烯磷脂对青年鼠海马CA3区神经元突触可塑性的影响[J]. 吉林大学学报:医学版, 2009, 35(3): 419–422. |
| [14] | 张璇, 蔺俊斌, 王娟, 等. "形神共养"对脑缺血再灌注大鼠功能恢复和突触形态结构参数的影响[J]. 中国康复医学杂志, 2015, 30(11): 1105–1111. DOI:10.3969/j.issn.1001-1242.2015.11.004 |
| [15] | 吴敏霞, 曾育琦, 林旭云, 等. APP/PS1转基因AD鼠海马CA1区神经元突触超微结构[J]. 解剖学杂志, 2017, 40(4): 437–439. DOI:10.3969/j.issn.1001-1633.2017.04.017 |
| [16] | 吴馥梅, 杜红燕, 章子贵. 突触界面曲率及其生理意义[J]. 神经解剖学杂志, 1994, 10(1): 89–92. |
| [17] | LIU H Y, YANG J H, LIU Q F, et al. Lanthanum chloride impairs spatial memory through ERK/MSK1 signaling pathway of hippocampus in rats[J]. Neurochem Res, 2014, 39(12): 2479–2491. DOI:10.1007/s11064-014-1452-6 |
| [18] | ZHANG Z G, WANG X Y, NIAN W W, et al. Effects of calcium on drinking fluorosis-induced hippocampal synaptic plasticity impairment in the offspring of rats[J]. Transl Neurosci, 2017, 8: 191–200. |
| [19] | OZTANIR M N, CIFTCI O, CETIN A, et al. The beneficial effects of 18β-glycyrrhetinic acid following oxidative and neuronal damage in brain tissue caused by global cerebral ischemia/reperfusion in a C57BL/J6 mouse model[J]. Neurol Sci, 2014, 35(8): 1221–1228. DOI:10.1007/s10072-014-1685-9 |
| [20] | WANG D, GUO T Q, WANG Z Y, et al. ERKs and mitochondria-related pathways are essential for glycyrrhizic acid-mediated neuroprotection against glutamate-induced toxicity in differentiated PC12 cells[J]. Braz J Med Biol Res, 2014, 47(9): 773–779. DOI:10.1590/1414-431X20143760 |
 2019, Vol. 45
2019, Vol. 45


