扩展功能
文章信息
- 王学敏, 邓淑蓉, 彭玲玲, 潘茂华, 潘宇政
- WANG Xuemin, DENG Shurong, PENG Lingling, PAN Maohua, PAN Yuzheng
- 气管切开插管大鼠肺部形态学和肥大细胞活性的动态变化及其意义
- Dynamic changes of pulmonary morphology and mast cell activity in rats after tracheotomy and intubation and their significances
- 吉林大学学报(医学版), 2019, 45(02): 262-267
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 262-267
- 10.13481/j.1671-587x.20190209
-
文章历史
- 收稿日期: 2018-05-30
2. 广西壮族自治区上林县人民医院外科, 广西 上林 530500
2. Department of Surgery, People's Hospital of Shanglin County, Guangxi Zhuang Autonomous Region, Shanglin 530500, China
气管切开留置气管套管建立人工气道是昏迷等危急重症患者的重要抢救措施[1]。气管切开建立人工气道时,呼吸系统失去了喉以上呼吸道的加温加湿及机械屏障等功能,下呼吸道的理化环境随之发生改变,肺部的防御等功能亦会有所变化[2]。肥大细胞主要分布于呼吸道黏膜和皮肤等处,是机体的天然哨兵之一,肥大细胞除了释放生物活性物质外,还参与了肺部免疫功能的调节[3]。根据肥大细胞这一功能特点,本文作者推测气管切开后肺部肥大细胞的功能会发生改变。本实验从肺组织病理检查、肺部肥大细胞脱颗粒及其释放的活性物质,即类胰蛋白酶β、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、组胺、白细胞介素6(interleukin-6, IL-6)等检测,动态观察气管切开留置气管套管大鼠肺部肥大细胞活性的变化及其与肺部炎症的关系,阐明气管切开插管大鼠肺部炎症发生的机制。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器健康SPF级健康SD雄性成年大鼠,体质量(150±30)g,由广西科大学实验动物中心提供, 动物合格证号:SCXK (桂)2014-0002。TNF-αELISA试剂盒(批号:CSB-E11987r)和IL-6 ELISA试剂盒(批号:CSB-E04640r)(成都华美生物医药有限公司),组胺ELISA试剂盒(武汉伊莱瑞特生物科技有限公司,批号:E-EL-0032c),肥大细胞类胰蛋白酶β试剂盒(TPSB,上海江莱生物科技有限公司,批号:bs2726R)。大鼠脑立体定向仪(宁波东南仪器有限公司),酶标仪(美国Bio-Rad公司),高速低温离心机(德国HETTICH公司),正置光学显微镜(日本Olympus公司)。
1.2 实验动物分组和模型建立按随机数字表法,将大鼠分为正常对照组和气管切开插管组, 每组24只。每组根据造模后不同时间点分为4个亚组,即造模后24、48、72和168h组,每个亚组6只大鼠。大鼠自由进水,普通饲料喂养。气管切开插管组大鼠采用一次性硬膜外麻醉导管制作气管切开插管留置大鼠模型[4]。大鼠称体质量,阿托品0.02mg·kg-1肌肉注射麻醉前给药,30min后2%~3%戊巴比妥钠30mg·kg-1腹腔注射麻醉。暴露白色气管,做一个“V字型”切口,将导管送入气管中,切口外留置导管长度18~23cm,固定气管插管缝合消毒。模型成功标志:导管内有呼吸所致蒸气贴壁;将刀柄置于外口,刀柄上出现气雾;将棉花或者发丝置于两组导管外口,可见其随呼吸飘动[5]。造模成功后大鼠仍置于SPF级环境中饲养。
1.3 取材和指标检测在造模后24、48、72和168 h4个时间点处死大鼠后结扎右主支气管,取左支气管肺泡灌洗液,用4℃预冷的灭菌生理盐水3 mL灌洗,反复灌洗3次,回收约2mL, 共回收6mL, 于4℃、转速1500r·min-1离心10 min,取上清分装于-80℃保存,用于检测组胺、TNF-α和IL-6水平。无菌分离右肺,用新双面刀片切取2~3 mm3样品,迅速投入4℃固定液中固定15 min,再将组织切成1 mm×1 mm×1 mm小块,放入4℃固定液中固定,用于透射电镜观察肥大细胞。余下右肺用4%多聚甲醛固定液固定,行石蜡包埋、切片,用于光镜观察肺组织形态及类胰蛋白酶β表达。
1.4 光镜观察大鼠肺组织病理表现取肺组织病理切片行苏木精-伊红染色(HE染色),利用显微镜观察肺组织病理学改变,采用Smith评分方法[6]对肺水肿、肺泡与间质炎症、肺泡与间质出血、肺不张和透明膜形成分别进行0~4分的半定量分析:无损伤0分,病变范围 < 25%为1分,病变范围占25%~50%为2分,50% < 病变范围 < 75%为3分,病变满视野为4分,总肺损伤评分为上述各项之和。每只大鼠观察10个高倍视野,取其平均值。
1.5 透射电镜观察大鼠肥大细胞超微结构待检肺组织投入4%戊二醛固定2 h,1%锇酸固定后1 h,包埋,超薄切片,双重染色,透射电镜(H-7650)观察肥大细胞的超微结构及脱颗粒情况。
1.6 大鼠肺泡灌洗液中组胺水平测定采用竞争ELISA法,按试剂盒说明书操作。加样,即每孔加入生物素抗体工作液,37℃温育→洗板→加辣根过氧化物酶标记亲和素工作液,37℃孵育→洗板→加底物溶液,37℃避光显色→加终止溶液,终止反应→450 nm波长处测光密度(A)值。采用Curve Exert 1.4软件,输入标准浓度和各样本的A值,绘制标准曲线,得到样本的实际表达水平。
1.7 大鼠肺泡灌洗液中TNF-α和IL-6水平测定采用双抗体夹心ELISA法,按试剂盒说明书操作。加样后37℃温育→加生物素标记抗体工作液,37℃温育,余步骤同1.6组胺水平检测。
1.8 大鼠肺组织肥大细胞中类胰蛋白酶β表达采用免疫组织化学SP染色法检测肥大细胞中类胰蛋白酶β表达。以胞浆显棕黄色为阳性细胞,于每张切片中在400倍光镜下随机选取4个支气管黏膜部位进行观察,通过显微摄像系统将选取的视野使用Image-Pro Plus软件对类胰蛋白酶β染色阳性细胞进行分析,并测定吸光度(A)值,根据A值计算积分(M)值, 以M值表示其表达水平。M=阳性表达平均A值×阳性目标总面积×100%。
1.9 统计学分析采用SPSS 17.00统计软件进行统计学分析。2组大鼠肺组织Smith评分、肺泡灌洗液中组胺、TNF-α及IL-6水平和肥大细胞中类胰蛋白酶β表达水平均符合正态分布,以x±s表示,多组间比较釆用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组大鼠肺组织病理学表现光镜下正常对照组大鼠肺组织结构完整,肺泡间隔均匀一致,肺泡腔清晰,肺泡壁光滑;气管切开插管组大鼠可见肺间质及肺泡内出血,炎症细胞浸润,肺泡间隔增宽,且随着时间延长损伤不断加重。见图 1(插页三)。Smith评分:气管切开插管组大鼠肺组织各时间点均有不同程度的水肿和出血等,Smith评分均高于正常对照组(P < 0.05);气管切开插管组内不同时间点比较,随着时间延长大鼠肺组织损伤加重,Smith评分升高(P < 0.05)。见表 1。
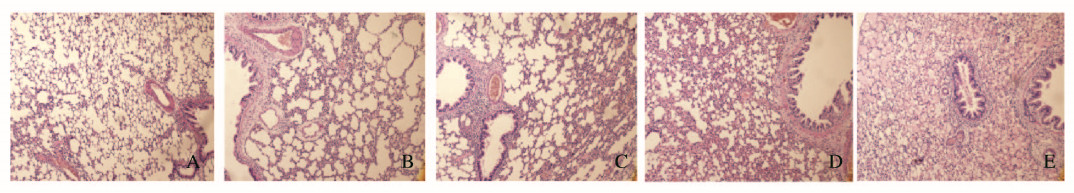
|
| A:Normal control group; B-E:Tracheotomy and intubation group(24, 48, 72, and 168 h). 图 1 光镜观察2组大鼠肺组织病理学表现(HE, ×200) Fig. 1 Pathology of lung tissue of rats in two groups observed by light microscope(HE, ×200) |
|
|
| (n=6, x±s) | |||||
| Group | Smith score | ||||
| (t/h) | 24 | 48 | 72 | 168 | |
| Normal control | 0.2±0.7 | 0.2±0.9 | 0.3±0.5 | 0.2±0.6 | |
| Tracheotomy and intubation | 4.0±0.9* | 4.8±0.6*△ | 9.2±0.5*△#○ | 11.6±2.5*△#○ | |
| * P < 0.05 compared with normal control group;△ P < 0.05 compared with 24 h;# P < 0.05 compared with 48 h; ○ P < 0.05 compared with 72 h. | |||||
正常对照组大鼠肥大细胞胞浆内含有大量颗粒;气管切开插管组大鼠各时间点肺组织肥大细胞出现不同程度的颗粒减少,且颗粒胞膜融合而成空泡,其中以24h时肥大细胞脱颗粒最明显,随时间延长,肥大细胞脱颗粒逐渐增多。见图 2。

|
| A:Normal control group; B-E:Tracheotomy and intubation group(24, 48, 72, and 168h). 图 2 电镜下观察2组大鼠肺组织肥大细胞脱颗粒情况(×10000) Fig. 2 Degranulation of lung mast cells of rats in two groups under electron microscope (×10000) |
|
|
正常对照组大鼠肺泡灌洗液中组胺水平偏低。与正常对照组比较,气管切开插管组大鼠肺泡灌洗液中组胺水平在24、72和168h3个时间点明显升高(P < 0.05),在48h时组胺水平与正常对照组比较差异无统计学意义(P>0.05)。气管切开插管组大鼠肺泡灌洗液中组胺水平24h时即明显升高,48h时降低(P < 0.05),此后随时间逐渐延长,在72和168h时明显升高(P < 0.05)。见表 2。
| [n=6, x±s, ρB/(μg·L-1)] | |||||
| Group | Level of histamine | ||||
| (t/h) | 24 | 48 | 72 | 168 | |
| Normal control | 14.69±2.53 | 12.41±1.92 | 13.40±3.05 | 10.63±2.67 | |
| Tracheotomy and intubation | 27.70±10.60* | 13.74±4.40△ | 22.85±5.67*# | 23.46±12.4*# | |
| * P < 0.05 compared with normal control group;△ P < 0.05 compared with 24 h;# P < 0.05 compared with 48 h. | |||||
与正常对照组比较,气管切开插管组大鼠肺泡灌洗液中TNF-α水平在4个不同时间点均明显升高(P < 0.05)。气管切开插管组大鼠肺泡灌洗液中TNF-α水平在24 h时达峰值,随后逐渐下降(P < 0.05),168 h时又升高(P < 0.05)。见表 3。
| [n=6, x±s, ρB/(ng·L-1)] | |||||
| Group | Level of TNF-α | ||||
| (t/h) | 24 | 48 | 72 | 168 | |
| Normal control | 45.25±10.03 | 42.41±11.90 | 43.81±8.06 | 40.33±12.61 | |
| Tracheotomy and intubation | 1 960.92±104.99* | 486.66±21.24*△ | 228.67±19.13*△# | 321.67±28.68*△#○ | |
| * P < 0.05 compared with normal control group;△ P < 0.05 compared with 24 h;# P < 0.05 compared with 48 h; ○ P < 0.05 compared with 72 h. | |||||
与正常对照组比较,气管切开插管组肺泡灌洗液中IL-6水平在不同时间点均明显升高(P < 0.05),24h时即达到峰值,随后逐渐下降(P < 0.05),在168h时稍有升高(P < 0.05)。见表 4。
| [n=6, x±s, ρB/(μg·L-1)] | |||||
| Group | Level of IL-6 | ||||
| (t/h) | 24 | 48 | 72 | 168 | |
| Normal control | 9.51±1.31 | 8.32±1.94 | 9.33±3.02 | 9.30±2.16 | |
| Tracheotomy and intubation | 290.31±12.45* | 27.16±10.57*△ | 23.72±10.24*△# | 41.52±6.63*△#○ | |
| * P < 0.05 compared with normal control group;△ P < 0.05 compared with 24 h;# P < 0.05 compared with 48 h; ○ P < 0.05 compared with 72 h. | |||||
免疫组织化学法检测结果显示:正常对照组大鼠肥大细胞中类胰蛋白酶β有少量表达。气管切开插管组大鼠肥大细胞中类胰蛋白酶β表达水平在4个时间点均明显升高(P < 0.05)。正常对照组大鼠各时间点肥大细胞中类胰蛋白酶β表达水平比较差异无统计学意义(P>0.05);气管切开插管组大鼠肥大细胞中类胰蛋白酶β表达水平最初随时间延长逐渐升高,72h时达到高峰(P < 0.05),在168h时明显降低(P < 0.05)。见图 3(插页三)和表 5。
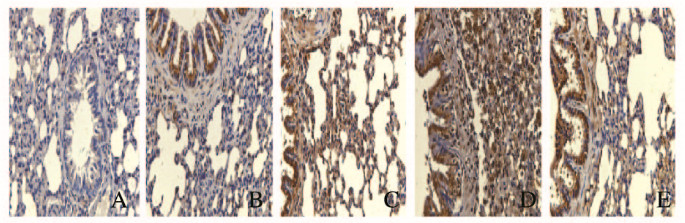
|
| A:Normal control group; B-E:Tracheotomy and intubation group(24, 48, 72, and 168 h). 图 3 2组大鼠肺肥大细胞中类胰蛋白酶β的表达(免疫组织化学,×40) Fig. 3 Expressions of trypsin-β in lung mast cells of rats in two groups (Immunohistochemistry, ×40) |
|
|
| (n=6, x±s, η/%) | |||||
| Group | Expression level of tryptase-βin mast cells | ||||
| (t/h) | 24 | 48 | 72 | 168 | |
| Normal control | 13.0±2.7 | 12.0±1.9 | 13.0±3.0 | 12.0±2.6 | |
| Tracheotomy and intubation | 21.0±2.5* | 28.0±4.0* | 35.0±2.9*△# | 25.0±3.0*△#○ | |
| * P < 0.05 compared with normal control group;△ P < 0.05 compared with 24h;# P < 0.05 compared with48h; ○ P < 0.05 compared with 72 h. | |||||
肥大细胞是一群极端异质性的细胞群,肺部是其主要栖息地之一[7]。肥大细胞主要分布在肺部的气管黏膜、血管及其周围,具有哨兵作用[8]。肥大细胞的功能主要表现在两方面,一是合成和分泌类胰蛋白酶、组胺、TNF-α及IL-6等生物活性物质并参与炎症等一系列反应[9];二是通过吞噬作用及炎症反应参与肺部的免疫防御调节[3]。
本实验对气管切开插管大鼠肺组织病理、肥大细胞脱颗粒及其活性物质的释放进行了动态观察。类胰蛋白酶β属于肥大细胞和嗜碱性粒细胞的特异性活性物质,参与许多炎症反应[10-11]。本研究中大鼠肺组织病理变化检测显示:气管切开后大鼠肺组织即发生炎症改变,同时肥大细胞开始出现脱颗粒,类胰蛋白酶β表达明显增加,支气管肺泡灌洗液中肥大细胞释放的其他活性物质组胺、TNF-α和IL-6水平也随之升高,其水平在24 h时达峰值此后逐步下降。本实验结果提示:大鼠气管切开后早期肺部即产生炎症,且一直持续存在,肥大细胞活性也随着肺部炎症出现而发生改变,表现为活性增强、脱颗粒等现象。肥大细胞活性增强、脱颗粒可能是主导气管切开后炎症发生发展的主要机制。
促使肥大细胞激活的物质很多,常见的有细菌、病毒、毒素和药物等。近期研究者[12-13]发现:机械损伤、物理刺激等亦可激活肥大细胞。本实验中气管切开是大鼠肺部肥大细胞激活的因素,本文作者认为早期肥大细胞激活主要为气管切开损伤本身及气道开放后失去了上呼吸道加温、加湿和机械屏障及其肺部理化环境发生改变所导致。杨红晖等[14]通过观察471例全麻气管插管患者肺部感染情况发现:气管插管24h时肺部感染率仅为5.38%,24 h后达到41.67%,随着时间延长感染发生率升高。这些临床资料从另一方面表明气管切开早期肥大细胞激活并非细菌和病毒等因素引起,而是因为损伤本身及肺部理化环境的改变所致。
气管切开早期肥大细胞活性增强、脱颗粒,对肺部的防御功能产生很多有利影响:一是肥大细胞可以直接黏附吞噬细菌[15],二是产生炎症反应以防止细菌定植并清除细菌[16-17]。但随着时间延长,炎症本身可导致呼吸道黏膜上皮细胞功能缺损及血运障碍,β-防御素等天然抗菌物质分泌减少,导致肺部免疫防御功能下降,反而有利于细菌定植并发生感染。吴歆等[18]报道:气管切开插管留置患者β-防御素-2水平降低。临床资料[19-20]也显示:气管切开早期不易并发肺部感染,但随着时间延长,肺部感染率呈直线上升。
综上所述,本文作者认为气管切开早期适当应用抑制肥大细胞活性的药物,对预防肺部感染的发生可能会有益处。
| [1] | BROWNE G A. Quick response tracheotomy:A novel surgical procedure[J]. Intensive Care Med, 2016, 31(4): 276–284. DOI:10.1177/0885066615627141 |
| [2] | OREADI D, CARLSON E R. Morbidity and mortality associated with tracheotomy procedure in a university medical centre[J]. Int J Oral Maxillofac Surg, 2012, 41(8): 974–977. DOI:10.1016/j.ijom.2012.03.022 |
| [3] | EBERT S, BECKER M, LEMMERMANN N A, et al. Mast cells expedite control of pulmonary murine cytomegalovirus infection by enhancing the recruitment of protective CD8 T cells to the lungs[J]. PLoS Pathog, 2014, 10(4): 1–16. |
| [4] | 朱翠香, 彭玲玲, 张冉令, 等. 一次性硬膜外麻醉导管气管切开插管留置大鼠模型建立[J]. 中华实验外科杂志, 2015, 32(10): 2480. DOI:10.3760/cma.j.issn.1001-9030.2015.10.052 |
| [5] | 卢记明, 张炳熙. 大鼠气管插管方法学概述[J]. 中国比较医学杂志, 2009, 19(8): 76–80. DOI:10.3969/j.issn.1671-7856.2009.08.021 |
| [6] | SMITH K M, MROZEK J D, SIMONTON S C, et al. Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques:gas exchange and lung pathology in an animal model of respiratory distress syndrome[J]. Crit Care Med, 1997, 25(11): 1888–1897. DOI:10.1097/00003246-199711000-00030 |
| [7] | 徐南辉, 王滔, 张伟玉, 等. 肥大细胞脱颗粒肽调控肥大细胞脱颗粒的实验研究[J]. 福建医药杂志, 2017, 39(6): 149–152. |
| [8] | DAHAL B K, KOSANOVIC D, KAULEN C, et al. Involvement of mast cells in monocrotaline-induced pulmonary hypertension in rats[J]. Respir Res, 2011, 2(12): 60–66. |
| [9] | KRYSTEL-WHITTEMORE M, DILEEPAN K N, Wood J G. Mast cell:A multi-functional master cell[J]. Front Immunol, 2015, 6: 620. |
| [10] | 黄玉萨, 谢家骏, 胡风丽. 类胰蛋白酶在过敏性疾病诊断中的研究进展[J]. 中成药, 2016, 38(6): 1355–1359. |
| [11] | QIAN N, LI X B, WANG X H, et al. Tryptase promotes breast cancer angiogenesis through PAR-2 mediated endothelial progenitor cell activation[J]. Oncol Lett, 2018, 16(2): 1513–1520. |
| [11] | CHENG K, SHEN X Y, DING G H, et al. Relationship between laser acupuncture analgesia and the function of mast cells[J]. Zhongguo Zhen Jiu, 2009, 29(6): 478–483. |
| [12] | AGIER J, ROZALSK S, WIKTORSKA M, et al. The RLR/NLR expression and pro-inflammatory activity of tissue mast cells are regulated by cathelicidin LL-37 and defensin hBD-2[J]. Sci Rep, 2018, 8(1): 11750. DOI:10.1038/s41598-018-30289-w |
| [13] | Gilfillan A M, Rivera J. The tyrosine kinase network regulating mast cell activation[J]. Immunol Rev, 2009, 228(1): 149–169. |
| [14] | 杨红晖, 姚小红, 黄秀良, 等. 全麻气管插管术后患者肺部感染的调查分析[J]. 中华医院感染学杂志, 2009, 19(21): 2868–2869. DOI:10.3321/j.issn:1005-4529.2009.21.020 |
| [15] | BREITLING S, HUI Z, ZABINI D, et al. The mast cell-B cell axis in lung vascular remodeling and pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 312(5): L710–L721. DOI:10.1152/ajplung.00311.2016 |
| [16] | OZDEMIR O. The role of mast cell density in tumor-associated angiogenesis and survival of squamous cell carcinoma of the lung[J]. J Cancer Res Ther, 2015, 11(4): 1041. |
| [17] | 邓淑蓉, 潘宇政, 彭玲玲, 等. 淫羊藿苷对气管切开插管大鼠肺部肥大细胞活性及炎性反应的影响[J]. 中华中医药杂志, 2018, 33(4): 1594–1597. |
| [18] | 吴歆, 冯伟. 气管插管和气管切开术后并发肺部感染的相关因素分析[J]. 医学文选, 2003, 22(5): 628–630. DOI:10.3969/j.issn.1673-6575.2003.05.006 |
| [19] | 钟景灿, 李成林, 林锦才. 早期气管切开对预防重症颅脑损伤患者术后肺部感染的影响分析[J]. 齐齐哈尔医学院学报, 2017, 38(4): 437–439. |
| [20] | 南琼, 高玉松, 王凤仙, 等. 重型颅脑损伤早期气管切开术后发生肺部感染相关因素分析[J]. 中国临床神经外科杂志, 2018, 23(7): 490–491. |
 2019, Vol. 45
2019, Vol. 45


