扩展功能
文章信息
- 王馨梦, 李启阳, 刘超, 肖建英
- WANG Xinmeng, LI Qiyang, LIU Chao, XIAO Jianying
- 微球蛋白1对胃癌细胞侵袭和迁移的影响及其机制
- Effects of microspherule protein 1 on invasion and migration of gastric cancer cells and their mechanisms
- 吉林大学学报(医学版), 2019, 45(02): 251-257
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 251-257
- 10.13481/j.1671-587x.20190207
-
文章历史
- 收稿日期: 2018-07-16
2. 锦州医科大学基础医学院发育生物学教研室, 辽宁 锦州 121001
2. Department of Developmental Biology, School of Basic Medical Sciences, Jinzhou Medical University, Jinzhou 121001, China
胃癌是目前最常见的消化道恶性肿瘤之一,严重威胁着人类健康。临床上很多胃癌患者在手术切除前便已有转移,是导致术后转移和复发的直接原因。探讨与胃癌转移相关的因素,了解其转移机制并加以干预是治疗胃癌的有效途径[1]。上皮-间质转化(epithelial-mesenchymal transition,EMT)在多种癌细胞的侵袭和迁移中扮演着重要角色[2]。EMT标志物主要有上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)以及转录因子Snail。当肿瘤细胞侵袭、迁移能力增强时,E-cadherin表达水平降低,N-cadherin和Snail表达水平升高[3]。
微球蛋白1(microspherule protein 1, MCRS1)也称为MSP58(58000 microspherule protein),既往研究[4-7]显示:MCRS1在乳腺癌、肠癌和食管癌组织及细胞中高表达,在结直肠癌中其表达水平明显高于正常癌旁组织[8]。敲低MCRS1可明显抑制胃癌MGC803细胞和BGC823细胞的增殖,MCRS1对胃癌细胞的增殖具有促进作用[9],在众多癌细胞中MCRS1被认为是癌基因[10-11]。但最新研究[12]显示:MCRS1蛋白通过抑制端粒酶活性,从而抑制胃癌患者的淋巴转移。由此可见,MCRS1具有促癌和抑癌的双重特质。基于MCRS1在肿瘤中的特殊双重作用,为探讨其在胃癌发生发展中的作用,本实验通过检测MCRS1在胃癌细胞中的表达情况,选取低表达的细胞株进行上调实验,探讨过表达MCRS1对胃癌细胞迁移和侵袭能力的影响及可能的作用机制。
1 材料与方法 1.1 细胞、主要试剂和仪器胃癌BGC-823细胞、SGC-7901细胞和正常胃黏膜上皮GES-1细胞(上海吉凯基因化学技术有限公司)。dNTP和感受态DH5α(TaKaRa公司,中国),Lipo 3000(Invitrogen公司,美国),MCRS1抗体(Abcam公司,美国),E-cadherin抗体、N-cadherin抗体、Snail抗体、β-actin抗体和HRP标记的山羊抗兔IgG(ABclonal公司,中国),BCA蛋白浓度测定试剂盒、细胞裂解液和ECL化学发光试剂(北京鼎国昌盛生物技术有限责任公司,中国),质粒小量提取试剂盒和胶回收试剂盒(爱思进生物技术有限公司,中国)。Matrigel基质胶和Transwell小室(BD公司,美国),PCR扩增仪(Mastercycler nexus X2, Eppendorf公司,德国),CO2培养箱(Heraeus公司,德国),凝胶自动成像仪(Uiltralum公司,美国),水浴式电转印槽、电泳仪和电泳槽(Bio-Rad公司,美国)。
1.2 重组质粒pcDNA3.1-myc-MCRS1的构建 1.2.1 人MCRS1全长序列的扩增根据人MCRS1(Genebank ID:NM_001012300)序列,设计特异性PCR引物,上游引物加Hind Ⅲ酶切位点,下游引物加XbaⅠ酶切位点和终止密码子。引物由中美泰和生物技术(北京)有限公司合成,引物序列如下:上游序列为5′-GGCGGAAGCTTCCACCATGGACAAAGATTCTCAGGGGC-3′,下游序列为5′-GGCGGTCTAGACTGTGGTGTGATCTTGGCAGCC-3′。PCR反应体系50 μL,反应条件:94℃、7 min;94℃、45 s,55℃、30 s,72℃、3 min,35个循环;72℃、10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后回收并纯化凝胶。
1.2.2 pcDNA3.1-myc-MCRS1重组质粒的构建和鉴定PCR纯化产物和pcDNA3.1载体先用Hind Ⅲ酶切,37℃孵育3 h,将酶切产物纯化后再用XbaⅠ酶切孵育3 h,胶回收纯化后用T4连接酶与pcDNA3.1连接,16℃恒温过夜。取1 μL连接产物转化到感受态细胞DH5α中,37℃、180 r·min-1振荡1 h。取50 μL菌液涂布于含有氨苄霉素的琼脂平板上,37℃倒置培养24 h。挑取单克隆后再摇菌过夜。采用质粒小量提取试剂盒提取质粒后用HindⅢ和XbaⅠ酶切鉴定,选择酶切片段大小与预期相符的阳性克隆,送至中美泰和生物技术(北京)有限公司进行检测,将结果完全正确的重组质粒扩增培养,去内毒素处理后分装,于-4℃条件下保存。
1.3 细胞培养与转染采用含有10%胎牛血清的RPMI-1640培养基(含有100 U·L-1青霉素和50 mg·L-1链霉素)培养人胃癌BGC-823细胞、胃癌SGC-7901细胞和人胃黏膜上皮GES-1细胞。培养条件为含5% CO2细胞培养箱,37℃培养。细胞达到约80%融合时进行传代。质粒转染参照Lipo3000转染试剂盒说明书进行。实验分为空白组(未做转染处理)、空载体转染组(转染pcDNA3.1空载体)和MCRS1转染组(转染pcDNA3.1-myc-MCRS1质粒),转染后培养48 h收集细胞,进行后续实验。
1.4 Western blotting法检测各组细胞中MCRS1蛋白表达和侵袭相关蛋白表达水平收集各组细胞,蛋白裂解液提取细胞总蛋白,进行8% ~ 12% SDS-PAGE电泳分离,将蛋白转移至PVDF膜上,用含1% BSA的TBST封闭2 h,分别与稀释后一抗(MCRS1抗体、E-cadherin抗体、N-cadherin抗体和Snail抗体)4℃孵育16~18 h。TBST洗膜3次后,采用HRP偶联的IgG二抗(稀释比1:2 000)室温温育1.5 h,摇床上洗膜3次后显影。采用Image J软件计算蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.5 细胞划痕实验检测胃癌细胞迁移能力将BGC-823细胞接种于6孔板,细胞转染后继续培养24 h,采用黄色枪头划痕,PBS清洗细胞3次,使用显微镜观察同一位置不同时间点(0、12、24、36和48 h)划痕宽度变化情况并拍照,采用Image J测量3组细胞划痕面积,并计算迁移率,以12 h细胞迁移率计算为例,迁移率=(0 h划痕面积-12 h划痕面积)/ 0 h划痕面积×100%。
1.6 Transwell实验检测胃癌细胞迁移和侵袭能力将100 μL稀释好的Martrigel基质胶均匀铺于Transwell小室底部,37℃培养箱中放置1 h, 取出后吸取上层液体并弃去(铺胶检测细胞侵袭能力,不铺胶检测细胞迁移能力)。接种5 ×104个细胞于Trans签拭去小室上层细胞,PBS缓冲液清洗小室上层3次,自然风干后向小室下腔加入600 μL多聚甲醛固定液,固定10 min后,用PBS缓冲液清洗小室下腔2次。向小室下腔加入600 μL结晶紫染液,染色10 min,用PBS洗3次,洗净结晶紫。将小室置于200倍光学显微镜下观察并随机选取5个视野计算细胞总数,取平均值作为该次实验结果。
1.7 统计学分析采用Graphpad prism 7统计软件进行统计学分析。各组细胞中蛋白表达水平、细胞迁移率、细胞迁移数量和细胞侵袭数量以x±s表示,组间比较采用方差分析方法。以P < 0.05为差异有统计学意义。
2 结果 2.1 MCRS1重组质粒鉴定设计特异MCRS1引物,通过PCR扩增出目的条带,目的基因为1785 bp(图 1A)。将胶回收后的目的基因与pcDNA3.1载体连接,构建pcDNA3.1-myc-MCRS1质粒。酶切鉴定重组质粒pcDNA3.1-myc-MCRS1,得到与PCR扩增产物大小一致的片段(图 1B)。
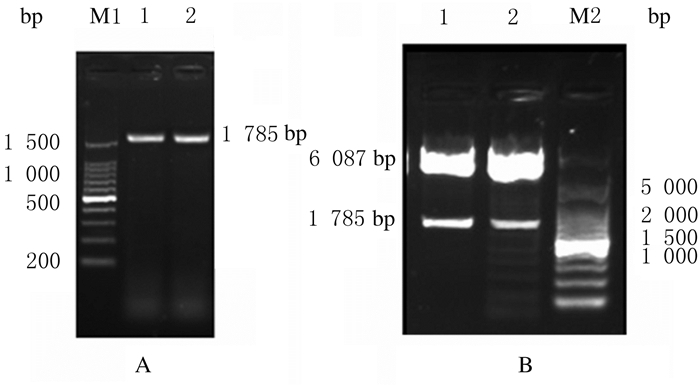
|
| A:Construction; M1:1500 bp Marker; Lane 1, 2:MCRS1.B:Identification; Lane 1, 2:pcDNA3.1-myc-MCRS1;M2:5000 bp Marker. 图 1 pcDNA3.1-myc-MCRS1质粒构建和鉴定电泳图 Fig. 1 Electrophoregram of construction and identification of pcDNA3.1-myc-MCRS1 plasmid |
|
|
MCRS1蛋白在BGC-823细胞中表达水平最低,为0.680±0.003;其次是在GES-1细胞,为0.826±0.005;在SGC-7901细胞中表达水平最高,为1.446±0.006。见图 2。因此,选择MCRS1本体表达水平低的胃癌BGC-823细胞进行后续转染实验。
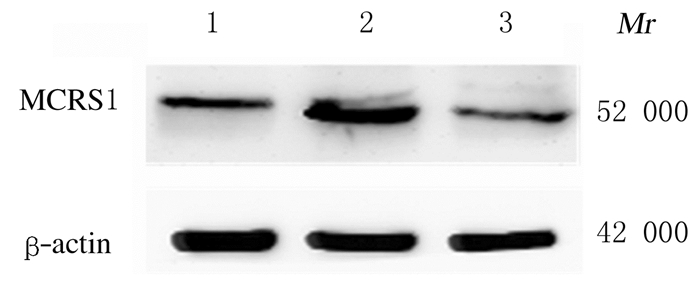
|
| Lane 1:GES-1 cells; Lane 2:SGC-7901 cells; Lane 3:BGC-823 cells. 图 2 Western blotting法检测MCRS1蛋白在GES-1、SGC-7901和BGC-823细胞中表达电泳图 Fig. 2 Electrophoregram of expressions of MCRS1 protein in GES-1, SGC-7901 and BGC-823 cells detected by Western blotting method |
|
|
细胞划痕实验中,BGC-823细胞转染MCRS1后12、24、36和48 h,MCRS1转染组细胞迁移数量少于空白组和空载体转染组(图 3),划痕相对距离较远,迁移率低于空白组和空载转染组(P < 0.01)。见图 4。

|
| 图 3 各组胃癌细胞BGC-823的迁移情况 Fig. 3 Migration of gastric cancer BGC-823 cells in various groups |
|
|
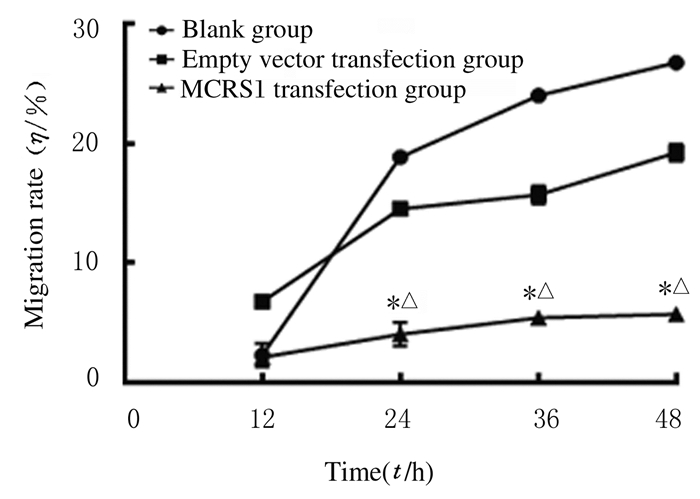
|
| *P < 0.01 compared with blank group; △P < 0.01 compared with empty vector transfection group. 图 4 各组胃癌BGC-823细胞的迁移率 Fig. 4 Migration rates of gastric cancer BGC-823 cells in various groups |
|
|
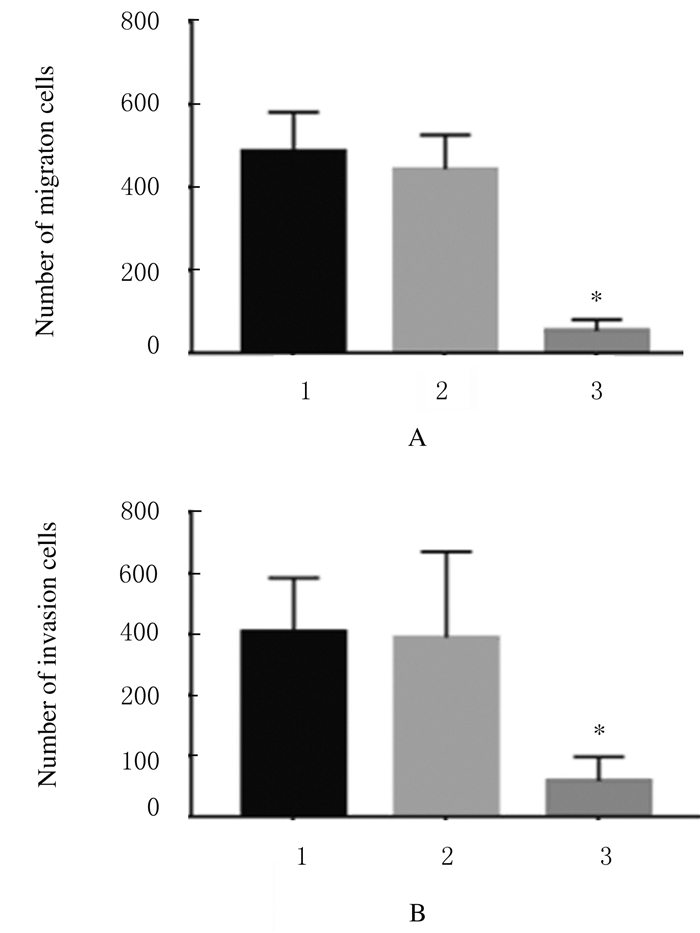
Transwell小室实验中,BGC-823细胞转染pcDNA 3.1-myc-MCRS1 24 h后,MCRS1转染组细胞穿过小室数量明显少于空白组和空载体转染组(P < 0.01),细胞迁移数量和侵袭数量远低于空白组和空载体转染组(P < 0.01)。见图 5(插页三)和6。
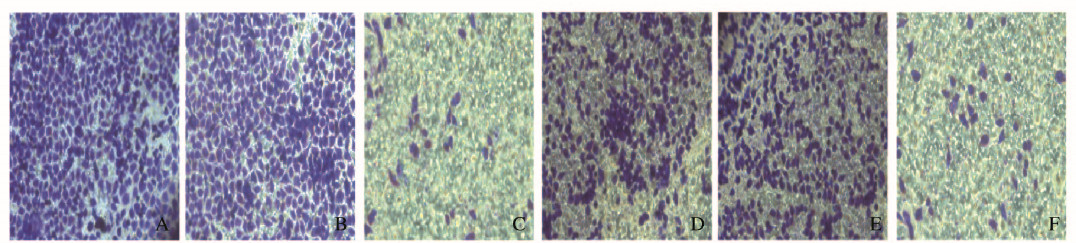
|
| A-C:Migration; D-F:Invasion; A, D: Blank group; B, E: Empty vector transfection group; C, F: MCRS1 transfection group. 图 5 Transwell实验检测各组胃癌细胞BGC-823迁移和侵袭情况(结晶紫,×200) Fig. 5 Migration and invasion of gastric cancer BGC-823 cells in various groups detected with Transwell assay(Crystal violet, ×200) |
|
|
|
| 1: Blank group; 2: Empty vector transfection group; 3: MCRS1 transfection group. 图 6 各组胃癌BGC-823细胞迁移(A)和侵袭(B)细胞数量 Fig. 6 Number of migration(A) and invasion(B) cells of gastric cancer BGC-823 cells in various groups |
|
|
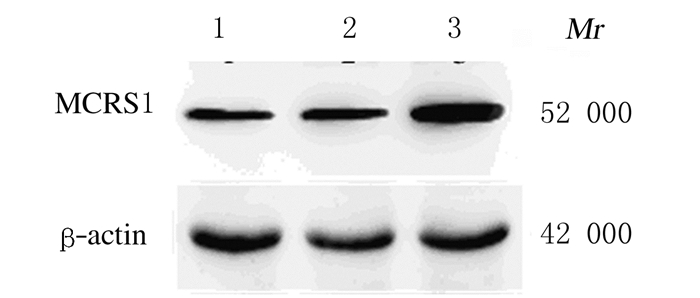
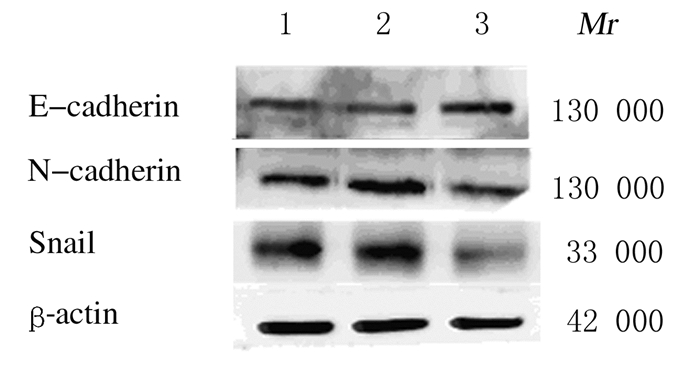
与空白组(0.657±0.023)和空载体转染组(0.591±0.025)比较,MCRS1转染组细胞中MCRS1蛋白表达水平(1.165±0.054)明显升高(P < 0.01),说明转染成功,见图 7和表 1。MCRS1转染组细胞中E-cadherin蛋白表达水平(0.948±0.027)明显高于空白组(0.529±0.023)和空载体转染组(0.532±0.012)(P < 0.01)。MCRS1转染组细胞中N-cadherin蛋白表达水平(0.578±0.006)明显低于空白组(1.038±0.008)和空载体转染组(1.110±0.018)(P < 0.01)。MCRS1转染组Snail蛋白表达水平(0.487±0.008)明显低于空白组(1.044±0.015)和空载体转染组(1.047±0.012)(P < 0.01)。见图 8和表 1。
|
| Lane 1: Blank group; Lane 2: Empty vector transfection group; Lane 3: MCRS1 transfection group. 图 7 Western blotting法检测各组细胞中MCRS1蛋白表达电泳图 Fig. 7 Electrophoregram of expressions of MCRS1 protein in cells in various groups detected by Western blotting method |
|
|
| (x±s) | ||||
| Group | MCRS1/β-actin | E-cadherin/β-actin | N-cadherin /β-actin | Snail/β-actin |
| Blank | 0.657±0.023 | 0.529±0.023 | 1.038±0.008 | 1.044±0.015 |
| Empty vector transfection | 0.591±0.025 | 0.532±0.012 | 1.110±0.018 | 1.047±0.012 |
| MCRS1 transfection | 1.165±0.054*△ | 0.948±0.027*△ | 0.578±0.006*△ | 0.487±0.008*△ |
| *P < 0.01 compared with blank group; △P < 0.01 compared with empty vector transfection group. | ||||
|
| Lane 1: Blank group; Lane 2: Empty vector transfection group; Lane 3: MCRS1 transfection group. 图 8 Western blotting法检测各组细胞中E-cadherin、N-cadherin和Snail蛋白表达电泳图 Fig. 8 Electrophoregram of expressions of E-cadherin, N-cadherin and Snail proteins in cells in various groups detected by Western blotting method |
|
|
MCRS1全长462个氨基酸,主要定位在核仁和中心体[13]。MCRS1在恶性肿瘤发展、淋巴结转移过程及患者生存情况方面发挥重要作用。研究[4-9]显示:下调MCRS1表达可抑制乳腺癌、肠癌、食管癌、结直肠癌和胃癌细胞的生长和增殖,但MCRS1蛋白又可抑制胃癌患者的淋巴转移,说明MCRS1具有抑癌和促癌的双重特质[12]。MCRS1在胃癌细胞的迁移和侵袭方面充当何种角色目前尚不明确。本研究选择胃癌BGC-823细胞、SGC-7901细胞和正常胃黏膜上皮细胞GES-1,采用Western blotting方法检测到MCRS1蛋白在胃癌BGC-823细胞中低表达,因此选择BGC-823细胞进行后续过表达实验。随后构建重组质粒pcDNA3.1-myc-MCRS1,采用瞬时转染技术将质粒转入BGC-823细胞,Western blotting法检测显示:与空白组和空载体转染组比较,MCRS1转染组E-cadherin蛋白表达水平升高,N-cadherin和Snail蛋白表达水平降低。划痕实验和Transwell小室实验则证实上调MCRS1表达明显抑制胃癌细胞的迁移和侵袭,与CUI等[9]对胃癌MGC803细胞和BGC-823细胞的研究结果有所不同,原因可能是不同实验室细胞遗传背景存在差异,且由于其特殊的抑癌和致癌双重作用,导致其在不同细胞中影响不同[12]。为了进一步验证本实验结果,本文作者将在MCRS1本体表达水平高的SGC-7901细胞中进行下调实验,从正反两方面验证MCRS1在胃癌发展中的作用,从而达到实验的严谨性。
EMT现象是指上皮细胞在特定的生理和病理情况下,向间质细胞表型转化,同时伴随有细胞形态和细胞功能的改变[14]。肿瘤细胞浸润和转移涉及许多不同的过程,EMT作为其中关键的步骤,被认为是癌症侵袭和转移的重要环节[15]。鉴于EMT标志物E-cadherin、N-cadherin以及转录因子Snail在促进胃癌转移和侵袭中的作用,因此检测转移过程中三者的表达水平,探讨其是否可作为胃癌转移的早期诊断指标。E-cadherin作为一种钙依赖性跨膜黏附蛋白,是黏附蛋白的核心组件,能够抑制肿瘤细胞浸润和转移,甚至是一种抑癌基因[16]。研究[17]显示:在上皮细胞中N-cadherin可使细胞形态向成纤维细胞转化,从而使这些细胞富有活力与侵袭性,N-cadherin的作用之一是提高细胞的移动能力,因此当肿瘤细胞中的N-cadherin表达水平升高时,表明其获得了更强的侵袭以及转移能力。而Snail家族成员具有促进细胞转移的作用,在许多肿瘤组织中存在高表达,被视为肿瘤侵袭和转移的促进因素[18-20]。在本研究中,上调MCRS1之后,E-cadherin蛋白表达水平升高,N-cadherin和Snail蛋白表达水平降低,提示MCRS1对胃癌细胞侵袭和转移有抑制作用。
综上所述,本实验验证了过表达MCRS1可以明显抑制胃癌细胞的侵袭和迁移,其机制可能与E-cadherin蛋白表达增加、N-cadherin及Snail蛋白表达减少有关。在本研究基础上,本文作者还将通过更多的实验探讨MCRS1抑制胃癌进展和转移的机制,为临床上胃癌的分子治疗提供新的理论依据及治疗策略,提高胃癌患者的生存率,达到预防和治疗胃癌并防止其复发的目的。
| [1] | 周洲, 高采平, 邱春华, 等. 上皮间质转化相关因子在胃癌转移中的表达变化[J]. 国际消化病杂志, 2018, 38(2): 126–129. DOI:10.3969/j.issn.1673-534X.2018.02.011 |
| [2] | 赵燕颖, 王秀岩, 秦国涛, 等. 血管内皮生长因子165b对人肝癌HepG2细胞生物学特性的影响[J]. 吉林大学学报:医学版, 2018, 44(1): 101–105. |
| [3] | MANI S A, GUO W J, LIAO M J, et al. The epithelial-mesenchymal transition generates cells with properties of stemcells[J]. Cell, 2008, 133(4): 704–715. DOI:10.1016/j.cell.2008.03.027 |
| [4] | 闫巍中. MCRS1、MCRS2在食管癌中的表达研究[J]. 中国卫生标准管理, 2016, 7(6): 167–168. |
| [5] | SHI H, CHEN S X, JIN H F, et al. Downregulation of MSP58 inhibits growth of human colorectal cancer cells via regulation of the cyclinD1-cyclin-dependent kinase 4-p21 pathway[J]. Cancer Sci, 2009, 100(9): 1585–1590. DOI:10.1111/cas.2009.100.issue-9 |
| [6] | WU L, ZHANG Z G, QIN H Z, et al. Downregulation of MSP58 suppresses cell proliferation in neuroblastoma cell lines[J]. Neuroreport, 2012, 23(16): 932–936. DOI:10.1097/WNR.0b013e328359566e |
| [7] | XU C S, ZHENG J Y, ZHANG H L, et al. MSP58 knockdown inhibits the proliferation of esophageal squamous cell carcinoma in vitro and in vivo[J]. Asian Pac J Cancer Prev, 2012, 13(7): 3233–3238. DOI:10.7314/APJCP.2012.13.7.3233 |
| [8] | 陈明晓, 杜金林, 王建平, 等. MCRS1、MCRS2基因在结直肠癌中的表达研究[J]. 浙江医学, 2016, 38(21): 1717–1722. |
| [9] | CUI J X, XI H Q, CAI A Z, et al. Increased expression of 58-kDa microspherule protein(MSP58) in human gastric cancer promotes cell proliferation and correlates with poor patient survival[J]. Clin Lab, 2016, 62(6): 993–1001. |
| [10] | BADER A G, SCHNEIDER M L, BISTER K, et al. T TOJ3, a target of the v-Jun transcription factor, encodes a protein with transforming activity related to human microspherule protein 1(MCRS1)[J]. Oncogene, 2001, 20(51): 7524–7535. DOI:10.1038/sj.onc.1204938 |
| [11] | LIU MX, ZHOU KC, CAO Y. MCRS1 overexpression, which is specifically inhibited by miR-129*, promotes the epithelial mesenchymal transition and metastasis in non-small cell lung cancer[J]. Mol Cancer, 2014, 13(11): 245–259. |
| [12] | 路明, 李艳丽, 高峰, 等. 胃癌患者淋巴转移与RacGAP1及MCRS1在组织中表达的关系及意义[J]. 中国实验诊断学, 2018, 22(1): 63–66. DOI:10.3969/j.issn.1007-4287.2018.01.022 |
| [13] | ZHONG M, ZHANG X, LI B, et al. Expression of MSP58 in hepatocellular carcinoma[J]. Med Oncol, 2013, 30(2): 539. DOI:10.1007/s12032-013-0539-2 |
| [14] | NIETO M A, HUANG R Y, JACKSON R A, et al. Emt:2016[J]. Cell, 2016, 166(1): 21–45. DOI:10.1016/j.cell.2016.06.028 |
| [15] | 朱军辉, 金明, 邱浩, 等. Calreticulin通过诱导细胞EMT促进鼻咽癌迁移和侵袭[J]. 中国病理生理杂志, 2018, 34(5): 925–929. DOI:10.3969/j.issn.1000-4718.2018.05.024 |
| [16] | YIN M, ZHANG W, LI H, et al. LKB1, ZEB1 expression in gastric cancer tissue and its clinical significance[J]. Guizhou Med, 2017, 41(10): 1021–1024, 1121. |
| [17] | 杨宏樱. N-cadherin、E-cadherin及p63在宫颈癌中的表达及相关性[J]. 河北医药, 2016, 38(17): 2565–2568. |
| [18] | ZHANG Y Y, YANG Y J. Progress of Snail in gastric cancer[J]. Chin J Gastroenterol Hepatol, 2015, 24(10): 1163–1165. |
| [19] | KUME K, HARAGUCHI M, HIJIOKA H, et al. The transcriptionfactor Snail enhanced the degradation of E-cadherin and desmoglein 2 in oral squamous cell carcinoma cells[J]. Biochem Biophys Res Commun, 2013, 430(3): 889–894. DOI:10.1016/j.bbrc.2012.12.060 |
| [20] | QU B L, YU W, HUANG Y R, et al. 6-OH-BDE-47 promotes human lung cancer cells epithelial mesenchymal transition via the AKT/Snail signal pathway[J]. Environ Toxicol Pharmacol, 2015, 39(1): 271–279. DOI:10.1016/j.etap.2014.11.022 |
 2019, Vol. 45
2019, Vol. 45


