扩展功能
文章信息
- 朱广伟, 黄金胜, 黄永建, 郑炜, 杨树钢, 林春霖, 陈恒恺, 叶建新
- ZHU Guangwei, HUANG Jinsheng, HUANG Yongjian, ZHENG Wei, YANG Shugang, LIN Chunlin, CHEN Hengkai, YE Jianxin
- 内质网蛋白29过表达慢病毒载体的构建及其对胃癌细胞生物学行为的影响
- Construction of lentiviral vector with overexpression of ERp29 and its effect on biological behavior of gastric cancer cells
- 吉林大学学报(医学版), 2019, 45(02): 244-250
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 244-250
- 10.13481/j.1671-587x.20190206
-
文章历史
- 收稿日期: 2018-06-08
2. 福建医科大学消化道恶性肿瘤教育部重点实验室, 福建 福州 350005
2. Key Laboratory of Gastrointestinal Cancer, Ministry of Education, Fujian Medical University, Fuzhou 350005, China
胃癌是恶性程度极高的消化道恶性肿瘤之一,我国每年发病人数超过40万,死亡人数高达30万[1]。胃癌高死亡率及难以治愈的重要原因在于复发和早期淋巴途径转移,因此寻找胃癌淋巴转移特异性标志物并阐明其在胃癌发生发展中的分子机制具有重要的理论和临床意义。本课题组前期研究[2]改良了蛋白质双向凝胶电泳技术(2-DE), 改善了对极酸、碱性区域和低丰度蛋白的分离及检测,通过改善胃癌和正常胃黏膜组织蛋白凝胶图谱的分辨率发现:内质网蛋白29(endoplasmic reticlum protein 29,ERp29)在胃癌组织中表达水平明显降低。ERp29作为内质网折叠蛋白,在新生蛋白的折叠和分泌调控上具有重要作用。ERp29与胃癌的关系目前未见有关报道。本实验通过构建ERp29的慢病毒表达载体,建立稳定表达ERp29的人胃癌细胞株,为研究ERp29在胃癌生物学特性中的功能和作用奠定基础。
1 材料与方法 1.1 细胞、主要试剂和仪器胃癌细胞株SGC7901、MGC803以及293T细胞(教育部消化道恶性肿瘤重点实验室)。DMEM、RPMI 1640、Opti-MEM培养基和胎牛血清(美国Gibco公司),限制性核酸内切酶和T4 DNA连接酶(美国New England Biolabs公司),胶回收试剂盒、质粒小量抽提试剂盒(上海超世生物科技有限公司),质粒大量抽提试剂盒(德国Qiagen公司),Taq DNA Polymerase High Fidelity(保真聚合酶)和Lipofectamine® 3000转染试剂(美国Invitrogen公司),anti-ERp29抗体(美国Abcam公司)。Transwell小室(美国Corning公司,聚碳酸酯膜孔径:8.0 μm),PCR仪(AB2720型)购于美国Applied Biosystems公司,凝胶成像系统购于英国Syngene公司,无菌洁净工作台购于苏州净化设备有限公司,SHP-150型生化培养箱购于上海精宏实验设备有限公司,Mini-PROTEIN垂直蛋白电泳仪购于美国BioRad公司。
1.2 pCDH-ERp29过表达载体的构建首先提取细胞总RNA:用ExScript RT-PCR Kit试剂盒逆转录获得cDNA, 反应体系为5×PrimeScript Buffer 10μL、PrimeScript RT Enzyme Mix 2.5μL、Oligo dT Primer (50 μmol·L-1)2.5μL、Random Primers (100 μmol·L-1) 2.5μL、Total RNA 2.5μg,RNase Free ddH2O补至50μL。逆转录条件:37℃、15min,85℃、5s。ERp29引物:上游5′-CGGAATTCGCCACCATGGCTGCCGCTGTGCCCCG-3′, 下游5′-CGGGAT-CC TTACTTGTCGTCATCGTCTTTGTAGTCC-AGCTCCTCTTTCTCGG-3′ (下划线部分分别为EcoRⅠ和BamHⅠ酶切位点)。25μL体系,扩增参数:94℃预变性5min;94℃变性30s,55℃退火40s,72℃延伸48s,共25个循环;最后72℃延伸10min。回收产物、双酶切产物与pCDH-CMV-EF1-RFP-Puro质粒连接、转化、扩增、测序;最后酶切鉴定命名为pCDH-ERp29。
1.3 ERp29过表达慢病毒的包装293T细胞接种于15cm细胞培养皿,待细胞密度达70%~80%时用于转染;pCDH-ERp29载体10μg、pMDL载体10μg、VSV-G载体6μg、Rev载体4μg,与相应的TE混合均匀,调整总体积为420μL,室温下孵育5min;2mol·L-1 CaCl260μL加入混合体系中,再加入2×HeBs480μL;混合后室温孵育20~40min;加入293T细胞,4~6h后弃去上清液,加入12mL solution A液,洗涤细胞;加入含10%血清培养基10mL,培养箱内继续培养48h。上清液即为含慢病毒载体的上清液。将病毒液稀释为4个浓度梯度后转染293T细胞,培养72h后通过荧光显微镜计数荧光细胞,结合稀释倍数测定病毒的滴度。
1.4 构建稳定高表达ERp29的胃癌细胞株培养MGC803和SGC7901细胞,取处于对数生长期的细胞接种至24孔板,细胞汇合度为10%~30%;弃去培养基加入病毒液,每孔加入polybrene,终浓度5mg·L-1,促进病毒感染细胞,轻微摇晃,37℃、5%CO2培养箱继续培养。8~12h观察细胞生长状态,弃去上清,加入完全培养基,继续培养。感染3~4d后加入适当浓度的puromycin完全培养基,筛选稳定感染细胞。筛选好的pCDH-ERp29慢病毒和对照慢病毒的细胞分别命名为pCDH-ERp29-MGC803、pCDH-Vector-MGC803、pCDH-ERp29-SGC7901和pCDH-Vector-SGC7901。
1.5 CCK-8检测胃癌细胞的增殖能力选取处于对数生长期的胃癌细胞pCDH-ERp29-MGC803、pCDH-Vector-MGC803、pCDH-ERp29-SGC7901和pCDH-Vector-SGC7901,胰酶消化,计数后接种于96孔板中培养,每组平行5个复孔。37℃培养箱培养16~24 h,分别于种板后不同时间点(0、24、48、72和96 h)取出细胞,加入CCK-8试剂,每孔10 μL,轻轻敲击培养板,充分混匀,继续培养1 h,于酶标仪450 nm处检测吸光度(A)值,以A值表示细胞增殖能力。
1.6 平板克隆形成实验4种胃癌细胞消化计数,采用倍比稀释法获得较少数量的细胞,按照预先计算的量吸取800个细胞至6孔板,加入2 mL培养基;十字摇匀,使细胞均匀分散,培养箱常规培养,定期观察,1周后换液。2周后形成肉眼可见的克隆,弃去培养液,1×PBS洗3次,从侧壁轻柔加入,甲醇固定10min,双蒸水洗3次;加入结晶紫,铺满培养皿底部,室温静置染色约10min,吸干净结晶紫,双蒸水洗涤,晾干后形成肉眼可见的克隆,计数克隆数目。
1.7 Transwell小室细胞迁移实验将4种处于对数生长期的胃癌细胞行胰酶消化,用无血清培养基制成细胞密度为1×105mL-1的重悬细胞悬液;Transwell小室放入24孔板中,小室下层加含20%胎牛血清的培养液800 μL,小室内加入含4×104个胃癌细胞(4种胃癌细胞)的无血清培养液500 μL,常规培养24~36 h;用棉签擦去小室孔上层细胞,结晶紫染色5 min,显微镜下观察小室下层细胞并拍照。每孔取5个视野。
1.8 Transwell小室细胞侵袭实验10g·L-1 Matrigel以无血清培养液按1:3稀释,在冰上操作,取20 μL包被24孔Transwell培养板的小室微孔膜的上层,37℃放置30min,凝固备用;取4种处于对数生长期的胃癌细胞行胰酶消化,用无血清培养基制成细胞密度为1×105mL-1的重悬细胞悬液;Transwell小室放入24孔板中,小室下层加入含20%胎牛血清的培养液800 μL,小室内加入含4×104个胃癌细胞(4种胃癌细胞)的无血清培养液500 μL,常规培养24~36 h;用棉签擦去小室孔上层细胞,结晶紫染色5 min,显微镜下观察小室下层细胞并拍照。每孔取5个视野。
1.9 Real-time PCR检测细胞中ERp29 mRNA表达4种胃癌细胞RNA提取和逆转录步骤同1.2。各取逆转录得到的cDNA模板2.5μL, 在96微孔板上进行PCR反应,每孔做3个复孔对照,取平均值。应用ABI StepOne Real-time PCR System (Applied Biosystems)仪器进行操作,试剂采用SYBR Premix Ex Taq Kit (日本TaKaRa公司)试剂盒。引物合成委托上海铂尚生物技术有限公司完成:ERp29 F,5′-AAACTCGGCTTCCAGCGA-3′;ERp29 R,5′-TGGCTC- CAACCTTAACTGCC;GAPDH F,5′-TGCACCACCAACTGCTTAGC-3′;GAPDH R,5′-AGCTCAGGGATGACCTTGCC-3′。PCR反应条件:95℃、1min,95℃、15s,60℃、30s,共40个循环。每对引物(基因)在每个模板中做3个重复孔,得到的Ct值取平均值;ΔCt=每个目的基因的Ct平均值-对应模板的内参基因(GAPDH)的Ct平均值。ΔΔCt=ΔCt实验组-ΔCt对照组, 实验组和对照组中待测基因的倍数关系以2-ΔΔCt表示。
1.10 Western blotting法检测细胞中ERp29蛋白表达胃癌细胞样本中加入细胞裂解液,待细胞完全裂解后提取细胞蛋白,BCA蛋白定量,样品使用10%SDS-聚丙烯酰胺凝胶分离,每孔上样30μg蛋白;电泳后转膜,缓冲液封闭,TBST洗涤3次,每次10min,加入稀释好的单抗兔抗ERp29单克隆抗体(1:100, 美国Abcam公司)和小鼠抗β-actin(1:2000,美国Cell signaling公司);4℃孵育过夜,TBST洗3次,每次15min;加入稀释好的二抗,室温2h,TBST洗涤3次,每次15min。采用化学发光检测,凝胶成像系统分析拍照,以条带灰度值表示蛋白表达水平,以β-actin为内参。
1.11 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组胃癌细胞增殖能力、克隆形成数量、迁移和侵袭的细胞数量以及胃癌细胞中ERp29 mRNA和蛋白表达水平以x±s表示,组间比较采用双侧t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 pCDH-ERp29过表达载体的构建经双酶切鉴定,可见786bp和线性化的空质粒两处条带,扩增片段与理论长度一致,提示pCDH-ERp29过表达载体构建成功。见图 1。

|
| Lane1:DNA marker; Lane2:pCDH-Vector; Lane 3, 4:pCDH-ERp29. 图 1 pCDH-ERp29过表达载体双酶切鉴定 Fig. 1 Identification of pCDH-ERp29 overexpression vector by double enzyme digestion |
|
|
在慢病毒感染24 h的MGC803和SGC7901胃癌细胞中加入puromycin至终浓度为0.5 mg·L-1,为最佳筛选药物浓度,细胞于37℃、5%CO2继续培养,直到空白加药组细胞全部死亡时,继续用浓度为0.5 mg·L-1的puromycin筛选慢病毒感染的胃癌细胞,荧光显微镜下观察,胃癌细胞全部带红色荧光且能够在puromycin抗性的培养基存活,说明慢病毒稳定感染的胃癌细胞株成功建立。见图 2(插页二)。
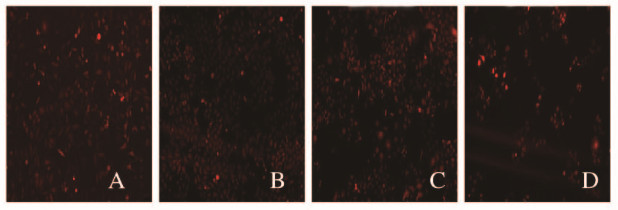
|
| A, B:MGC803 cells C, D:SGC7901 cells; A, C:pCDH-Vector group; B, D: pCDH-ERp29group. 图 2 荧光显微镜观察慢病毒稳定感染的胃癌细胞(×100) Fig. 2 Lentivirus stably infected-gastric cancer cells observed by fluorescence microscope(×100) |
|
|
与pCDH-Vector组比较,pCDH-ERp29组MGC803细胞的增殖能力无明显变化(P=0.681);与pCDH-Vector组比较,pCDH-ERp29组SGC7901细胞的增殖能力无明显变化(P=0.736)。见图 3。

|
| A: MGC803 cells; B: SGC7901 cells. 图 3 各组胃癌细胞的增殖能力 Fig. 3 Proliferation abilities of gastric cancer cells in various groups |
|
|
各组胃癌细胞(MGC803和SGC7901慢病毒感染对照和ERp29过表达组)克隆形成情况见图 4(插页二)。pCDH-Vector组[(165±16)个]和pCDH-ERp29组[(167±8)个]MGC803细胞克隆数量差异无统计学意义(P=0.691);pCDH-Vector组[(82±11)个]和pCDH-ERp29组[(91±18)个]SGC7901细胞克隆数量差异无统计学意义(P=0.679)。
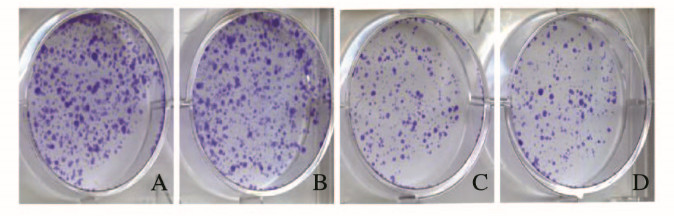
|
| A, B: MGC803 cells; C, D: SGC7901 cells; A, C:pCDH-Vector group; B, D:pCDH-ERp29 group. 图 4 各组胃癌细胞克隆形成情况(结晶紫) Fig. 4 Colony formation of gastric cancer cells in various groups(Crystal violet) |
|
|
各组胃癌细胞(MGC803和SGC7901慢病毒感染对照和ERp29过表达组)迁移情况见图 5(插页三)。与pCDH-Vector组[(723±123)个]比较,pCDH-ERp29组MGC803细胞的迁移能力被明显抑制,细胞迁移数量[(396±94)个]明显减少(P=0.031);与pCDH-Vector组[(835±115)个]比较,pCDH-ERp29组SGC7901细胞的迁移能力被明显抑制,细胞迁移数量[(456±96)个]明显减少(P=0.039)。
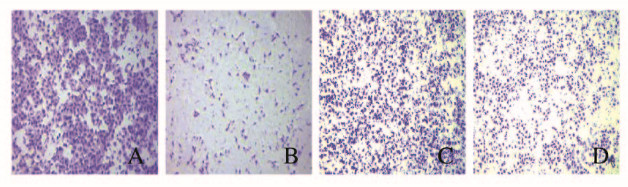
|
| A, B: MGC803 cells; C, D: SGC7901 cells; A, C:pCDH-Vector group; B, D:pCDH-ERp29 group. 图 5 各组胃癌细胞迁移能力(结晶紫,×100) Fig. 5 Migration abilities of gastric cancer cells in various groups(Crystal violet, ×100) |
|
|
各组胃癌细胞(MGC803和SGC7901慢病毒感染对照和ERp29过表达组)侵袭情况见图 6(插页三)。与pCDH-Vector组[(691±125)个]比较,pCDH-ERp29组MGC803细胞侵袭能力被抑制,侵袭细胞数量[(383±106)个]明显减少(P=0.028);与pCDH-Vector组[(964±89)个]比较,pCDH-ERp29组SGC7901细胞侵袭能力被抑制,侵袭细胞数量[(403±83)个]明显减少(P=0.026)。
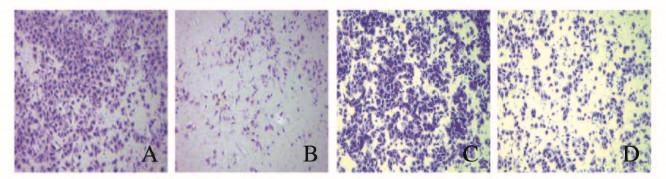
|
| A, B: MGC803 cells; C, D: SGC7901 cells; A, C:pCDH-Vector group; B, D:pCDH-ERp29 group. 图 6 各组胃癌细胞侵袭能力(结晶紫,×100) Fig. 6 Invasion abilities of gastric cancer cells in various groups(Crystal violet, ×100) |
|
|
与pCDH-Vector组(1.00±0.00)比较,pCDH-ERp29组MGC803细胞中ERp29 mRNA表达水平(3.52±1.21)明显升高(P=0.001);与pCDH-Vector组(1.00±0.00)比较,pCDH-ERp29组SGC7901细胞中ERp29 mRNA表达水平(2.97±1.96)明显升高(P=0.005)。
2.8 各组胃癌细胞中ERp29蛋白表达水平将pCDH-ERp29-MGC803组、pCDH-Vector-MGC803组、pCDH-ERp29-SGC7901组、pCDH-Vector-SGC7901组胃癌细胞提取蛋白,采用Western blotting法检测各组细胞中ERp29蛋白表达,其电泳图见图 7。与pCDH-Vector组(1.00±0.00)比较,pCDH-ERp29组MGC803细胞中ERp29蛋白表达水平(3.52±0.61)明显升高(P=0.002);与pCDH-Vector组(1.00±0.00)比较,pCDH-ERp29组SGC7901细胞中ERp29蛋白表达水平(3.06±0.43)明显升高(P=0.002)。
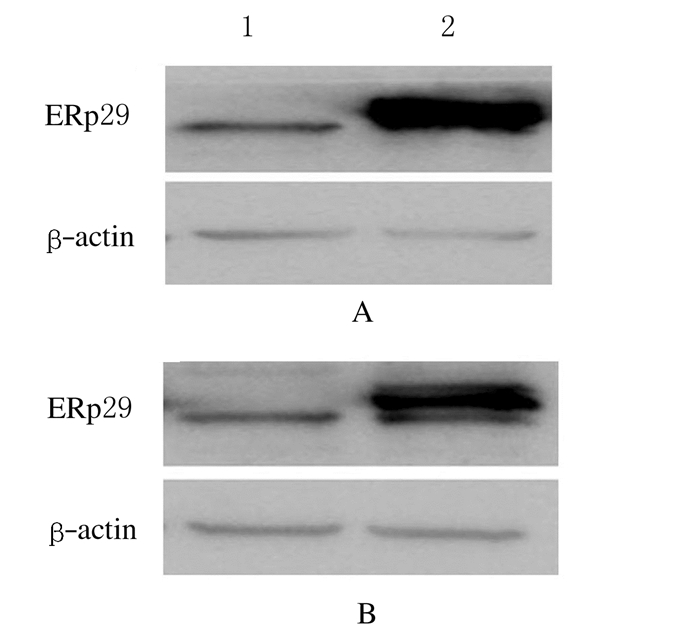
|
| A: MGC803 cells; B: SGC7901 cells.Lane 1:pCDH-vector group; Lane 2:pCDH-ERp29 group. 图 7 各组胃癌细胞中ERp29蛋白表达电泳图 Fig. 7 Electrophoregram of expressions of ERp29 protein in gastric cancer cells in various groups |
|
|
ERp29是DEMMER等[3]首先在大鼠牙釉质细胞中发现,在昆虫、植物和哺乳动物中高度保守的蛋白质,其相对分子质量为29000,广泛分布于脑、肺、肝脏、肾上腺、甲状腺和牙釉质等分泌旺盛的器官[4]。ERp29是由261个氨基酸构成的蛋白质,包含2个结构域:N-端结构域(1~156aa)和C-端结构域(157~251aa),定位在第12号染色体上。ERp29作为内质网折叠蛋白,在蛋白质合成后加工修饰方面具有重要的作用[5]。ERp29是一个辅助蛋白折叠、分泌的分子,已有研究[6-9]表明:ERp29在肿瘤发生发展中起关键作用。但ERp29影响肿瘤的确切作用机制目前并未完全阐明。
大量研究[6-9]显示:ERp29在肿瘤发生发展中起重要的作用。CHERETIS等[6]对皮肤基底细胞癌的研究发现:ERp29在皮肤癌组织中表达增强,且浸润性癌比表浅癌的表达更明显,表明ERp29促进了皮肤癌的进展。FAN等[7]采用双向电泳及蛋白质谱鉴定发现:与其相配对的结直肠正常黏膜比较,结直肠癌组织中ERp29的表达明显增强,提示ERp29可能与结直肠癌进展有关。DENG等[8]也认为:ERp29在结直肠癌高表达,可以作为不良预后的风险因子,提示ERp29促进结直肠癌的转移。SHNYDER等[9]对肺癌研究发现:ERp29在肺癌组织中高表达,认为其对肺癌进展具有重要作用。
ZHANG等[10]对胰腺癌研究发现:ERp29在胰腺癌组织中的表达明显降低,且高表达提示预后较好,表明ERp29抑制胰腺癌的进展。BAMBANG等[11]发现:在恶性度高的乳腺癌细胞中ERp29的表达明显减少,在恶性度低的乳腺癌细胞中表达增加,提示ERp29抑制乳腺癌细胞的恶性生物学行为。YUAN等[12]对胆囊癌中ERp29表达的研究发现:ERp29在低分化、肿瘤较大等分期较晚的组织中表达明显降低,ERp29高表达提示良好预后,表明ERp29抑制胆囊癌的进展。BAMBANG等[13]报道:过表达ERp29抑制裸鼠乳腺癌移植瘤的生长和侵袭。最近又有新的报道[14-15]提示:ERp29在肿瘤中发挥相反的生物学功能。
目前,ERp29与胃癌细胞生物学行为关系的研究未见相关报道。因此本文作者构建ERp29过表达慢病毒载体,并感染胃癌MGC803和SGC7901细胞株。与pCDH-Vector组比较,pCDH-ERp29组细胞增殖能力无明显变化;为了进一步验证,采用克隆形成实验检测细胞增殖能力:与pCDH-Vector组比较,pCDH-ERp29组细胞增殖能力无明显变化,提示ERp29对胃癌MGC803和SGC7901细胞的增殖能力无明显影响。这与BAMBBANG等[13]的研究结果不一致,其认为ERp29可以抑制裸鼠乳腺癌移植瘤的生长。本研究结果显示:无论是CCK-8增殖实验还是克隆形成实验均未检测到ERp29对MGC803和SGC7901细胞增殖能力的影响,这说明ERp29在胃癌中的作用不同于乳腺癌、皮肤癌、结直肠癌和肺癌等,但具有何种特殊作用需进一步研究。
本研究中ERp29对MGC803和SGC7901细胞迁移和侵袭能力影响的实验结果显示:与pCDH-Vector组比较,pCDH-ERp29组MGC803细胞迁移和侵袭能力被明显抑制;与pCDH-Vector组比较,pCDH-ERp29组SGC7901细胞迁移和侵袭能力被明显抑制。上述结果提示:ERp29可抑制胃癌细胞的迁移和侵袭。ZHANG等[10]对胰腺癌研究、BAMBANG等[11]对乳腺癌细胞中ERp29的研究、YUAN等[12]对胆囊癌ERp29研究及BAMBANG等[13]对ERp29在裸鼠乳腺癌移植瘤中的研究有类似的结果,上述研究结果均提示ERp29可抑制肿瘤的进展。
另外,ZHANG等[10]研究发现:ERp29表达与胰腺癌淋巴转移有关联。BAMBANG等[13]对50例N0和40例N1-2期乳腺癌组织检测发现:ERp29在N1-2期组织中的表达明显降低,表明ERp29与乳腺癌的淋巴转移有关联。YUAN等[12]发现:在淋巴转移的胆囊癌组织中ERp29表达明显降低,无淋巴结转移的组织标本中ERp29表达增强,提示ERp29抑制胆囊癌淋巴转移。本课题组在前期ERp29与胃癌临床病理关系的研究[16]中也发现:ERp29与胃癌淋巴结转移及淋巴结转移数量有关联,这也是本课题组未来研究的重点内容。
BAMBANG等[13]对ERp29的机制研究显示:ERp29与乳腺癌细胞的上皮-间质转化关系密切,ERp29促使上皮细胞间质转化的机制是ERp29蛋白负向调控E-钙黏蛋白,更深层次的机制需要进一步探讨。因此,本课题组构建ERp29过表达慢病毒载体,筛选稳定转染的MGC803和SGC7901细胞株,为进一步研究提供理论基础。
综上所述,本文作者利用慢病毒载体构建稳定过表达ERp29的MGC803和SGC7901细胞株,采用Real-time PCR和Western blotting技术检测稳定感染慢病毒胃癌细胞中ERp29mRNA和蛋白的表达发现:ERp29mRNA和蛋白表达上调,稳定细胞株构建成功。为了深入探讨ERp29对胃癌细胞生物学行为的影响,采用CCK-8、平板克隆、Transwell小室迁移和侵袭实验进行检测,结果显示:ERp29过表达对胃癌MGC803和SGC7901细胞的增殖能力无影响,但是能够抑制这2种胃癌细胞的迁移和侵袭。本研究结果为后续的ERp29作用机制研究提供了前提条件。
| [1] | CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA:Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | 王锦州.胃腺癌组织差异表达蛋白质的分离与鉴定[D].福州: 福建医科大学, 2013. |
| [3] | DEMMER J, ZHOU C, HUBBARD M J. Molecular cloning of ERp29, a novel and widely expressed resident of the endoplasmic reticulum[J]. FEBS Lett, 1997, 402(2/3): 145–150. |
| [4] | MKRTCHIAN S, SANDALOVA T. ERp29, an unusual redox-inactive member of the thioredoxin family[J]. Antioxid Redox Signal, 2006, 8(3/4): 325–337. |
| [5] | LIEPINSH E, BARYSHEV M, SHARIPO A, et al. Thioredoxin fold as homodimerization module in the putative chaperone ERp29:NMR structures of the domains and experimental model of the 51 kDa dimer[J]. Structure, 2001, 9(6): 457–471. DOI:10.1016/S0969-2126(01)00607-4 |
| [6] | CHERETIS C, DIETRICH F, CHATZISTAMOU I, et al. Expression of ERp29, an endoplasmic reticulum secretion factor in basal-cell carcinoma[J]. Am J Dermatopathol, 2006, 28(5): 410–412. DOI:10.1097/01.dad.0000211521.49810.ac |
| [7] | FAN N J, GAO J L, LIU Y, et al. Label-free quantitative mass spectrometry reveals a panel of differentially expressed proteins in colorectal cancer[J]. Biomed Res Int, 2015, 2015: 365068. |
| [8] | DENG Y J, TANG N, LIU C, et al. CLIC4, ERp29, and Smac/DIABLO derived from metastatic cancer stem-like cells stratify prognostic risks of colorectal cancer[J]. Clin Cancer Res, 2014, 20(14): 3809–3817. DOI:10.1158/1078-0432.CCR-13-1887 |
| [9] | SHNYDER S D, MANGUM J E, HUBBARD M J. Triplex profiling of functionally distinct chaperones (ERp29/PDI/BiP) reveals marked heterogeneity of the endoplasmic reticulum proteome in cancer[J]. J Proteome Res, 2008, 7(8): 3364–3372. DOI:10.1021/pr800126n |
| [10] | ZHANG K, YAO H P, YANG Z, et al. Comparison of ILK and ERP29 expressions in benign and malignant pancreatic lesions and their clinicopathological significances in pancreatic ductal adenocarcinomas[J]. Clin Transl Oncol, 2016, 18(4): 352–359. DOI:10.1007/s12094-015-1331-x |
| [11] | BAMBANG I F, LU D, LI H P, et al. Cytokeratin 19 regulates endoplasmic reticulum stress and inhibits ERp29 expression via p38 MAPK/XBP-1 signaling in breast cancer cells[J]. Exp Cell Res, 2009, 315(11): 1964–1974. DOI:10.1016/j.yexcr.2009.02.017 |
| [12] | YUAN L W, LIU D C, YANG Z L. Correlation of S1P1 and ERp29 expression to progression, metastasis, and poor prognosis of gallbladder adenocarcinoma[J]. HBPD Int, 2013, 12(2): 189–195. |
| [13] | BAMBANG I F, XU S C, ZHOU J B, et al. Overexpression of endoplasmic reticulum protein 29 regulates mesenchymal-epithelial transition and suppresses xenograft tumor growth of invasive breast cancer cells[J]. Lab Invest, 2009, 89(11): 1229–1242. DOI:10.1038/labinvest.2009.87 |
| [14] | WU J, YANG Y Y, GAO S S, et al. ERp29 inhibits tumorigenicity by suppressing epithelial mesenchymal transition in gastric cancer[J]. Oncotarget, 2017, 8(45): 78757–78766. |
| [15] | ZHANG Y, HU Y, WANG J L, et al. Proteomic identification of ERP29 as a key chemoresistant factor activated by the aggregating p53 mutant Arg282Trp[J]. Oncogene, 2017, 36(39): 5473–5483. DOI:10.1038/onc.2017.152 |
| [16] | 钟文进.组织芯片研究ERp29在胃癌中的表达及意义[D].福州: 福建医科大学, 2014. |
 2019, Vol. 45
2019, Vol. 45


