扩展功能
文章信息
- 王六一, 刘楠, 冯旭, 李梦红, 包幸福, 胡敏
- WANG Liuyi, LIU Nan, FENG Xu, LI Menghong, BAO Xingfu, HU Min
- 内皮素B受体激动剂对小鼠成牙骨质细胞生物学行为的影响
- Effects of endothelin B receptor agonist on biological behaviors of cementoblastsof mice
- 吉林大学学报(医学版), 2019, 45(02): 239-243
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 239-243
- 10.13481/j.1671-587x.20190205
-
文章历史
- 收稿日期: 2018-07-21
2. 吉林省牙发育与颌骨重塑与再生重点实验室, 吉林 长春 130021
2. Key Laboratory of Dental Development and Jaw Remodeling and Regeneration of Jilin Province, Changchun 130021, China
正畸治疗过程中,正畸力诱发牙槽骨改建的同时,也会引发牙根出现不同程度的吸收, 而牙骨质是其中最易受累的组织[1-2]。受损牙根的修复与牙髓干细胞(dental pulp stem cells, DPSCs)向成牙骨质细胞分化能力相关联[3-4]。成牙骨质细胞是执行牙根修复的效应细胞,这一过程受到诸多细胞因子的调控[5-6]。内皮素(endothelin,ET)是一种由内皮细胞合成的生物活性肽,由21个氨基酸组成, 其受体分别被称为内皮素A受体(endothelin A receptor,ETAR)、内皮素B受体(endothelin B receptor,ETBR)和内皮素C受体(endothelin C receptor, ETCR)。内皮素1(endothelin-1,ET-1)不仅有强烈缩血管[7]、加强心肌和平滑肌收缩及促进神经内分泌的功能,而且还是一类强大的促分化剂和细胞生长因子,具有促进细胞有丝分裂的性质[8-9]。NELSON等[10]发现:ET-1在前列腺癌中介导新骨形成,之后关于ET-1在骨相关方面的研究日益增多。HU等[11]和SPATH等[12]关于骨髓间充质细胞(bone marrow mesenchymal cells,BMSCs)和DPSCs的实验结果显示:ET-1促进具有分化潜能的干细胞向成骨方向分化。ET-1在骨形成和牙体硬组织形成中起关键作用,对其作用机制的研究已成为热点,但对于ETBR通路的研究尚无明确结论。鼠成牙骨质细胞OCCM-30作为利用转基因技术获得的永生化的细胞系,具有可传代次数多、性质稳定且分化能力强的特点,是较好的体外研究细胞系,因此本实验以OCCM-30为研究对象,观察特异性激活ETBR后细胞的生物学反应,探讨正畸源性牙根吸收修复的新途径。
1 材料与方法 1.1 主要试剂ETBR激动剂、β甘油磷酸钠和MTT(Sigma公司,美国), BCIP/NBT碱性磷酸酶显色试剂盒和Annexin Ⅴ-FITC细胞凋亡试剂盒(碧云天公司,中国),氯化十六烷基吡啶(上海生工公司,中国),RNA试剂盒(TaKaRa公司,日本),胎牛血清(Gibco公司,美国)。
1.2 建立小鼠成牙骨质细胞培养体系复苏小鼠成牙骨质细胞系OCCM-30,采用含有10%胎牛血清、1%双抗的高糖DMEM培养液培养,培养条件为37℃、5%CO2,选择第3~5代细胞用于实验。研究分为实验组和对照组。实验组细胞在培养液中加入ETBR激动剂,使其终浓度为10-6mol·L-1;对照组为各实验相应的培养液。
1.3 MTT法检测细胞增殖将细胞以每孔5×103个细胞密度接种于96孔板中,每组6个复孔。第2天待细胞贴壁后,按实验组和对照组分别更换培养液,继续培养24、48和72h。到达相应时间点后,在避光条件下分别向每孔培养液中加入MTT溶液(5 μg·L-1)20μL,继续孵育4 h后弃上清,每孔加入DMSO150μL,采用酶标仪测量490 nm处的吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
1.4 流式细胞仪检测细胞凋亡以每孔1×105个细胞的密度将细胞接种于6孔板中,按实验分组更换培养液,培养3d后收集培养液中细胞和贴壁的细胞,采用PBS洗涤2次后加入Annexin Ⅴ-FITC染液5μL,流式细胞仪上机检测,波长为480nm。细胞凋亡率=早期凋亡率+晚期凋亡率。每组细胞平行检测6个样品。
1.5 碱性磷酸酶染色观察细胞分化配制细胞分化诱导液方法:α-MEM培养基中加入10%胎牛血清、1%双抗、10mol·L-1的β甘油磷酸钠和50mg·L-1维生素C。按实验分组处理细胞。培养第7天时,使用BCIP/NBT碱性磷酸酶显色试剂盒染色,拍照并观察。
1.6 茜素红染色法检测细胞矿化结节量按上述步骤处理细胞,在诱导第10天,进行矿化结节染色,1%茜素红染液染色,肉眼及镜下观察矿化结节量。
1.7 实时定量PCR检测细胞中分化和矿化相关基因的表达水平以上述细胞分化诱导液培养实验组和对照组细胞,分别在培养24、48和72h时提取细胞总RNA,逆转录成cDNA后进行实时荧光定量PCR检测。所用引物如序列如下:Runx-2 F, 5′-CTTCATTCGCCTCACAAAC-3′, Runx-2 R, 5′-CTAGCAGTGACGGTCT-3′; BSP F, 5′-GA-GACGGCGATAGTTCC-3′, BSP R, 5′-AGTG-CCGCTAACTCAA-3′; OCN F, 5′-TGAACAG-ACTCCGGCG-3′, OCN R, 5′-GATACCGTAG-ATGCGTTTG-3′; Osterix F, 5′-GGCCTTTCG-TCTGCAACTGG-3′, Osterix R, 5′-GGTGCGC-TGATGTTTGCTCA-3′; Col1 F, 5′-GAGGGCCAAGACGAAGACATC-3′, Col1 R, 5′-CAGA-TCACACGTCATCGCACAAC-3′; GAPDH F, 5′-ACCACAGTCCATGCCATCAC-3′, GAPDH R, 5′-TCCACCACCCTGTTGCTGTA-3′。采用2-ΔΔCt方法计算Runx2、BSP、Osterix、OCN和Col1基因mRNA相对表达水平,计算公式:ΔCT=CT目的基因- CT内参基因;ΔΔCT=ΔCT待测基因-ΔCT对照基因;待测基因的倍数= 2-ΔΔCT。
1.8 统计学分析采用SPSS21.0统计软件进行统计学分析。各组成牙骨质细胞增殖抑制率,Runx2、BSP、Osterix、OCN和Col1 mRNA表达水平以x±s表示,符合正态分布及方差齐性,组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组成牙骨质细胞增殖抑制率与对照组(0mol·L-1 ETBR激动剂)比较,实验组细胞培养24、48和72h时成牙骨质细胞增殖抑制率(10.980%±0.045%、37.240%±0.031%和26.790%±0.039%)明显升高(P < 0.05或P < 0.01),在48h时抑制作用最为明显。
2.2 2组成牙骨质细胞凋亡率与对照组比较,实验组细胞凋亡率无明显变化,维持在较低水平。见图 1。
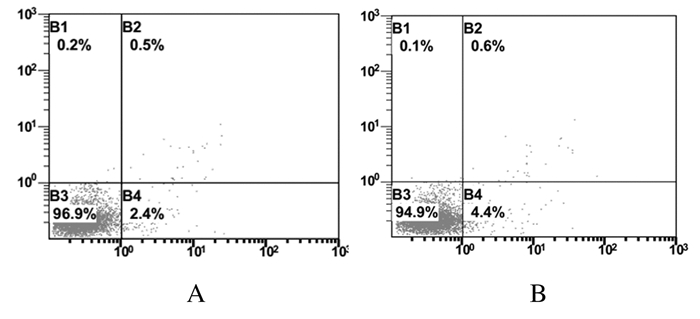
|
| A:Control group; B:Experiment group. 图 1 流式细胞术检测各组细胞凋亡率 Fig. 1 Apoptotic rates of cells in various groups detected by flow cytometry |
|
|
采用碱性磷酸酶染色检测细胞分化:对照组细胞呈现明显的分化特征,碱性磷酸酶高表达,而实验组细胞则呈现相对低的表达,见图 2(插页二)。茜素红染色检测细胞矿化结果与碱性磷酸酶染色检查结果一致,对照组矿化结节产生较多,而实验组矿化结节产生相对较低, 见图 3(插页二)。
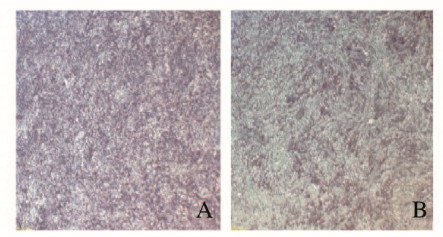
|
| A:Control group;B:Experiment group. 图 2 碱性磷酸酶染色检测2组小鼠成牙骨质细胞体外分化情况(Bar=20 μm) Fig. 2 Differentiation of cementoblasts in vitro of mice in two groups detected by alkaine phosphatase staining(Bar=20 μm) |
|
|
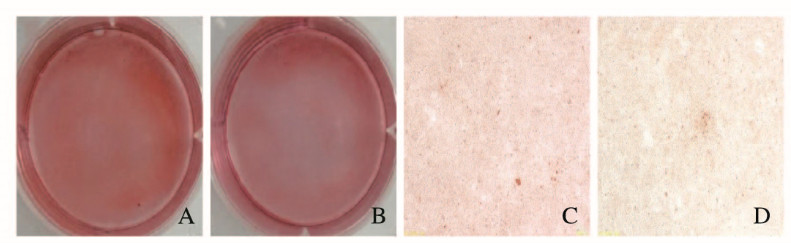
|
| A,C:Control group;B,D:Experiment group;C,D:Bar=100 μm. 图 3 茜素红染色检测2组小鼠成牙骨质细胞矿化情况 Fig. 3 Mineralization of cementoblasts of mice in two groups detected by alizarin red staining |
|
|
ETBR激活剂培养成牙骨质细胞24 h时,与对照组比较,实验组细胞中Runx2、BSP、Osterix、OCN和Col1 mRNA表达水平差异无统计学意义(P>0.05)。随着作用时间的延长,在培养48和72 h时,与对照组比较,实验组细胞中OCN mRNA表达水平降低,但差异无统计学意义(P>0.05);Runx2、BSP、Osterix和Col1 mRNA表达水平明显降低(P < 0.05)。见表 1。
| (n=3,x±s) | |||||||
| Group | Runx2 | BSP | |||||
| (t/h) 24 | 48 | 72 | 24 | 48 | 72 | ||
| Control | 1.022±0.257 | 1.022±0.257 | 1.022±0.257 | 1.000±0.038 | 1.000±0.038 | 1.000±0.038 | |
| Experiment | 1.122±0.188 | 0.937±0.096 | 0.628±0.253* | 1.025±0.022 | 0.843±0.122 | 0.568±0.055* | |
| Group | Osterix | OCN | |||||
| (t/h) 24 | 48 | 72 | 24 | 48 | 72 | ||
| Group | 1.022±0.257 | 1.022±0.257 | 1.022±0.057 | 1.007±0.114 | 1.007±0.114 | 1.007±0.144 | |
| Experiment | 0.834±0.078 | 0.777±0.098 | 0.566±0.012* | 1.091±0.015 | 0.937±0.198 | 0.628±0.035 | |
| Group | Col1 | ||||||
| (t/h) 24 | 48 | 72 | |||||
| Control | 1.018±0.225 | 1.018±0.225 | 1.018±0.225 | ||||
| Experiment | 0.793±0.169 | 0.622±0.061* | 0.370±0.114* | ||||
| * P<0.05 compared with control group. | |||||||
成牙骨质细胞是牙周组织中形成牙骨质的效应细胞。成牙骨质细胞首先分泌胶原形成类牙骨质,随后在类牙骨质中沉积无机盐而形成牙骨质[13]。早期相关研究[5, 14-15]显示:成牙骨质细胞受到一系列细胞因子的调控,包括Wnt5a、SOST、Osterix和Sema3A等。而在细胞分化过程中,多个基因参与其中,Runx2和Osterix是已知的最重要的2个转录因子,两者表达水平上升会促进多个基因的转录过程,从而促进成牙骨质细胞的分化[16]。Col1是形成类牙骨质的胶原成分,能为后续的矿化过程提供支架[17]。OCN和BSP直接参与成牙骨质细胞的矿化过程,调节细胞对钙离子的沉积[18-19]。本实验采用小鼠成牙骨质细胞系OCCM-30,其具有连续培养而不改变遗传性状的特性,且表达上述基因。
ET-1最早提取自猪的内皮细胞,被证实具有强烈的收缩血管作用。研究[8-11]表明:ET-1能调控干细胞的增殖和分化过程,具有较强的促进细胞分裂和分化的作用。关于ET-1的作用机制尚未完全清楚,已知的作用通路包括钙磷调节通路、ETR受体、Wnt通路和MAPKs通路[20-22]。ET-1发挥作用依赖于细胞膜表面的受体,分别被称为ETAR和ETBR。研究[21]表明:ET-1通过ETAR受体发挥大多数生理功能,但是单独激活ETBR受体的生物效应还不清楚,因此本研究采用特异性的ETBR激活剂检测ETBR对成牙骨质细胞功能的影响。
在本实验中,实验组ETBR激动剂浓度为1×10-1 mol·L-1,与对照组比较,ETBR激动剂作用不同时间后,实验组细胞增殖抑制率均大于0,表明特异性激活ETBR对OCCM-30细胞增殖起抑制作用。本研究中细胞凋亡率检测结果显示:实验组细胞凋亡率与对照组比较无明显差异,提示ETBR激动剂并不是通过促进细胞凋亡抑制OCCM-30增殖。成牙骨质细胞分化和矿化是产生修复性牙本质的基础,本研究中碱性磷酸酶染色和茜素红染色检测结果显示:与对照组比较,实验组细胞肉眼及镜下染色明显较浅,表明ETBR激动剂抑制OCCM-30体外矿化及分化。为了进一步探讨ETBR激动剂抑制分化的机制,本研究采用实时定量PCR方法检测多种分化和矿化相关基因表达水平,结果显示:所检测基因的表达均受到抑制。
综上所述,ETBR特异性激活剂可抑制成牙骨质细胞增殖和分化。本研究仅探讨了的ETBR特异性激活剂在体外对鼠成牙骨质细胞OCCM-30的作用,ETBR激动剂以何种途径、何种靶点抑制OCCM-30细胞增殖和分化仍有待深入研究。
| [1] | MATSUZAWA H, TORIYA N, NAKAO Y, et al. Cementocyte cell death occurs in rat cellular cementum during orthodontic tooth movement[J]. Angle Orthod, 2017, 87(3): 416–422. DOI:10.2319/071116-541.1 |
| [2] | 姚国栋, 江银华. 正畸治疗中牙根吸收的影响因素[J]. 口腔医学, 2012, 32(8): 502–504. |
| [3] | CHOI H D, NOH W C, PARK J W, et al. Analysis of gene expression during mineralization of cultured human periodontal ligament cells[J]. J Periodont Implant Sci, 2011, 41(1): 30–43. DOI:10.5051/jpis.2011.41.1.30 |
| [4] | JÄGER A, KUNERT D, FRIESEN T, et al. Cellular and extracellular factors in early root resorption repair in the rat[J]. Eur J Orthod, 2008, 30(4): 336–345. DOI:10.1093/ejo/cjn012 |
| [5] | BAO X F, LIU Y Y, HAN G H, et al. the Effect on proliferation and differentiation of cementoblast by using sclerostin as inhibitor[J]. Int J Mol Sci, 2013, 14(10): 21140–21152. DOI:10.3390/ijms141021140 |
| [6] | LI Z, LI X, ZHOU J, et al. Effects of low-intensity pulsed ultrasound in periodontal tissue regeneration[J]. Int J Stomatol, 2016, 43(3): 329–332. |
| [7] | MORAWIETZ H, TALANOW R, SZIBOR M, et al. Regulation of the endothelin system by shear stress in human endothelial cells[J]. J Physiol(Lond), 2000, 525(Pt 3): 761–770. |
| [8] | ZHANG W M, ZHOU J, YE Q J. Endothelin-1 enhances proliferation of lung cancer cells by increasing intracellular free Ca2+[J]. Life Sci, 2008, 82(13/14): 764–771. |
| [9] | LIU J, LIU X. Knockdown of ET-1 gene can inhibit the proliferation, invasion of human prostate cancer cell[J]. West Indian Med J, 2017, 28(8): 3377–3382. |
| [10] | NELSON J B, HEDICAN S P, GEORGE D J, et al. Identification of endothelin-1 in the pathophysiology of metastatic adenocarcinoma of the prostate[J]. Nat Med, 1995, 1(9): 944–949. DOI:10.1038/nm0995-944 |
| [11] | HU L W, WANG X, JIANG X Q, et al. In vivo and in vitro study of osteogenic potency of endothelin-1 on bone marrow-derived mesenchymal stem cells[J]. Exp Cell Res, 2017, 357(1): 25–32. DOI:10.1016/j.yexcr.2017.04.018 |
| [12] | SPATH L, ROTILIO V, ALESSANDRINI M, et al. Explant-derived human dental pulp stem cells enhance differentiation and proliferation potentials[J]. J Cell Mol Med, 2010, 14(6b): 1635–1644. |
| [13] | RIPAMONTI U, PETIT J C, TEARE J. Cementogenesis and the induction of periodontal tissue regeneration by the osteogenic proteins of the transforming growth factor-beta superfamil[J]. J Periodont Res, 2009, 44(2): 141–152. DOI:10.1111/jre.2009.44.issue-2 |
| [14] | 包幸福, 倪宇昕, 李莹, 等. Wnt5a在小鼠牙骨质发育中的表达特点及其对成牙骨质细胞分化的影响[J]. 吉林大学学报:医学版, 2018, 44(3): 461–465. |
| [15] | QIU Y, REN A S, PANG Q, et al. Effects of Sema3A on the proliferation and mineralization of a cementoblast cell line OCCM-30[J]. J Oral Sci Res, 2016, 32(5): 445–448. |
| [16] | HIRATA A, SUGAHARA T, NAKAMURA H. Localization of runx2, osterix, and osteopontin in tooth root formation in rat molars[J]. J Histochem Cytochem, 2009, 57(4): 397–403. DOI:10.1369/jhc.2008.952192 |
| [17] | 刘宏. 矿化相关蛋白及其与牙周组织的关系[J]. 国际口腔医学杂志, 2000, 27(2): 94–97. |
| [18] | 王春玉, 龙丰云, 陈香, 等. 骨钙素介导的骨内分泌系统[J]. 中华骨质疏松和骨矿盐疾病杂志, 2013, 6(3): 196–202. DOI:10.3969/j.issn.1674-2591.2013.03.002 |
| [19] | KASUGAI S, NAGATA T, SODEK J. Temporal studies on the tissue compartmentalization of bone sialoprotein (BSP), osteopontin (OPN), and SPARC protein during bone formation in vitro[J]. J Cell Physiol, 1992, 152(3): 467–477. DOI:10.1002/(ISSN)1097-4652 |
| [20] | VAN SANT C, WANG G, ANDERSON M G, et al. Endothelin signaling in osteoblasts:global genome view and implication of the calcineurin/NFAT pathway[J]. Mol Cancer Ther, 2007, 6(1): 253–261. DOI:10.1158/1535-7163.MCT-06-0574 |
| [21] | LIANG L, ZHOU W, YANG N, et al. ET-1 Promotes differentiation of periodontal ligament stem cells into osteoblasts through ETR, MAPK, and Wnt/β-Catenin signaling pathways under inflammatory microenvironment[J]. Mediators Inflamm, 2016, 2016: 8467849. |
| [22] | CLERK A, KEMP T J, HARRISON J G, et al. Up-regulation of c-Jun mRNA in cardiac myocytes requires the extracellular signal-regulated kinase cascade, but c-Jun N-terminal kinases are required for efficient up-regulation of c-Jun protein[J]. Biochem J, 2002, 368(Pt 1): 101–110. |
 2019, Vol. 45
2019, Vol. 45


