扩展功能
文章信息
- 王云检, 张珉, 蒙博, 尤国华, 张璐阳
- WANG Yunjian, ZHANG Min, MENG Bo, YOU Guohua, ZHANG Luyang
- 雷公藤甲素对裸鼠胰腺癌皮下移植瘤生长的抑制作用及其机制
- Inhibitory effect of triptolide on growth of subcutaneous tumor of pancreatic cancer in nude mice and its mechanism
- 吉林大学学报(医学版), 2019, 45(02): 234-238
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 234-238
- 10.13481/j.1671-587x.20190204
-
文章历史
- 收稿日期: 2018-06-10
胰腺癌是消化系统最常见的高度恶性肿瘤之一。随着环境和饮食结构的改变,胰腺癌全球范围发病率和死亡率均呈逐年上升趋势,严重危胁人类的生命健康[1]。由于部位的特殊性,胰腺癌发病隐蔽,早期缺乏特异性表现,容易出现漏诊的情况,90%患者确诊时已到晚期[2]。目前, 胰腺癌的临床治疗手段主要以外科手术为主,近年来中药单体治疗肿瘤已经成为国内外医学研究的热点。雷公藤甲素(Triptolide)是从卫矛科雷公藤中提取的成分之一,具有多种生物活性,如抗肿瘤、抗炎等[3]。乔志新等[4]研究发现:雷公藤甲素作用于胰腺癌Bx PC-3和PANC-1细胞后可抑制其增殖并促进凋亡;采用罗丹明123和DCFH-DA染色方法测定到线粒体通透性增强,同时免疫印迹法检测到凋亡相关蛋白Bcl-2下调、Bax上调,认为雷公藤甲素可能通过增强线粒体通透性诱导细胞凋亡。目前,国内外关于雷公藤甲素对人胰腺癌SW1990细胞的体外抑制作用鲜有报道。本研究以雷公藤甲素为活性物质,通过移植胰腺癌细胞于裸鼠下肢,初步探讨雷公藤甲素抗胰腺癌作用及其分子机制。
1 材料与方法 1.1 主要试剂和仪器雷公藤甲素(成都瑞芬思生物科技有限公司),注射用盐酸吉西他滨(南京正大天晴制药有限公司,国药准字H20093403),RPMI-1640培养液和0.25%蛋白酶(武汉博士德生物工程有限公司),Bax和Bcl-2兔抗鼠多克隆一抗(北京博奥森生物技术有限公司),DAB显色试剂盒(深圳晶美生物工程有限公司)。二氧化碳培养箱(美国Thermo Forma公司), 超净工作台(中国苏净集团安泰公司), TS100倒置显微镜(日本Nikon公司), AO-800石蜡包埋机和病理切片机(上海医疗器械厂), Elx800型全自动酶标仪(奥地利KIALAB公司)。
1.2 实验细胞人胰腺癌细胞SW1990购于赛齐(上海)生物工程有限公司。将人胰腺癌细胞SW1990体外培养扩增,取对数生长期细胞,制备瘤细胞悬液,调整细胞密度为1×107 mL-1。
1.3 实验动物4~5周龄SPF级健康BALB/c裸鼠40只,雌雄各半, 体质量18~22 g,由中国科学院上海巴斯德实验动物中心提供,动物合格证号:SYXK(沪)2014-0017。
1.4 实验分组将40只健康BALB/c裸鼠按体质量指数随机区组设计,于裸鼠背部靠近右后肢皮下注射0.2 mL SW1990细胞悬液(约2×106个瘤细胞),2周后测量裸鼠种植瘤直径, 以肿瘤直径≥5 mm判为造模成功, 共有30只裸鼠建模成功。按肿瘤体积大小及雌雄将荷瘤裸鼠平均分为3组,每组10只,分别为模型组、吉西他滨组和雷公藤甲素组。另选取10只健康正常裸鼠,于同样位置注射等体积生理盐水,作为对照组。根据人与鼠体质量换算法计算, 将雷公藤甲素用生理盐水按雷公藤甲素(g) :生理盐水(mL)= 1:20配制成雷公藤甲素混悬液(0.5 g·mL-1),冰箱贮存备用。分组后第2天开始用药。对照组和模型组裸鼠均予以生理盐水0.4 mL,雷公藤甲素组裸鼠以雷公藤甲素0.4 mL·d-1灌胃,3d灌胃1次,连续给药11次;吉西他滨组裸鼠采用腹腔注射吉西他滨125 mg·kg-1,3 d注射1次,连续给药11次。
1.5 各组裸鼠体质量和瘤体质量检测末次给药24h后测量各组裸鼠体质量和瘤体大小。用水合氯醛麻醉裸鼠, 置于超净工作台,剥离皮下瘤体组织,称质量。部分瘤体组织用4%多聚甲醇固定,另一部分立即置于液氮中保存备用。根据瘤体组织质量,计算各组裸鼠瘤体组织质量平均值,按照公式计算各组裸鼠肿瘤抑制率。肿瘤抑制率= (模型组瘤质量-给药组瘤质量)/模型组平均瘤质量×100%。
1.6 HE染色观察裸鼠肿瘤组织形态表现裸鼠肿瘤组织行HE染色, 取固定好的瘤体组织,石蜡包埋,切片(7~10μm),染色,脱水,二甲苯透明,树脂封片,置于显微镜下观察。
1.7 免疫组织化学检测裸鼠肿瘤组织中Bax和Bcl-2表达取固定好的瘤体组织,石蜡包埋,切片(7~10μm), 采用兔二步法染色,烤片,水化,洗片,封闭,加入兔抗人抗体,洗片,滴加1滴羊抗兔IgG抗体,洗片,滴加1滴DAB溶液,洗片,封片。每组标本随机采集10个高倍镜视野(×400)拍照,采用Image-pro plus 7.0分析系统,以细胞核呈棕黄色为阳性表达结果,以积分吸光度(IOD)代表蛋白相对表达水平。
1.8 Western blotting法检测裸鼠肿瘤组织中Bax、Bcl-2和Caspase-9蛋白表达水平取液氮中保存的瘤体组织100 mg,加入1.5 mL预冷PBS,用匀浆器在冰浴下匀浆,于4℃、6000 r·min-1离心15 min,弃上清,加入200 μL全细胞裂解液,裂解40 min,4℃、12000 r·min-1高速离心15 min,收集上清液,按照试剂盒方法测定蛋白浓度。蛋白上样量为50 μg,12% SDS-PAGE凝胶电泳,80~120 V、2 h,电泳完毕后转移至PVDF膜上;5%脱脂奶粉TBST封闭2 h;加入单克隆一抗抗体Bax(1:500)、Bcl-2(1:250)、Caspase-9和Caspase-3 (1:500),PVDF膜用0.5% TBS-T溶液洗膜3次,每次5 min,用鼠抗兔多克隆二抗抗体(1:1000)交联物室温摇床孵育2 h,0.5% TBS-T溶液洗膜3次,显影,对显影条带进行灰度分析,采用Quantity One软件进行定量分析。
1.9 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组裸鼠肿瘤组织中Bax、Bcl-2、Caspase-9和Caspase-3蛋白表达水平均以x±s表示,多组间比较采用单因素方差分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 各组人胰腺癌荷瘤裸鼠瘤体质量和肿瘤抑制率与模型组比较,吉西他滨组和雷公藤甲素组裸鼠瘤体质量明显降低(P < 0.05)。吉西他滨组肿瘤抑制率为26.49%,雷公藤甲素组肿瘤抑制率为50.89%,雷公藤甲素组肿瘤抑制率明显高于吉西他滨组(P < 0.05)。见表 1。
| (n=10, x±s) | ||
| Group | Tumor weight(m/mg) | Inhibitory rate of tumor(η/%) |
| Control | - | - |
| Model | 3.36±0.42 | 0 |
| Gemcitabine | 2.47±0.66* | 26.49±3.47* |
| Triptolide | 1.65±0.27* | 50.89±6.14*△ |
| “-”:No data. * P < 0.05 compared with model group; △ P < 0.05 compared with gemcitabine group. |
||
对照组细胞正常;模型组肿瘤组织中肿瘤细胞结构完整,生长状态良好,有少量凋亡细胞,肿瘤组织侵袭到脂肪、肌层组织;吉西他滨组和雷公藤甲素组肿瘤细胞死亡明显增加,尤其雷公藤甲素组肿瘤细胞死亡数量最多,多数细胞核结构被破坏。见图 1(插页二)。
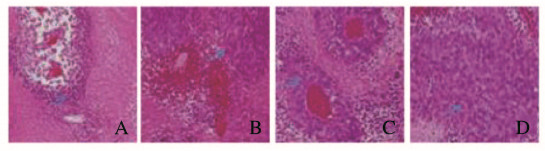
|
| A:Control group; B:Model group; C:Gemcitabine group; D:Triptolide group. 图 1 各组裸鼠肿瘤组织形态表现(HE, ×100) Fig. 1 Morphology of tumor tissue of nude mice in various groups (HE, ×100) |
|
|
与对照组比较,模型组裸鼠肿瘤组织中Bcl-2表达水平升高(P < 0.05),Bax表达水平明显降低(P < 0.05),而Bcl-2/Bax比值明显升高(P < 0.05);与模型组比较,雷公藤甲素组肿瘤组织中Bcl-2表达水平降低(P < 0.05),而Bcl-2/Bax比值明显降低(P < 0.05)。与吉西他滨组比较,雷公藤甲素组肿瘤组织中Bcl-2和Bax表达水平均升高(P < 0.05),但Bcl-2/Bax比值明显降低(P < 0.05)。见图 2(插页二)和表 2。
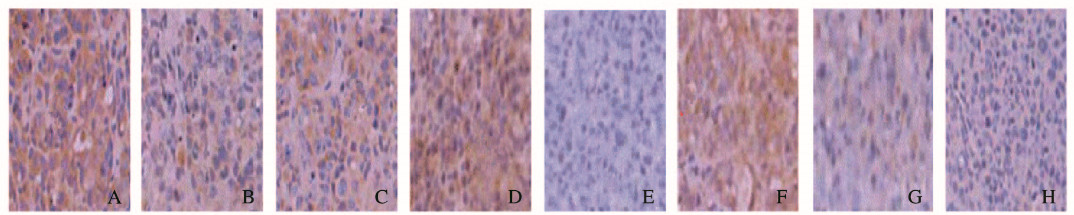
|
| A-D:Bcl-2;E-H:Bax; A, E:Control group; B, F:Model group; C, G:Gemcitabine group; D, H:Triptolide group. 图 2 各组裸鼠胰腺组织中凋亡相关蛋白Bax和Bcl-2的表达(免疫组织化学,×400) Fig. 2 Expressions of apoptosis-related proteins Bax and Bcl-2 in pancreas tissue of nude mice in various groups(Immunohistochemistry, ×400) |
|
|
| (n=10, x±s) | |||
| Group | Bax | Bcl-2 | Bcl-2/Bax |
| Control | 0.11±0.03 | 0.05±0.01 | 0.45±0.03 |
| Model | 0.04±0.01* | 0.15±0.03* | 3.75±0.37* |
| Gemcitabine | 0.06±0.02 | 0.08±0.02 | 1.33±0.16 |
| Triptolide | 0.10±0.02△# | 0.11±0.03△# | 1.10±0.11△# |
| * P < 0.05 compared with control group;△ P < 0.05 compared with model group;# P < 0.05 compared with gemcitabine group. | |||
与对照组比较,模型组裸鼠肿瘤组织中Bax、Caspase-9和Caspase-3蛋白表达水平均明显降低(P < 0.05),Bcl-2蛋白表达水平明显升高(P < 0.05);与模型组比较,雷公藤甲素组肿瘤组织中Bax、Caspase-9和Caspase-3蛋白表达水平均明显升高(P < 0.05),Bcl-2蛋白表达水平明显降低(P < 0.05)。与吉西他滨组比较,雷公藤甲素组肿瘤组织中Bcl-2蛋白表达水平明显降低(P < 0.05),Caspase-3蛋白表达水平明显升高(P < 0.05)。见图 3和表 3。

|
| Lane 1: Control group; Lane 2:Model group; Lane 3:Gemcitabine group; Lane 4:Triptolide group. 图 3 Western blotting法检测各组裸鼠胰腺组织中Bax、Bcl-2、Caspase-9和Caspase-3蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of Bax, Bcl-2, Caspase-9, and Caspase-3 proteins in pancreas tissue of nude mice in various groups detected by Western blotting method |
|
|
| (n=10, x±s) | ||||
| Group | Bax | Bcl-2 | Caspase-9 | Caspase-3 |
| Control | 0.71±0.02 | 0.19±0.02 | 0.89±0.07 | 0.92±0.06 |
| Model | 0.30±0.01* | 0.53±0.06* | 0.20±0.02* | 0.17±0.01* |
| Gemcitabine | 0.47±0.02 | 0.61±0.05 | 0.58±0.06 | 0.59±0.07 |
| Triptolide | 0.52±0.03△ | 0.28±0.03△# | 0.62±0.04△ | 0.71±0.09△# |
| * P < 0.05 compared with control group;△ P < 0.05 compared with model group;# P < 0.05 compared with gemcitabine group. | ||||
研究[5]显示:肿瘤的发生发展与细胞凋亡受阻存在密切关系。诱导肿瘤细胞凋亡是治疗恶性肿瘤的一个重要策略。研究[6-8]显示:雷公藤甲素能够强化恶性肿瘤坏死因子相关促凋亡配体,可以选择性杀死肿瘤细胞,同时对正常细胞无损伤。
凋亡是由多种基因参与调控的过程, 如Bcl-2家族和Caspase等[9-10]。Bcl-2家族是Caspase的上游信号, 其中Bcl-2是一种抗凋亡因子,而Bax是促凋亡因子,Bcl-2/Bax比值对细胞凋亡起平衡调控作用[11]。本研究结果显示:雷公藤甲素可通过下调Bcl-2蛋白表达和上调Bax蛋白表达,降低Bcl-2/Bax比值,从而对SW1990细胞移植瘤发挥促凋亡作用。
Caspase是一组半胱氨酸蛋白酶,在肿瘤细胞凋亡中发挥始动和效应作用[12-13],其中Caspase-9是细胞凋亡的起始者,Caspase-3是细胞凋亡过程中最主要的终末剪切酶,是细胞凋亡的执行者,Caspase-3的活化主要依靠Caspase-9的激活[14-15]。雷公藤甲素可激活人骨肉瘤细胞中凋亡蛋白Caspase-3和Caspase-9,促进聚腺苷二磷酸-核糖聚合酶的裂解,诱导人骨肉瘤细胞凋亡[16-19]。本研究结果显示:雷公藤甲素可明显激活人胰腺癌SW1990移植瘤组织中的Caspase-9,使Caspase-3表达水平明显上调,从而诱导细胞凋亡,与LI等[20]研究阿魏酸对人MGC-803癌细胞中Caspase-3、Bax和Bcl-2表达的影响趋势一致。
综上所述,雷公藤甲素能明显抑制SW1990胰腺癌荷瘤裸鼠肿瘤组织的生长,对胰腺癌SW1990细胞产生促凋亡作用,其机制可能与雷公藤甲素通过下调Bcl-2表达、促进Bax表达、降低Bcl-2/Bax比值、激活Caspase-9和Caspase-3有关联,说明雷公藤甲素对胰腺癌移植瘤具有诱导凋亡作用。
| [1] | ANTWI S O, PETERSEN G M. Leukocyte telomere length and pancreatic cancer risk:updated epidemiologic review[J]. Pancreas, 2018, 47(3): 265–271. DOI:10.1097/MPA.0000000000000995 |
| [2] | 武赞凯, 杜恒锐, 王振江, 等. 胰腺癌流行病学及诊治的研究进展[J]. 中南大学学报:医学版, 2017, 42(6): 713–719. |
| [3] | SHEN Y F, ZHANG X, WANG Y, et al. Celastrol targetsI RKs to block Toll-like 4-mediated nuclear factor-κB activation[J]. J Integr Med, 2016, 14(3): 203–208. DOI:10.1016/S2095-4964(16)60257-1 |
| [4] | 乔志新, 贺敏, 李伟静, 等. 雷公藤甲素诱导胰腺癌细胞凋亡[J]. 生物技术通讯, 2013, 24(4): 519–523. DOI:10.3969/j.issn.1009-0002.2013.04.017 |
| [5] | 郑婷婷, 焦丽静, 阙祖俊, 等. 中药诱导肿瘤凋亡相关机制研究进展[J]. 上海中医药杂志, 2016, 50(10): 103–109. |
| [6] | ZHANG Y, LI Z, BA W Q, et al. Dermal pharmacokinetic study of Fufang Leigongteng microemulsion gel by microdialysis combined with HPLC[J]. Pharm Today, 2015, 25(9): 620–623. |
| [7] | ZIAEI S, HAIABY R. Immunosuppressive, anti-inflam-matory and anti-cancer properties of triptolide:A minireview[J]. Avicenna J Phytomed, 2016, 6(2): 149–164. |
| [8] | WEI Y M, WANG Y H, XUE H Q, et al. Triptolide, a potential autophagy modulator[J]. Chin J Integr Med, 2019, 25(3): 233–240. DOI:10.1007/s11655-018-2847-z |
| [9] | VAZQUEZ-SANTILLAN K, MELENDEZ-ZAJGLA J, JIMENEZ-HERNANDEZ L, et al. NF-κB signaling in cancer stem cells:a promising therapeutic target?[J]. Cell Oncol (Dordr), 2015, 38(5): 327–339. |
| [10] | XI C, PENG S J, WU Z P, et al. Toxicity of triptolide and the molecular mechanisms involved[J]. Biomed Pharmacother, 2017, 90(3): 531–541. |
| [11] | 张艳, 李海龙, 王虎平, 等. 阿魏酸对人胃癌MGC-803细胞增殖的影响[J]. 中国中医药信息杂志, 2016, 23(9): 70–73. DOI:10.3969/j.issn.1005-5304.2016.09.017 |
| [12] | 陈豫民, 王琰, 韩轲, 等. bcl-2结合抗凋亡蛋白在食管癌中的表达及意义[J]. 山西医药杂志, 2015, 44(16): 1873–1875. |
| [13] | 孙云, 胡晓杰, 马国娟, 等. 胃癌组织中LMO1与Bcl-2、Bax、Survivin、Caspase-3蛋白表达的关系及意义[J]. 肿瘤学杂志, 2016, 22(9): 703–707. DOI:10.3760/cma.j.issn.1673-422X.2016.09.016 |
| [14] | 曹米兰, 吴有芳, 郭建军. 不同方法处理的九香虫对人胃癌SGC-7901细胞体外作用比较及其抑癌组分分布[J]. 生物资源, 2017, 39(5): 328–332. |
| [15] | 杨静, 凋亡相关基因Caspase-3、Caspase-9和c-IAP1在胃腺癌组织中的表达及意义[D].承德: 承德医学院, 2017. |
| [16] | 高德全, 张建波, 王联林, 等. 胃癌组织EZH2与凋亡相关蛋白Caspase-3、Bcl-2、Bax表达的关系及意义[J]. 现代中西医结合杂志, 2014, 23(15): 1615–1617. DOI:10.3969/j.issn.1008-8849.2014.15.007 |
| [17] | 张妍, 何航, 韩倩倩, 等. α-细辛醚对Eca-109细胞凋亡及XIAP、caspase-3表达的影响[J]. 郑州大学学报:医学版, 2017, 52(4): 377–380. |
| [18] | YU X L, ZHOU X, FU C L, et al. Celastrol induces apoptosis of human osteosarcoma cells via the mitochondrialapoptotic pathway[J]. Oncol Rep, 2015, 34(3): 1129–1136. DOI:10.3892/or.2015.4124 |
| [19] | CASC O R, FONSECA J E, MOITA L F. Celastrol:A spectrum of treatment opportunities in chronic diseases[J]. Front Med (Lausanne), 2017, 15(4): 69. |
| [20] | LI H Y, ZHANG J, SUN L L, et al. Celastrol induces apoptosis and autophagy via the ROS/JNK signaling pathway in human osteosarcoma cells:An in vitro and in vivo study[J]. Cell Death Dis, 2015, 22(6): e1604. |
 2019, Vol. 45
2019, Vol. 45


