扩展功能
文章信息
- 徐振华, 苏荣健
- XU Zhenhua, SU Rongjian
- 姜油酮联合索拉非尼对人肝癌HepG2细胞迁移和侵袭的抑制作用
- Inhibitory effects of zingerone combined with sorafenib on migration and invasion of human liver cancer HepG2 cells
- 吉林大学学报(医学版), 2019, 45(02): 228-233
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 228-233
- 10.13481/j.1671-587x.20190203
-
文章历史
- 收稿日期: 2018-07-23
2. 锦州医科大学生命科学研究院遗传学教研室, 辽宁 锦州 121000
2. Department of Genetics, School of Life Sciences, Jinzhou Medical University, Jinzhou 121000, China
肝细胞癌(hepatocellular carcinoma, HCC)是肝脏最常见的原发性恶性肿瘤[1],其起病隐匿、癌细胞向远端迁移和侵袭的能力强导致发现时多为晚期。索拉非尼是目前治疗肝癌的常用靶向药物[2],因其抑制肿瘤相关信号转导通路和血管生成等诸多优点而被广泛用于临床[3],但是由于靶向药物的单一性和癌症的多突变性,治疗效果并不理想。抑癌剂量的索拉非尼会导致患者生存质量明显下降,加重疾病负担,因此,如何平衡索拉非尼抑癌作用和提高生命质量便成为了临床研究中亟待解决的问题。随着中医学的发展,越来越多的中药被用于治疗各类常见疾病,尤以癌症的治疗研究最为普遍。姜油酮是一种稳定的干姜根茎活性成分,又名香草基丙酮[4]。植物姜是一种具有抗炎、抗氧化和抗癌特性的天然膳食香料[5],其成分姜油酮具有干扰肿瘤细胞能量代谢及抑制肿瘤细胞增殖的作用[6],但是其对人肝癌细胞的抑制作用目前尚不清楚。本实验观察姜油酮与索拉非尼联合应用对人肝癌HepG2细胞迁移和侵袭能力的影响,为临床减轻肝癌患者病痛和合理用药提供实验依据。
1 材料与方法 1.1 主要试剂和仪器抗基质金属蛋白酶2(MMP-2)和抗基质金属蛋白酶9(MMP-9) (兔源)购自于美国Cell Signal公司,高糖DMEM、青链霉素抗生素和胎牛血清购于美国Hyclone公司,蛋白酶抑制剂苯甲基磺酰氟(PMSF)购于美国Sigma公司,Transwell小室购于美国Costar公司,辣根过氧化物酶HRP标记的二抗购于北京中杉公司,索拉非尼购于德国Bayer Schering Pharma AG公司(批号:20130510),姜油酮购自美国Sigma-Aldrich公司(-20℃保存),MTT购自华美生物技术有限公司(使用时配制成质量浓度5 g·L-1)。酶标仪和SDS-PAGE蛋白电泳仪购于美国Bio-Rad公司,低温高速离心机购于美国Thermo公司。
1.2 细胞培养和分组人肝癌HepG2细胞系购自中科院细胞库。HepG2细胞培养于高糖DMEM(含10%FBS)中,在37℃、5%CO2条件下进行传代培养。实验分为2步:首先选择不同浓度姜油酮和索拉非尼(姜油酮浓度分别为0、5、10、15、30和50 μmol·L-1,索拉非尼浓度分别为0、3、5、10、15和20 μmol·L-1)单独应用观察细胞增殖能力的变化,然后根据其结果选择联合用药的合适浓度,分为对照组(0 μmol·L-1)、姜油酮组(30 μmol·L-1)、索拉非尼组(3 μmol·L-1)和联合组(姜油酮30 μmol·L-1+索拉非尼3μmol·L-1)。
1.3 MTT法检测各组细胞增殖率取生长状态良好的HepG2细胞,胰酶消化后接种于96孔板,保证每孔细胞数量为5×103个,姜油酮按0、5、10、15、30和50 μmol·L-1的浓度梯度给药处理,索拉非尼按0、3、5、10、15和20 μmol·L-1的浓度梯度给药处理,联合组按索拉非尼3 μmol·L-1和姜油酮0、5、10、15、30和50 μmol·L-1浓度梯度给药处理,培养24和48h,每孔加入20 μLMTT溶液(5 g·L-1),继续放入培养箱中4h,之后每孔加入DMSO150 μL,震荡混匀15 min, 在酶标仪490 nm处测量吸光度(A)值,计算细胞增殖率。细胞增殖率=实验组A值/对照组A值×100%。
1.4 划痕法检测各组细胞迁移能力取生长状态良好的HepG2细胞,胰酶消化后接种于6孔板,使每孔的细胞数量均匀,约为2×105个,待细胞贴壁伸展铺满底部后,用枪头小心地在底部做出均匀划痕,PBS轻轻漂洗3次之后在倒置显微镜下拍照作为0h,之后按12、24和48h的时间点在相同划痕部位拍照,使用ImageJ软件分析划痕面积,分别记为W0、W12、W24和W48,计算平均值并求出划痕愈合率。划痕愈合率=(W0-W48)/W0×100%。
1.5 Transwell实验检测各组细胞侵袭能力取Transwell 24孔板, 先使用FN包被下层。将生长状态良好的HepG2细胞用胰酶消化,使用0%FBS接种细胞于孔板上层,细胞数量约为1.5×103个, 下层培养液为含20%FBS的DMEM高糖培养基,在37℃、5%CO2条件下培养48 h, 吸除板中培养基, 小心擦去上层细胞, 4%甲醛固定后用1%结晶紫染色, 在显微镜下计数穿膜细胞数。
1.6 Western blotting法检测各组HepG2细胞中MMP-2和MMP-9蛋白表达水平加药方法同1.2,48 h后用细胞刮刀收集细胞,根据细胞沉淀量分别加入一定体积的RIPA裂解液(含1%PMSF),4℃、12000 r·min-1离心20 min后使用BCA定量,沸水煮5 min进行SDS-PAGE,转膜,5%BSA封闭1 h,按抗体说明书配制一抗并置于4℃摇床过夜,TBST洗膜3次后加入一定体积二抗,室温孵育1h,洗膜3次ECL发光,采用Bio-Rad凝胶成像,Chemi-genius凝胶成像系统分析MMP-2、MMP-9与β-actin的比值。
1.7 统计学分析采用SPSS20.0统计软件进行统计学分析。各组细胞增殖率、划痕愈合率、Transwell穿膜细胞数和细胞中MMP-2及MMP-9蛋白表达水平均符合正态分布,以x±s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组HepG2细胞增殖率通过MTT法分别检测姜油酮组、索拉非尼组和联合组HepG2细胞增殖能力。姜油酮以0、5、10、15、30和50 μmol·L-1浓度单独作用细胞,细胞增殖率由(91.89±2.88)%下降至(43.45±1.58)%。索拉非尼在10 μmol·L-1时的细胞增殖率为(45.54±2.87)%,已超过半数致死剂量;而在3 μmol·L-1时细胞增殖率为(88.05±1.52)%,对细胞活力无明显影响,因此后续实验选择索拉非尼浓度为3 μmol·L-1。在姜油酮浓度为30 μmol·L-1时,与姜油酮单独用药组比较,联合组HepG2细胞增殖率明显下降。所以后续实验选用30 μmol·L-1姜油酮,3 μmol·L-1索拉非尼,而联合组为30 μmol·L-1姜油酮+3 μmol·L-1索拉非尼。见表 1。
| (n=5, x±s, η/%) | |
| Group | Proliferation rate |
| Zingerone(μmol·L-1) | |
| 0 | 100.00±2.23 |
| 5 | 91.89±2.88* |
| 10 | 87.17±1.94* |
| 15 | 75.53±3.54** |
| 30 | 59.19±1.42** |
| 50 | 43.45±1.58* |
| Sorafenib(μmol·L-1) | |
| 0 | 100.00±3.15 |
| 3 | 88.05±1.52** |
| 5 | 76.43±1.08** |
| 10 | 45.54±2.87** |
| 15 | 34.29±2.10** |
| 20 | 27.08±1.76** |
| Zingerone(μmol·L-1)+ Sorafenib(μmol·L-1) | |
| 0+3 | 100.00±2.67 |
| 5+3 | 85.40±2.36** |
| 10+3 | 72.03±1.25** |
| 15+3 | 60.08±1.05** |
| 30+3 | 47.40±2.12** |
| 50+3 | 24.87±1.56** |
| * P < 0.05,* * P < 0.01 compared with 0 μmol·L-1group. | |
联合组HepG2细胞划痕间距明显大于其他3组,细胞向划痕处迁移生长的数量减少。见图 1。划痕实验48 h后,对照组和姜油酮组HepG2细胞划痕愈合率分别为(80.00±2.52)%和(55.00±2.08)%, 姜油酮组划痕愈合率明显低于对照组(P < 0.05);联合组HepG2细胞划痕愈合率为(19.00±2.30)%,低于姜油酮组和索拉非尼组(69.00%±3.10%)(P < 0.01)。

|
| A:Control group; B:Zingerone group; C:Sorafenib group D:Combination group. 图 1 划痕实验检测各组HepG2细胞迁移能力(×100) Fig. 1 Migration abilities of HepG2 cells in various groups detected by wound scratch assay(×100) |
|
|
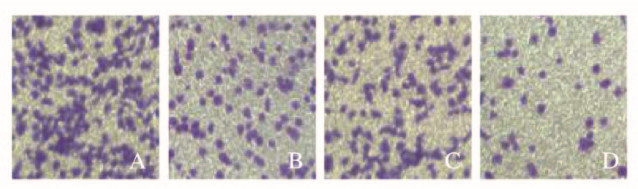
Transwell实验48h后,对照组HepG2细胞穿膜细胞数为(78±6)个,姜油酮组和索拉非尼组穿膜细胞数分别为(34±3)和(56±4)个,明显少于对照组(P < 0.05或P < 0.01);联合组穿膜细胞数为(15±2)个,明显少于姜油酮组和索拉非尼组(P < 0.01)。见图 2(插页二)。
|
| A:Control group; B:Zingerone group; C:Sorafenib group; D:Combination group. 图 2 Transwell实验检测各组HepG2细胞侵袭能力(结晶紫, ×100) Fig. 2 Invasion abilities of HepG2 cells in various groups detected by Transwell assay(Crystal violet, ×100) |
|
|
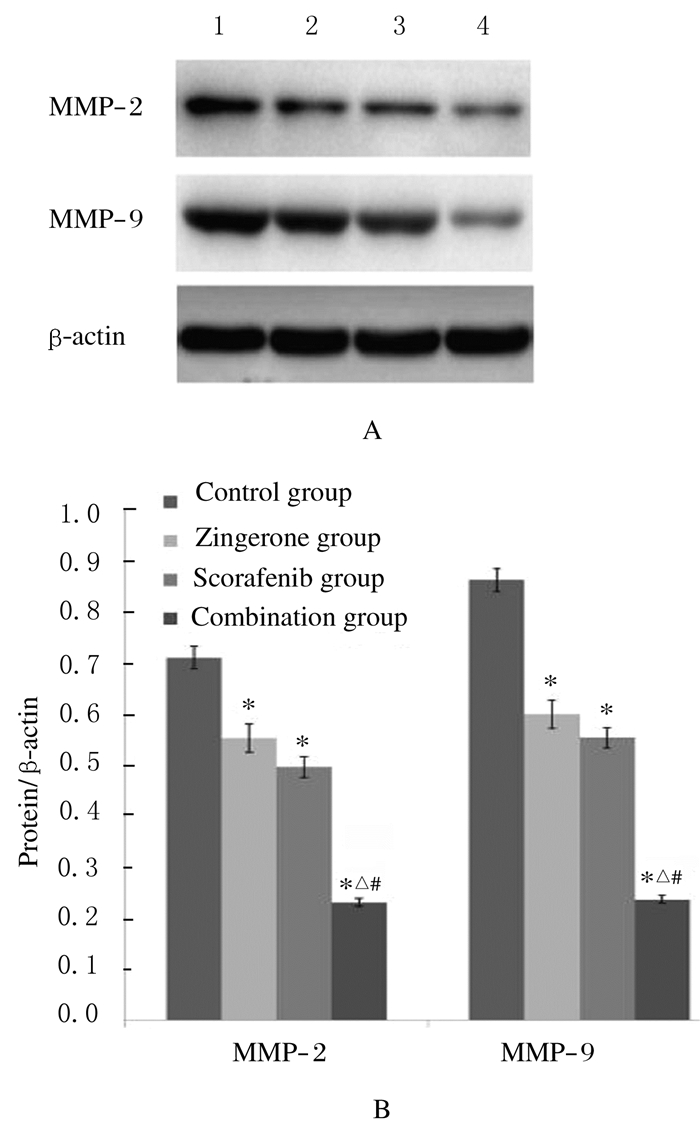
与对照组比较,姜油酮组、索拉非尼组和联合组HepG2细胞中MMP-2和MMP-9表达水平明显降低(P < 0.05);与姜油酮组和索拉非尼组比较,联合组HepG2细胞中MMP-2和MMP-9蛋白表达水平明显降低(P < 0.01)。见图 3。
|
| Lane1:Control group; Lane 2:Zingerone group; Lane 3:Sorafenib grouop; Lane 4:Combination group.*P < 0.05 compared with control group; △P < 0.05 compared zingerone group; #P < 0.01compared with sorafenib group. 图 3 各组HepG2细胞中MMP-2和MMP-9蛋白表达电泳图(A)和直条图(B) Fig. 3 Electrophoregram(A)and histogram(B) of expressions of MMP-2 and MMP-9 proteins in HepG2 cells in various groups |
|
|
HCC是导致癌症相关死亡的第三大原因[7],其突出特点是具有高度迁移和侵袭能力[8],癌细胞的迁移使正常组织细胞稳态遭到破坏,在迁移器官或组织处无限增殖,抑制机体正常的生理功能,失去治疗机会。促进癌细胞凋亡是目前抗肿瘤药物研发的重要机制之一,其中促进凋亡的方法除了抑制周围血管生成、减少细胞所需的必要营养之外,还有各种靶向药物的研究开发。索拉非尼是目前临床上常用的治疗肝癌药物之一,主要用于不能手术的晚期肝癌患者,但治疗有效率仅为30%左右[9]。
生姜作为辅食之外也是一种新鲜草药,常被用于治疗头痛、恶心和腹泻等疾病[10-12]。生姜含有活性酚类化合物,如姜酚和姜油酮等,这些化合物具有抗氧化、抗血管生成和抗动脉粥样硬化等功能[13]。姜油酮可抑制核转录因子κB (nuclear factor κB, NK-κB)的核转位[14],降低ERK 1/2的活化[15],在大鼠结肠癌中具有抗肿瘤功能[16]。本研究采用浓度梯度的姜油酮单体处理人肝癌HepG2细胞,随着姜油酮浓度的增加,细胞增殖率逐渐降低,在50 μmol·L-1时基本达到半数致死剂量。为了达到更好地抑癌效果而非无限增大用药剂量,本研究将3 μmol·L-1索拉非尼与姜油酮联合使用,联合后各浓度梯度下姜油酮抑癌效果均有很大提升,姜油酮30 μmol·L-1时已接近半数致死量,即联合组达到了单独用药组高剂量时才能具有的抑癌效果。为进一步观察姜油酮是否具有抑制迁移和侵袭的能力,在后续实验中选用姜油酮30 μmol·L-1联合索拉非尼3 μmol·L-1作为联合用药组,结果显示联合组具有更加显著的抑制细胞迁移和侵袭的效果。
肿瘤细胞和周围基质产生的基质金属蛋白酶(matrix metalloproteinase,MMPs)[17]是一类需要Ca2+和Zn2+辅助的内肽酶家族成员,能够降解基底膜和细胞外基质(extracellular matrix, ECM)中的Ⅳ型胶原、层黏连蛋白和弹性蛋白等成分[18-19],从而促进癌细胞对邻近和远端组织的迁移和侵袭。在超过20个MMPs成员中,有关MMP-2和MMP-9研究的最为广泛[20]。研究[21-24]显示:MMP-2还可水解其他生物活性分子,如生长因子和细胞因子等;MMP-9表达水平与人肝癌细胞的侵袭能力呈明显正相关关系,其在肝癌组织中的表达水平明显高于癌旁组织及正常肝组织。研究[25]显示:MMP-2和MMP-9在细胞内的表达水平与细胞的迁移和侵袭能力有关。为了明确姜油酮抑制迁移、侵袭与MMPs的关系,本研究采用Western blotting法检测各组HepG2细胞中MMP-2和MMP-9蛋白表达水平,结果显示:与对照组比较,姜油酮组MMP-2和MMP-9蛋白表达水平下降,联合组蛋白表达水平下降更加明显。因此本文作者认为:姜油酮可以抑制人肝癌细胞的迁移和侵袭能力,且与低浓度的索拉非尼联用效果更加明显;姜油酮可通过降低MMP-2和MMP-9蛋白的表达抑制肝癌细胞的迁移和侵袭。
综上所述,本研究证明了姜油酮具有一定的抑癌作用,而且随着浓度的增加,对肝癌细胞迁移和侵袭能力的抑制作用进一步加强;当姜油酮浓度固定时,低浓度的索拉非尼与之联用可明显降低肝癌细胞的迁移和侵袭能力。关于姜油酮和索拉非尼的具体作用机制还有待后续研究,且联合用药在动物体内是否具有抑癌作用并减少不良反应还需要深入研究。
| [1] | OOKA Y, MIHO K, SHUNTARO O, et al. Prediction of the very early occurrence of HCC right after DAA therapy for HCV infection[J]. Hepatol Int, 2018, 12(6): 523–530. DOI:10.1007/s12072-018-9895-5 |
| [2] | LEE S, CHO Y Y, CHO E J, et al. Synergistic effect of ursodeoxycholic acid on the antitumor activity of sorafenib in hepatocellular carcinoma cells via modulation of STAT3 and ERK[J]. Int J Mol Med, 2018, 42(5): 2551–2559. |
| [3] | LO J, LAU E Y, CHING R H, et al. Nuclear factor kappa B-mediated CD47 up-regulation promotes sorafenib resistance and its blockade synergizes the effect of sorafenib in hepatocellular carcinoma in mice[J]. Hepatology, 2015, 62(2): 534–545. DOI:10.1002/hep.v62.2 |
| [4] | WEE S L, PEEK T, CLARKE A R. The responsiveness of Bactrocera jarvisi (Diptera:Tephritidae) to two naturally occurring phenylbutaonids, zingerone and raspberry ketone[J]. J Insect Physiol, 2018, 109: 41–46. DOI:10.1016/j.jinsphys.2018.06.004 |
| [5] | CUI Y, SHI Y, BAO Y, et al. Zingerone attenuates diabetic nephropathy through inhibition of nicotinamide adenine dinucleotide phosphate oxidase 4[J]. Biomed Pharmacother, 2018, 99: 422–430. DOI:10.1016/j.biopha.2018.01.051 |
| [6] | KIM Y J, JEON Y, KIM T, et al. Combined treatment with zingerone and its novel derivative synergistically inhibits TGF-β1 induced epithelial-mesenchymal transition, migration and invasion of human hepatocellular carcinoma cells[J]. Bioorg Med Chem Lett, 2017, 27(4): 1081–1088. DOI:10.1016/j.bmcl.2016.12.042 |
| [7] | RAOUL J L, KUDO M, FINN R S, et al. Systemic therapy for intermediate and advanced hepatocellular carcinoma:Sorafenib and beyond[J]. Cancer Treat Rev, 2018, 68: 16–24. DOI:10.1016/j.ctrv.2018.05.006 |
| [8] | CHOWDHURY S M, LEE T, BACHAWAL S V, et al. Longitudinal assessment of ultrasound-guided complementary microRNA therapy of hepatocellular carcinoma[J]. J Control Release, 2018, 281: 19–28. DOI:10.1016/j.jconrel.2018.05.009 |
| [9] | 乔宪伟, 王柯萌, 杨月娥. 索拉非尼对中晚期肝癌介入治疗患者生存率及不良反应的临床疗效分析[J]. 北方药学, 2018, 15(7): 158. DOI:10.3969/j.issn.1672-8351.2018.07.133 |
| [10] | URIARTE I, INSAUSTI A, COCINERO E J, et al. Competing dispersive interactions:From small energy differences to large structural effects in methyl jasmonate and zingerone[J]. J Phys Chem Lett, 2018, 9(20): 5906–5914. DOI:10.1021/acs.jpclett.8b02339 |
| [11] | ERNST E, PITTLER M H. Efficacy of ginger for nausea and vomiting:a systematic review of randomized clinical trials[J]. Br J Anaesth, 2000, 84(3): 367–371. DOI:10.1093/oxfordjournals.bja.a013442 |
| [12] | PALATTY P L, HANIADKA R, VALDER B, et al. Ginger in the prevention of nausea and vomiting:a review[J]. Crit Rev Food Sci Nutr, 2013, 53(7): 659–669. DOI:10.1080/10408398.2011.553751 |
| [13] | MIN G, KU S K, LEE T, et al. Suppressive effects of zingerone on TGFBIp-mediated septic responses[J]. Arch Pharm Res, 2018, 41(3): 276–287. DOI:10.1007/s12272-017-0919-9 |
| [14] | KANDEMIR F M, YILDIRIM S, KUCUKLER S, et al. Therapeutic efficacy of zingerone against vancomycin-induced oxidative stress, inflammation, apoptosis and aquaporin 1 permeability in rat kidney[J]. Biomed Pharmacother, 2018, 105: 981–991. DOI:10.1016/j.biopha.2018.06.048 |
| [15] | LEE J, OH S W, SHIN S W, et al. Zingerone protects keratinocyte stem cells from UVB-induced damage[J]. Chem Biol Interact, 2018, 279: 27–33. DOI:10.1016/j.cbi.2017.11.004 |
| [16] | CHOI J S, RYU J, BAE W Y, et al. Zingerone suppresses tumor development through decreasing cyclin D1 expression and inducing mitotic arrest[J]. Int J Mol Sci, 2018, 19(9): E2832.. DOI:10.3390/ijms19092832 |
| [17] | HE X X, SHI L L, QIU M J, et al. Molecularly targeted anti-cancer drugs inhibit the invasion and metastasis of hepatocellular carcinoma by regulating the expression of MMP and TIMP gene families[J]. Biochem Biophys Res Commun, 2018, 504(4): 878–884. DOI:10.1016/j.bbrc.2018.08.203 |
| [18] | 刘霞, 齐凤杰, 杜晓媛. 沉默CRAF基因表达对肝癌细胞侵袭和迁移的影响[J]. 吉林大学学报:医学版, 2018, 44(3): 521–525. |
| [19] | 杨安强, 杨晓滨, 李平, 等. 脑膜瘤组织中CLDN6基因表达量与MMPs/TIMPs、EMT基因表达量的相关性研究[J]. 海南医学院学报, 2017, 23(17): 2419–2422. |
| [20] | ZHOU M, LIU X J, LI Z H, et al. Caspase-3 regulates the migration, invasion and metastasis of colon cancer cells[J]. Int J Cancer, 2018, 143(4): 921–930. DOI:10.1002/ijc.31374 |
| [21] | 芮昆昆, 章波, 邰小华, 等. 基质金属蛋白酶2与蛋白磷酸酶2A的癌性抑制因子在胃癌中的研究进展[J]. 医学信息, 2018, 31(3): 21–24. |
| [22] | 李杰, 肖达, 李智奇. 基质金属蛋白酶9基因在肝癌细胞株、肝细胞肝癌组织中的表达及意义[J]. 中国卫生工程学, 2018, 17(3): 351–353. |
| [23] | 陈小梦, 闫昊, 左子欣, 等. 癌组织中MMP-9的表达对食管癌诊断价值的meta分析[J]. 郑州大学学报:医学版, 2018, 53(5): 642–647. |
| [24] | 陈薇, 陈靖, 游佳, 等. MMP-9及glypican-3在肝癌组织中的表达及其临床病理价值[J]. 西安交通大学学报:医学版, 2018, 39(3): 392–395. |
| [25] | STUELTEN C H, PARENT C A, MONTELL D J. Cell motility in cancer invasion and metastasis:insights from simple model organisms[J]. Nat Rev Cancer, 2018, 18(5): 296–312. DOI:10.1038/nrc.2018.15 |
 2019, Vol. 45
2019, Vol. 45


