扩展功能
文章信息
- 任明, 张妍, 李容杭, 李秋菊
- REN Ming, ZHANG Yan, LI Ronghang, LI Qiuju
- 银杏叶提取物对辐射损伤小鼠脾脏氧化应激和蛋白激酶C活性的影响
- Effect of Ginkgo biloba L. extract on oxidative stress and activity of protein kinase C in spleen tissue of mice with irradiation damage
- 吉林大学学报(医学版), 2019, 45(02): 223-227
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 223-227
- 10.13481/j.1671-587x.20190202
-
文章历史
- 收稿日期: 2018-06-25
随着核能、放射源和射线等在各行业领域的广泛应用,电离辐射对人类健康的危害越来越受到重视[1-2]。辐射可造成人体免疫系统、造血系统和神经系统等一个或多个系统损伤[3-5],因而寻找低毒高效的抗辐射损伤药物一直是放射医学亟待解决的问题。银杏叶是天然的药食两用植物,银杏叶提取物(Ginkgo biloba L. extract, GBE)主要由黄酮类和萜类内酯化合物组成,具有清除自由基、抗氧化、增强机体免疫功能以及改善微循环等多方面的生理活性[6-8]。有研究[9-11]显示:GBE可通过调节caspase-3信号通路来拮抗辐射导致的骨髓间充质干细胞凋亡,降低辐射损伤小鼠骨髓细胞微核出现率和染色体畸变率,减轻辐射对肝脏合成功能的损伤,降低肝脏组织中丙二醛(malonaldehyde,MDA)水平,提高超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)活性。然而,针对GBE对免疫系统辐射损伤保护的机制探讨国内外尚未见报道。本研究利用辐射损伤小鼠模型,探讨GBE对辐射损伤小鼠脾脏氧化应激和蛋白激酶C(protein kinase C,PKC)活性的影响,阐明GBE对免疫系统损伤的保护作用及其机制。
1 材料与方法 1.1 实验动物和主要试剂清洁级健康ICR小鼠购自吉林大学动物实验中心,动物合格证号:SCXK(吉)2013-0001,6~8周龄,体质量18~22 g,雌雄各半。GBE购自德国威玛舒培博士药厂,BCA蛋白定量试剂盒购自北京碧云天生物有限公司,SOD试剂盒购自南京建成生物工程研究所,PKC ELISA试剂盒购自美国R & D公司,三氯乙酸、硫代巴比妥酸和氢氧化钠等化学试剂购自中国国药集团化学试剂有限公司。
1.2 实验动物分组将60只ICR小鼠适应性喂养1周,随机分为5组,每组12只,分别为空白对照(NC)组、辐射对照(IC)组、低剂量GBE(IC + GBEL)组、中剂量GBE(IC + GBEM)组和高剂量GBE(IC + GBEH)组。NC组小鼠腹腔注射生理盐水;IC组小鼠腹腔注射生理盐水,4.0 Gy γ线照射;IC + GBEL组小鼠腹腔注射GBE 5.0 mg·kg-1,4.0 Gy γ线照射;IC + GBEM组小鼠腹腔注射GBE 10.0 mg·kg-1,4.0 Gy γ线照射;IC + GBEH组小鼠腹腔注射GBE 20.0 mg·kg-1,4.0 Gy γ线照射。连续给予GBE 14 d,第15天除NC小鼠外均接受总剂量为4.0 Gy的γ射线全身照射,并于照射后24 h取各组小鼠脾组织用于后续实验。
1.3 各组小鼠脾脏组织中MDA水平检测MDA是机体脂质过氧化产物的终产物。取新鲜的脾脏组织,用冰冷的生理盐水制成10%匀浆液,4℃、10 000 g离心20 min,收集上清液,取0.5 mL上清液转至新离心管中,加入20%三氯乙酸1.0 mL,再加入1%硫代巴比妥酸0.5 mL,沸水浴40 min,冷却至室温后加入2 mL抽提液正丁醇,3000 r·min-1离心10 min,取上清液于535 nm处测定吸光度(A)值。
1.4 各组小鼠脾脏组织中SOD活性测定取新鲜的脾脏组织,制备脾脏匀浆上清液,应用SOD试剂盒测定SOD活性,严格按照其说明书操作。
1.5 各组小鼠脾脏组织中过氧化氢酶(catalase, CAT)活性测定采用改良比色法测定CAT活性。取0.1 mL脾匀浆上清液作为样品管,另取0.1 mL脾匀浆上清液作为样品空白管,样品管和空白试剂管加入0.2 mol·L-1 H2O2,再向各管中加入0.01 mol·L-1、pH 7.0磷酸盐缓冲液,充分反应1 min后加入5%重铬酸钾-冰醋酸混合液,沸水浴10 min,冷却后用酶标仪测定570 nm处A值。
1.6 各组小鼠脾脏组织中谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-px)活性测定采用二硫代双硝基苯甲酸(DTNB)直接显色法测定GSH-px活力。取0.1 mL脾匀浆液,100℃变性,作为对照管;另取0.1 mL脾匀浆液作为样品管;两管中均加入1.0 mmol·L-1还原型谷胱甘肽0.1 mL,37℃水浴5 min,加入1.25 mmol·L-1过氧化氢溶液0.05 mL,37℃反应3 min,加入0.61 mol·L-1三氯乙酸溶液1mL,反应10 min后,3000 g离心10 min,取0.5 mL上清液,加入4 mol·L-1氢氧化钠溶液0.03 mL、0.32 mol·L-1磷酸氢二钠溶液0.625 mL和1 mmol·L-1 DTNB显色液0.125 mL,充分反应8 min后,用酶标仪测定412 nm处A值。
1.7 ELISA法检测各组小鼠脾脏组织中PKC活性取脾脏加入预冷的磷酸盐缓冲液,用匀浆器将脾脏组织粉碎研磨成匀浆,3000 r·min-1离心15 min,取上清液, 严格按ELISA试剂盒说明书操作。
1.8 免疫组织化学法检测各组小鼠脾脏组织中8-羟基脱氧鸟嘌呤(8-hydroxy-2 deoxyguanosine, 8-OHdG)表达水平取在4%多聚甲醛中固定的脾脏组织进行石蜡包埋、切片、烘烤及常规脱蜡脱水;切片放入0.01 mol·L-1枸橼酸盐缓冲液中,微波炉加热10 min;取出冷却5 min,再加热5 min,再冷却,PBS洗3次,每次3 min;加3% H2O2去离子水室温孵育10 min,消除内源性过氧化物酶的活性;山羊血清封闭;二抗孵育;DAB显色;苏木精复染,酒精梯度脱水,二甲苯透明,中性树胶封片,晾干,显微镜下观察各组小鼠脾脏中8-OHdG表达情况,在400倍视野下计数每张脾组织切片脾细胞的阳性细胞数,求其平均值。
1.9 统计学分析应用SPSS 17.0统计软件进行统计学分析。各组小鼠脾脏组织中MDA水平、8-OHdG表达水平以及SOD、CAT和PKC活性以x±s表示,各组数据均呈正态分布,组间均数两两比较采用方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠脾脏组织中MDA水平与NC组比较,IC组和各剂量GBE组小鼠脾脏组织中MDA水平明显升高(P < 0.05)。与IC组比较,各剂量GBE组小鼠脾脏组织中MDA水平明显降低(P < 0.05),且IC + GBEH组低于IC+GBEL和IC+GBEM组(P < 0.05)。见表 1。
| (n=12, x±s) | |||||
| Group | MDA [cB/(mmol·L-1)] | SOD [λB/(U·mg-1)] | CAT [λB/(U·mg-1)] | GSH-px [λB/(U·mg-1)] | PKC [ρB/(μg·L-1)] |
| NC | 1.172±0.157 | 138.733±13.085 | 0.369±0.036 | 48.188±4.942 | 1.337±0.196 |
| IC | 3.027±0.295* | 81.371±7.321* | 0.161±0.016* | 25.183±3.243* | 0.615±0.099* |
| IC+GBEL | 2.471±0.251*△# | 93.268±6.630*△# | 0.185±0.015*△# | 28.180±3.452*△# | 0.744±0.099*△# |
| IC+GBEM | 2.072±0.185*△# | 107.533±8.436*△# | 0.262±0.038*△# | 34.305±3.136*△# | 0.903±0.070*△# |
| IC+GBEH | 1.678±0.207*△ | 126.735±12.033*△ | 0.306±0.026*△ | 41.375±3.437*△ | 1.122±0.086*△ |
| *P<0.05 vs NC group; △P < 0.05 vs IC group; #P < 0.05 vs IC+GBEH group. | |||||
与NC组比较,IC组和各剂量GBE组小鼠脾脏组织中SOD、CAT、GSH-px和PKC活性明显降低(P < 0.05)。与IC组比较,各剂量GBE组小鼠脾脏组织中SOD、CAT、GSH-px和PKC活性明显升高(P < 0.05),且IC + GBEH组高于IC+GBEL和IC+GBEM组(P < 0.05)。见表 1。
2.3 各组小鼠脾脏组织中8-OHdG表达水平与NC组比较,IC组小鼠脾脏组织中8-OHdG表达水平明显升高(P < 0.05);与IC组比较,各剂量GBE组小鼠脾脏组织中8-OHdG表达水平明显降低(P < .05),且IC+GBEH组高于于IC+GBEL和IC+GBEM组(P < 0.05)。见图 1(插页一)和2。
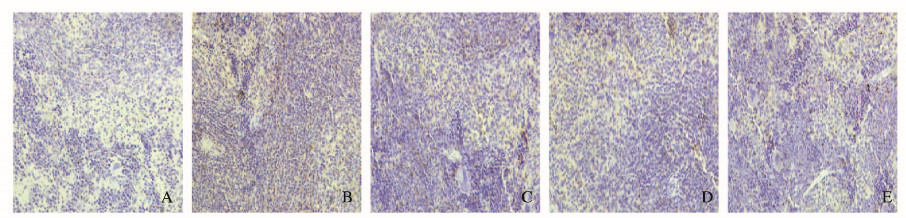
|
| A:NC group; B:IC group; C:IC + GBEL group; ):IC + GBEM group; E:IC + GBEH group. 图 1 各组小鼠脾脏组织中8-OHdG的表达(免疫组织化学, ×400) Fig. 1 Expressions of 8-OHdG in spleen tissue of mice in various groups(Immunohistochemistry, ×400) |
|
|
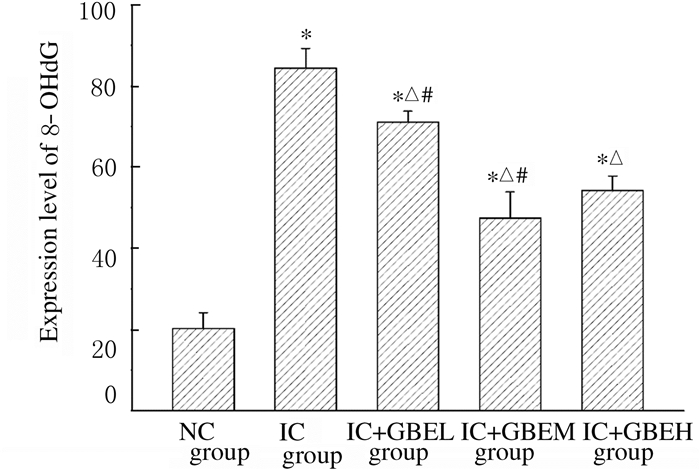
|
| *P < 0.05 vs NC group; △P < 0.05 vs IC group; #P < 0.05 vs IC+GBEH group. 图 2 各组小鼠脾脏组织中8-OhdG表达水平 Fig. 2 Expression levels of 8-OHdG in spleen tissue of mice in various groups |
|
|
辐射损伤对机体的主要危害之一是免疫系统损伤,特别是辐射产生过量的自由基对机体的损伤效应[12-14]。脾脏是机体重要的免疫器官,是各种免疫细胞发生、分化、发育以及成熟的场所,当机体受到外界抗原刺激后会在脾脏内发生免疫应答,通过产生各类免疫细胞和免疫分子来清除抗原,对于维持机体免疫功能起着重要作用。脾脏对电离辐射极为敏感,辐射损伤引起的免疫系统功能低下可持续存在数年、数十年,甚至终身,不断加重机体的免疫障碍,并且加速机体的衰老和死亡。
GBE具有广泛的生物学效应,尤其是抗氧化作用和清除自由基活性。体外细胞实验研究[15-19]表明:GBE可清除各类氧自由基,抑制脂质过氧化及提高抗氧化酶的活性。MDA是组织脂质过氧化产物的终产物之一,其水平越高,机体氧化损伤程度就越重。8-OHdG是DNA碱基被氧化修饰后形成的产物,其水平与机体DNA氧化损伤程度成正比[20]。本研究中,预防性给予小鼠腹腔注射GBE,然后给予4.0 Gy γ射线照射,结果表明:受辐照小鼠的免疫功能受到明显的影响,与NC组比较,接受照射的各组小鼠脾组织中抗氧化物酶活性明显下降;与IC组比较,给予GBE的各组小鼠脾组织中MDA水平明显下降,8-OHdG表达水平明显下降,SOD、CAT和GSH-Px等抗氧化物酶活性明显升高,说明GBE能够拮抗辐射对机体免疫器官造成的氧化损伤。PKC是丝氨酸/苏氨酸蛋白激酶家族成员之一,广泛分布于真核细胞,特别是哺乳动物细胞中,在细胞信息传递、离子通道调节、细胞生长分化、代谢以及转录激活等方面具有重要作用[21-24]。本研究结果显示:预防性给予中和高剂量GBE的小鼠,在接受4.0 Gy γ射线照射后,与NC组比较,接受照射的各组小鼠脾组织中PKC活性明显下降;与IC组比较,给予GBE的各组小鼠脾组织中蛋白激酶C活性均明显升高,说明GBE可以拮抗照射导致的PKC活性下降,从而增强脾脏细胞生长分化及代谢等功能。
综上所述,GBE可以抑制辐射损伤小鼠脾脏内的氧化应激,调节恢复脾脏PKC活性,从而增强脾脏的免疫功能。本研究结果为预防和治疗辐射损伤药物的研发提供了实验依据。
| [1] | 曲功霖, 李辰, 邵帅, 等. 四君子汤对电离辐射损伤的防治作用[J]. 癌变·畸变·突变, 2017, 29(4): 295–299. DOI:10.3969/j.issn.1004-616x.2017.04.010 |
| [2] | PURBEY P K, SCUMPIA P O, KIM P J, et al. Defined sensing mechanisms and signaling pathways contribute to the global inflammatory gene expression output elicited by ionizing radiation[J]. Immunity, 2017, 47(3): 421–434. DOI:10.1016/j.immuni.2017.08.017 |
| [3] | GAJOWIK A, DOBRZYNSKA M M. The evaluation of protective effect of lycopene against genotoxic influence of X-irradiation in human blood lymphocytes[J]. Radiat Environ Biophys, 2017, 56(4): 413–422. DOI:10.1007/s00411-017-0713-6 |
| [4] | 韩晓亮, 蒲国华, 李宝永, 等. 丙泊酚对电离辐射引起小鼠造血系统损伤的防护作用[J]. 国际药学研究杂志, 2016, 43(5): 931–934. |
| [5] | 杨龙, 王奕萍, 荣曙, 等. 电离辐射对大鼠脑皮质牛磺酸、谷氨酸及其谷氨酸阳性神经元的影响[J]. 中国辐射卫生, 2006, 15(4): 402–404. DOI:10.3969/j.issn.1004-714X.2006.04.008 |
| [6] | 宋军, 朱燕梅, 王秋林. 银杏叶提取物对小鼠心肌细胞氧化应激损伤的影响[J]. 成都医学院学报, 2017, 12(3): 260–264. DOI:10.3969/j.issn.1674-2257.2017.03.005 |
| [7] | 王冠, 耿丽晶, 陈博, 等. 不同前处理方式对银杏叶中过氧化氢酶活性的影响[J]. 饲料研究, 2016(18): 34–38. |
| [8] | WANG Z, ZHANG J L, REN T K, et al. Targeted metabolomic profiling of cardioprotective effect of Ginkgo biloba L. extract on myocardial ischemia in rats[J]. Phytomedicine, 2016, 23(6): 621–631. DOI:10.1016/j.phymed.2016.03.005 |
| [9] | 宋媛媛, 吕欣, 高春时, 等. 银杏叶提取物对电离辐射下大鼠骨髓间充质干细胞的保护作用机制研究[J]. 中国实验诊断学, 2016, 20(8): 1235–1239. |
| [10] | 陈家柏, 伍炜培. 银杏叶提取物与茶多酚对辐射损伤的协同保护作用[J]. 中药材, 2004, 27(9): 664–665. DOI:10.3321/j.issn:1001-4454.2004.09.018 |
| [11] | 金虹, 黄毅, 王继生, 等. 银杏叶提取物对辐射损伤小鼠的保护作用[J]. 中草药, 2010, 41(8): 1339–1342. |
| [12] | 方连英, 王彦, 徐畅, 等. 电离辐射诱导造血干细胞损伤的分子机制研究进展[J]. 基础医学与临床, 2017, 37(2): 256–260. DOI:10.3969/j.issn.1001-6325.2017.02.036 |
| [13] | MULINACCI N, VALLETTA A, PASQUALETTI V, et al. Effects of ionizing radiation on bio-active plant extracts useful for preventing oxidative damages[J]. Nat Prod Res, 2018: 1–9. |
| [14] | SUMAN S, KUMAR S, FORNACE A J, et al. The effect of carbon irradiation is associated with greater oxidative stress in mouse intestine and colon relative to γ-rays[J]. Free Radic Res, 2018, 16: 1–11. |
| [15] | 袁茵, 王辉, 鲁欣. 银杏叶提取物对叔丁基过氧化氢损伤人脐带间充质干细胞的干预作用[J]. 广州中医药大学学报, 2015, 32(3): 458–463. |
| [16] | 王如科, 孙源源, 韩建一, 等. 银杏叶提取物对过氧化氢刺激下的血管内皮细胞的影响[J]. 现代生物医学进展, 2014, 14(26): 5038–5041, 5048. |
| [17] | ZHAO M, WANG X X, WAN W H. Effects of the ginkgo biloba extract on the superoxide dismutase activity and apoptosis of endothelial progenitor cells from diabetic peripheral blood[J]. Genet Mol Res, 2014, 13(1): 220–227. DOI:10.4238/2014.January.14.1 |
| [18] | WANG A, YANG Q W, LI Q J, et al. Ginkgo biloba L. extract reduces H2O2-induced bone marrow mesenchymal stem cells cytotoxicity by regulating mitogen-activated protein kinase (MAPK) signaling pathways and oxidative stress[J]. Med Sci Monit, 2018, 24: 3159–3167. DOI:10.12659/MSM.910718 |
| [19] | 王俊妹, 孙千月, 吴哲, 等. 银杏叶提取物对破骨细胞分化和骨吸收的作用及其机制[J]. 吉林大学学报:医学版, 2017, 43(6): 1130–1136. |
| [20] | HUANG S X, QIU G Z, CHENG F R, et al. Berberine protects secondary injury in mice with traumatic brain injury through anti-oxidative and anti-inflammatory modulation[J]. Neurochem Res, 2018, 43(9): 1814–1825. DOI:10.1007/s11064-018-2597-5 |
| [21] | 刘勇, 黄蔚初, 程绪浩, 等. 电磁辐射对家兔小脑蛋白激酶C活力的影响[J]. 环境与健康杂志, 2008, 25(9): 781–783. DOI:10.3969/j.issn.1001-5914.2008.09.010 |
| [22] | 刘春明, 李德新, 吕爱萍, 等. 脾阳虚大鼠肝脾蛋白激酶C活性的实验研究[J]. 辽宁中医杂志, 2000, 27(1): 44–45. |
| [23] | 赵忆宁, 何颖, 沈先荣, 等. 西咪替丁对低剂量电离辐射致大鼠氧化应激的保护作用[J]. 解放军医学杂志, 2017, 42(2): 128–133. |
| [24] | 苌雪, 王坤, 张健, 等. 高能光子水吸收剂量辐射质转换因子的实验测量[J]. 中国医学物理学杂志, 2017, 34(12): 1196–1199. DOI:10.3969/j.issn.1005-202X.2017.12.002 |
 2019, Vol. 45
2019, Vol. 45


