扩展功能
文章信息
- 郑天洋, 许海洋, 金日华, 姜宏
- ZHENG Tianyang, XU Haiyang, JIN Rihua, JIANG Hong
- 人参皂苷Rg1对大鼠局灶性脑缺血再灌注损伤后脑皮层内泛素修饰蛋白聚集的影响
- Effect of ginsenoside Rg1 on cortical ubiquitin-modified protein aggregation after cerebral ischemia-reperfusion in rats
- 吉林大学学报(医学版), 2019, 45(02): 217-222
- Journal of Jilin University (Medicine Edition), 2019, 45(02): 217-222
- 10.13481/j.1671-587x.20190201
-
文章历史
- 收稿日期: 2018-07-07
2. 吉林大学中日联谊医院眼科, 吉林 长春 130033
2. Department of Ophthalmology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是人体细胞内主要的非溶酶体蛋白质降解途径,该系统可完成细胞内80%的蛋白质降解任务。人体短暂性脑缺血后,UPS无法正常运转,会出现皮层神经元内蛋白降解障碍,形成异常蛋白聚集,导致神经元死亡[1-2]。人参和三七中重要的有效中药单体成分之一是人参皂苷Rg1,其具备良好的抗氧化和脑保护作用[3],但在脑缺血过程中是否对UPS产生影响并不明确。本实验通过大鼠大脑中动脉缺血(middle cerebral artery occlusion, MCAO)模型观察脑缺血后泛素修饰蛋白聚集物水平的变化及人参皂苷Rg1对其影响,以探讨人参皂苷Rg1抗脑缺血性卒中的作用机理,为人参皂苷应用于脑缺血临床治疗提供理论基础。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康雄性SD大鼠72只,体质量200~250g,购自辽宁长生生物技术股份有限公司,动物合格证号:SCXK(辽)2015-0001。人参皂苷Rg1(纯度>95%)(美国Solarbio公司),抗泛素多克隆抗体(美国Abcam公司),尼莫地平注射液(批号:BXHP931,德国拜尔药业),蛋白浓度测定试剂盒(美国Thermo公司),其他试剂由吉林大学第一医院转化医学研究院提供。光学显微镜(Olympus BX-53型,日本Olympus公司),震动切片机(Leica RM2245型,德国Leica公司)。
1.2 动物分组和大鼠局灶性脑缺血再灌注(I/R)模型制备将大鼠随机分为6组:假手术组,I/R模型组,尼莫地平组,低、中和高剂量人参皂苷Rg1组,每组12只大鼠。术前5d各组大鼠腹腔注射给药造模,每日1次。根据实验中人与动物药物剂量换算[4],低、中和高剂量人参皂苷Rg1分别为10、20和40mg·kg-1,尼莫地平剂量为1mg·kg-1,假手术组和I/R模型组小鼠均腹腔注射等量生理盐水。用10%水合氯醛(3.5mg·kg-1)腹腔注射麻醉,模型制作采用Zea-Longa线栓法[5],线栓采用头端烫成光滑圆形的直径为0.24mm的鱼线,长度由右侧颈外动脉分叉部到大脑中动脉共计(18.5±0.5)mm。栓塞1.5h,将鱼线轻轻拔出并缝合皮下筋膜及皮肤,再灌注时间为24 h。假手术组大鼠不阻断血流,尼龙鱼线仅插入10mm,剩余步骤均与手术组相同。以Zea-Longa 5分制标准进行评分,各组大鼠均于再灌注24h进行神经功能缺损评分,1~3分为大鼠造模成功,0和4分的动物剔除。实验中剔除死亡大鼠,严格按实验条件进行补充分组(造模后I/R模型组死亡2只;尼莫地平组死亡1只,不符合评分标准1只;低剂量人参皂苷Rg1组死亡2只;中剂量人参皂苷Rg1组死亡1只,不符合评分标准1只;高剂量人参皂苷Rg1组死亡2只)。
1.3 TTC染色检测各组大鼠脑梗死面积各组大鼠于脑缺血1.5 h后行缺血再灌注24 h,断头取脑,放入-10℃冰箱中冷冻20 min,切成2 mm厚的冠状位切片,在37℃条件下置于1%TTC溶液中染色30 min。10 min翻转切片1次以求均匀染色,染色完成后行4%多聚甲醛固定。梗死灶呈灰白色,正常组织呈亮红色。使用数码相机在蓝色背景下对TTC脑切片进行病灶大小分析,将切片脑梗死面积加起来计算全脑梗死面积,为了调整水肿影响,通过参考文献[6]中的公式计算每个切片的校正梗死面积百分比,校正后梗死面积百分比=(对侧半球面积-患侧半球非损伤区域面积)/对侧半球面积×100%。
1.4 Western blotting法检测脑缺血后泛素修饰蛋白聚集物表达水平再灌注24 h后,取各组大鼠6只,麻醉后迅速断头取脑,将脑组织完整凿出,放置于-10℃冰箱中。将脑组织切成厚度约3 mm的切片,再将背侧丘脑外侧的皮层脑组织分离下来,置于-80℃冰箱中保存。取冷冻脑组织,PBS冲洗后,按1:10加入RIPA裂解液,使用度恩斯匀浆研磨器抽压35次,超声波粉碎20s后静置30 min,4℃、1400 r·min-1离心15 min,留取上清液。使用二喹啉甲酸(BCA)测定蛋白浓度后,-20℃保存备用。常规上样、电泳、转膜,奶粉封闭1 h,加入一抗4℃冰箱孵育过夜,TBST缓冲液洗脱3次,每次5 min,加入二抗室温下摇床孵育2 h,TBST缓冲液洗脱3次,每次5 min,加入显影液,使用凝胶呈像系统(SAGECREATION)拍照。一抗:抗泛素抗体;二抗:抗大鼠源性抗体。以凝胶分析系统(SAGECREATION Lane 1D)进行灰度分析,并与内参照(β-tubulin)比较,进行半定量分析。
1.5 HE染色观察细胞存活情况将视交叉后的脑组织2 mm后层面浸泡于4%多聚甲醛缓冲液24h,蒸馏水冲洗,梯度酒精冲洗,二甲苯透明,石蜡包埋,包埋后的脑组织切为5 μm厚切片,烘干行HE染色, 光镜下观察细胞存活情况。
1.6 免疫组织化学检测和图像分析再灌注24h后,取各组大鼠6只,10%水合氯醛(3.5 mg·kg-1)行腹腔注射。采用4%多聚甲醛经左心室灌流固定后,断头取脑;4%多聚甲醛固定,24 h梯度乙醇脱水,定向石蜡包埋,5μm冠状位切片。免疫组织化学Envision法染色,石蜡切片常规脱蜡去水,3%过氧化氢溶液孵育15min,滴加一抗(兔抗大鼠泛素单克隆抗体,稀释度1:800)4℃孵育过夜,使用PBS缓冲液分别冲洗3次,每次间隔5min。于37℃加入二抗(IgG多聚体,辣根过氧化物酶标记,羊抗兔)孵育30min,采用PBS缓冲液冲洗3次,每次间隔5 min。DAB显色后光学显微镜观察,泛素修饰蛋白聚集物在细胞质内呈棕褐色。
依据参考文献[7-8],采用MetaMorph医学图像分析系统对各组大鼠脑组织图片进行分析,测量参数包括脑皮质泛素修饰蛋白的平均光密度(MOD)值、积分光密度(IOD)值和总面积(area sum)。校准光密度值并且将感兴趣区域的参数即色彩(hue)、饱和度(saturation)和强度(intensity),分别设置为:0~30、0~255和0~255。使用宏可以缩短分析时间。结果以观测面积的IOD值和MOD值表示。每张图片的大小与观测面积相同。
1.7 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠神经功能学评分、脑梗死面积百分比和泛素修饰蛋白聚集物阳性表达水平等以x ±s表示,多组间样本均数比较采用单因素方差分析,2组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠神经功能评分采用经典Zea-Longa评分法对手术后符合条件的大鼠进行评分,假手术组,I/R模型组,尼莫地平组,低、中和高剂量人参皂苷Rg1组大鼠神经功能缺损评分分别为0、2.6±0.52、1.2±0.43、2.5±0.53、2.1±0.74和1.3±0.48,I/R模型组大鼠可见到神经功能障碍;尼莫地平组和各剂量人参皂苷Rg1组大鼠神经功能缺损评分明显低于I/R模型组,差异有统计学意义(P < 0.05)。见表 1。
| (n=12) | |||||
| Group | Number of rats | Neurological deficit score | |||
| 0 score | 1 score | 2 scores | 3 scores | ||
| Sham operation | 10 | 0 | 0 | 0 | 0 |
| I/R Model | 0 | 0 | 4 | 6 | 2.60±0.52* |
| Ginsenoside Rg1 | |||||
| Low dose | 0 | 0 | 5 | 5 | 2.50±0.53△ |
| Middle dose | 0 | 2 | 5 | 3 | 2.10±0.74△ |
| High dose | 0 | 7 | 3 | 0 | 1.30±0.48△ |
| Nimodipine | 0 | 8 | 2 | 0 | 1.20±0.43△ |
| *P<0.01 vs sham operation group; △P<0.05 vs I/R model group. | |||||
假手术组大鼠无梗死区域,I/R模型组、尼莫地平组和各剂量人参皂苷Rg1组大鼠梗死面积百分比分别为(63.0± 2.7)%、(13.5±1.3)%、(52.2±2.1)%、(32.3± 2.7)%和(21.2±3.1)%。I/R模型组大鼠梗死面积最明显。与I/R模型组比较,各剂量人参皂苷Rg1组大鼠梗死面积明显缩小,以高剂量人参皂苷Rg1组最明显(P < 0.05),缩小了约42%;高剂量人参皂苷Rg1组与尼莫地平组梗死面积相近,但仍高于尼莫地平组(P < 0.05)。见图 1(插页一)和2。
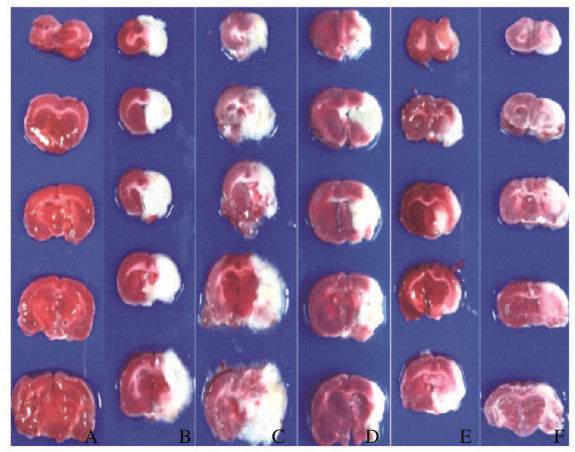
|
| A:Sham operation group; B:I/R model group; C:Low dose of ginsenoside Rgl group; D:Middle dose of ginsenoside Rgl group; E:High dose of ginsenosideRgl group; F:Nimodipine group. 图 1 TTC染色观察各组大鼠脑梗死后脑梗死面积 Fig. 1 Infarction areas of rats in various groups after cerebral infarction observed withTTC staining |
|
|

|
| *P < 0.05 vs sham operation group; △P < 0.05 vs I/R model group. 图 2 各组大鼠脑梗死面积百分比 Fig. 2 Percentages of infarction areas of rats in various groups |
|
|
HE染色结果显示:假手术组大鼠海马CA1区神经细胞排列有序,形态完好,核仁大而清晰,胞浆无粉染(图 3A,见插页一);I/R模型组大鼠海马CA1细胞核固缩,形状不规则,排列紊乱,胞浆粉染(图 3B,见插页一);各剂量人参皂苷Rg1和尼莫地平组大鼠海马CA1区神经细胞排列较之前稳定,细胞排列恢复,神经细胞核少部分发生变性(图 3C~F,见插页一)。假手术组大鼠皮层神经细胞细胞形态正常(图 3G,见插页一);I/R模型组大鼠皮层神经细胞出现胞浆粉染,胞核为多角形的死亡神经细胞(图 3H,见插页一);各剂量人参皂苷Rg1组核固缩的死亡神经细胞数量减少,正常形态细胞数量回升,以高剂量人参皂苷组效果最为突出(图 3I~K,见插页一);尼莫地平组与高剂量人参皂苷Rg1组细胞形态相近(图 3L,见插页一)。
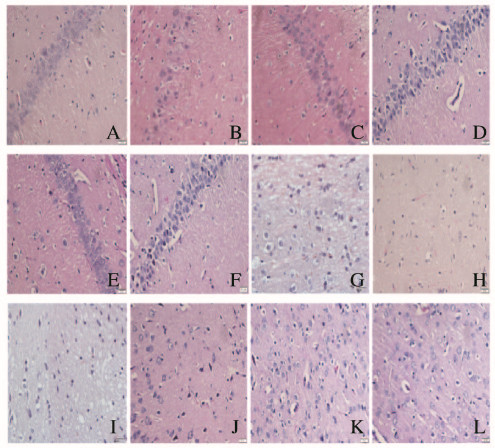
|
| A-F: Hippocampus CA1 region; G-L:Cortex region; A, G: Sham operation group; B, H: I/R model group; C, I: Lowdoseof ginsenosideRglgroup; D, J: Middle dose of ginsenosideRgl group; E, K: High dose of ginsenosideRgl group; F, L:Nimodipine group. 图 3 各组大鼠海马CA1和皮层区神经元死亡情况(HE, ×400) Fig. 3 Death of neurons in hippocampus CA1 and cortex regionof rats in various groups(HE, ×400) |
|
|
大鼠脑I/R损伤24h后免疫组织化学Envision染色结果显示:胞浆或胞核呈棕褐色为大鼠皮层神经元中泛素修饰蛋白聚集物阳性表达。假手术组大鼠泛素修饰蛋白聚集物阳性表达水平较低;I/R模型组大鼠泛素修饰蛋白聚集物阳性表达水平明显增加;各剂量人参皂苷Rg1组蛋白聚集物阳性表达水平均有不同程度降低,以高剂量人参皂苷Rg1组最为明显;尼莫地平组泛素修饰蛋白聚集物阳性表达水平与高剂量人参皂苷Rg1组相近。在本实验中MOD表示平均染色强度,与DAB试剂的显影时间呈正比关系, 即只有在相近的实验条件(MOD值)下,IOD值才有比较意义。测量结果显示:各组MOD值并无明显区别,但通过比较各组IOD值可以发现IOD值与泛素修饰蛋白聚集物阳性表达水平的变化规律明显趋同。见图 4(插页一)和图 5。
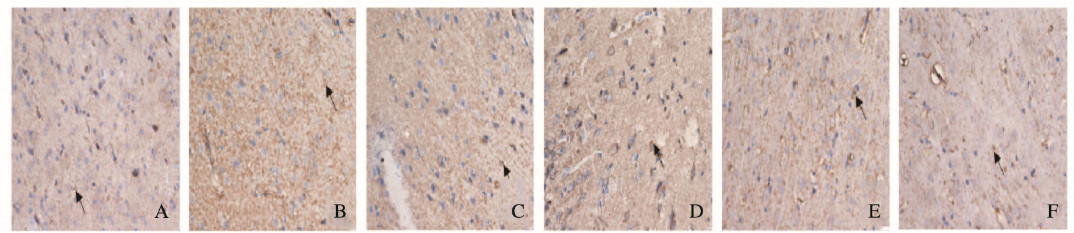
|
| A:Sham operation group; B: I/R model group; C: Low dose of ginsenosideRgl group; D: M ddle dose of ginsenoside Rgl group; E: Hgh dose of ginsenoside Rgl group; F:Nimodipine group. 图 4 各组大鼠皮层内泛素修饰蛋白聚集物表达情况(免疫组织化学, ×200) Fig. 4 Expressions of cortical ubiquitin-modified protein aggregation of rats in various groups(Immunohistochemsity, ×200) |
|
|
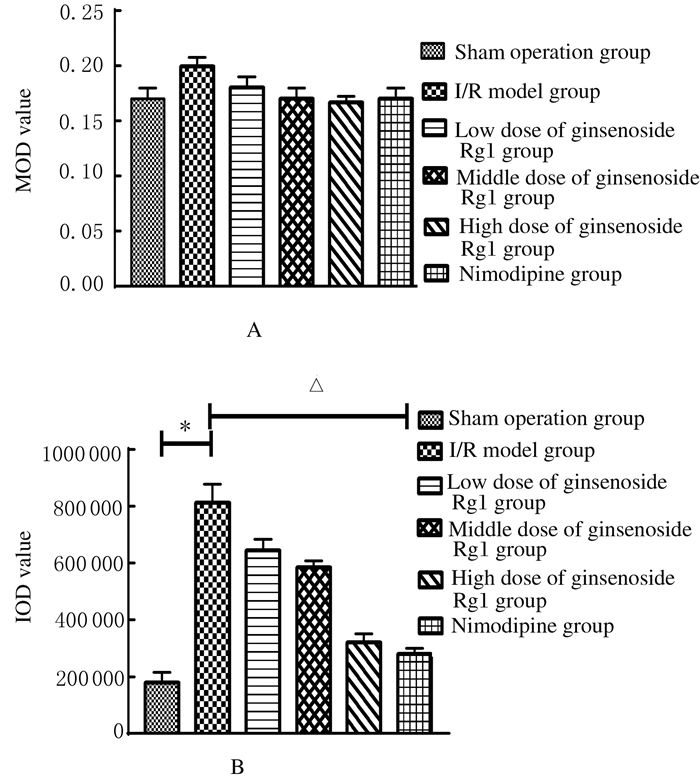
|
| A:MOD; B:IOD; *P < 0.05 vs sham operation group; △P < 0.05 vs I/R model group. 图 5 各组大鼠泛素修饰蛋白聚集物表达水平 Fig. 5 Expression levels of ubiquitin-modified protein aggregation of rats in various groups |
|
|
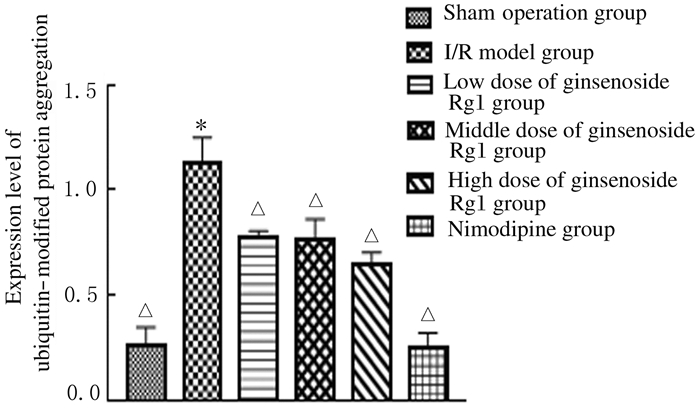
I/R损伤24h后选取符合条件的SD大鼠提取脑组织蛋白进行Western blotting法分析,I/R模型组大鼠皮层内泛素修饰蛋白聚集物表达水平高于假手术组(P < 0.05),各剂量人参皂苷Rg1和尼莫地平组大鼠皮层内泛素修饰蛋白聚集物表达水平均低于I/R模型组(P < 0.05)。与尼莫地平组比较,各剂量人参皂苷Rg1组大鼠皮层内泛素修饰蛋白聚集物表达水平升高(P < 0.05)。见图 6和7。

|
| Lane 1:Sham operation group; Lane 2:I/R model group; Lane 3:Low dose of ginsenoside Rg1 group; Lane 4:Middle dose of ginsenoside Rg1 group; Lane 5:High dose of ginsenoside Rg1 group. 图 6 各组大鼠皮层内泛素修饰蛋白聚集物表达电泳图 Fig. 6 Electrophoregram of expressions of ubiquitin-modified protein aggregation in cortex of rats in various groups |
|
|
|
| *P < 0.05 vs sham operation group; △P < 0.05 vs I/R model group. 图 7 Western blotting法检测各组大鼠皮层内泛素修饰蛋白聚集物表达水平 Fig. 7 Expressions of ubiquitin-modified protein aggregation in cortex of rats in various groups detected by Western blotting method |
|
|
本实验通过在SD大鼠大脑中动脉插入线栓建立大鼠MCAO模型,该动物模型成功率高且与临床症状高度相似,已成为经典的大脑I/R造模法。脑缺血性损伤成因众多,原因之一为缺血后脑组织出现异常蛋白聚集。该种蛋白聚集现象最早发现于阿尔滋海默病,随着研究深入,在亨廷顿病和帕金森病等退行性神经疾病中均发现了该种现象[9]。尽管退行性神经病变通常情况下发展缓慢,但在受到一些急性应激条件刺激后也可以加快发展的速度[10],而对于脑缺血后蛋白聚集物的成因目前比较认可的说法为:缺血后,神经元受到炎症、缺氧等异常因素的刺激,细胞内新合成的蛋白会发生折叠错误,而原有的蛋白会发生异常解链。由于此2种蛋白不具有正常的空间结构,无法维持稳定性,进而暴露蛋白质集团内部的疏水键,这些具有黏性的疏水键最终发生粘连形成蛋白聚集物[11]。正常生理情况下,细胞内存在UPS,不同于专职降解外部进入细胞内蛋白质的溶酶体,该系统专门降解细胞内自我产生的蛋白质[12]。且UPS会对蛋白质进行质量监控,及时降解掉上述蛋白聚集物[13-14]。但脑缺血时,UPS受到不可逆的损伤,这些有毒性的蛋白聚集物将会大量堆积并在在细胞质中沉降,附着与线粒体等膜性细胞器上,干扰正常的细胞周期运转,导致细胞凋亡[15]。人参类中药治疗脑缺血疾病具有不良反应小且适用范围广等优点,与传统的溶栓疗法比较无明显的时间窗限制。因此研究具有脑缺血疾病治疗效果的人参类中药,阐明其药物作用机理具有重要意义。
人参皂苷Rg1作为人参类中药的重要药理成分之一,具有优良的抗神经损伤作用[16-17]。研究[18]显示:人参皂苷Rg1可通过降低细胞内钙离子浓度,阻止细胞内溶酶体及磷脂酶激活而破坏神经元的正常骨架结构;也有学者[19]发现:Rg1可抗缺血后炎症,增加神经营养因子表达,起到脑保护作用。且人参皂苷Rg1尚可抑制Bax和p-JNK表达并促进Bcl-2因子表达使神经元的凋亡速度减缓[20-22]。但尚未有实验证实其在脑缺血后蛋白聚集物降解方面的药物作用。
本研究结果显示:人参皂苷Rg1可以较好地弱化大鼠脑I/R损伤后泛素修饰蛋白聚集这一病理过程,而且在实验过程中可见到相当数量的受试大鼠术后并发症明显减轻。本研究中高剂量人参皂苷Rg1组大鼠神经功能缺损评分明显降低,脑组织中泛素修饰化蛋白阳性表达水平明显降低;同时,高剂量人参皂苷Rg1组大鼠脑组织神经元固缩、坏死、核碎裂等病理变化得到改善,且大鼠脑组织神经元存活率升高,低和中剂量人参皂苷Rg1组大鼠与高剂量人参皂苷Rg1组比较上述病理改善作用较小,但也存在抑制脑I/R后蛋白聚集现象,说明其存在药物增量效应。本文作者推测人参皂苷Rg1对泛素修饰蛋白聚集的影响机制可能为脑缺血后人参皂苷发挥其抗炎、抗氧化和清除氧自由基作用,保护了神经细胞的结构与功能,使因缺血、氧化损伤造成折叠错误而产生的毒性蛋白质数量下降,起到脑神经元保护作用。但人参皂苷Rg1对UPS的具体影响机制仍需进行更深入的研究。
| [1] | CALDEIRA M V, SALAZAR I L, CURCIO M, et al. Role of the ubiquitin-proteasome system in brain ischemia:friend or foe?[J]. Prog Neurobiol, 2014, 112: 50–69. DOI:10.1016/j.pneurobio.2013.10.003 |
| [2] | THOMPSON S J, LOFTUS L T, ASHLEY M D, et al. Ubiquitin-proteasome system as a modulator of cell fate[J]. Curr Opin Pharmacol, 2008, 8(1): 90–95. DOI:10.1016/j.coph.2007.09.010 |
| [3] | 张经纬, 王广基, 孙建国, 等. 人参皂苷Rg1的药效学和药代动力学研究进展[J]. 中国药科大学学报, 2007, 38(3): 283–288. DOI:10.3321/j.issn:1000-5048.2007.03.021 |
| [4] | 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069–1072. DOI:10.3969/j.issn.1009-2501.2004.09.026 |
| [5] | LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84–91. |
| [6] | DURUKAN A, TATLISUMAK T. Ischemic stroke in mice and rats[J]. Methods Mol Biol (Clifton, NJ), 2009, 573: 95–114. DOI:10.1007/978-1-60761-247-6 |
| [7] | RUAN R, GUO A H, HAO Y J, et al. De novo assembly and characterization of narrow-ridged finless porpoise renal transcriptome and identification of candidate genes involved in osmoregulation[J]. Int J Mol Sci, 2015, 16(1): 2220–2238. DOI:10.3390/ijms16012220 |
| [8] | LI W, SUWANWELA N C, PATUMRAJ S, et al. Curcumin prevents reperfusion injury following ischemic stroke in rats via inhibition of NF κB, ICAM 1, MMP 9 and caspase 3 expression[J]. Mol Med Rep, 2017, 16(4): 4710–4720. DOI:10.3892/mmr.2017.7205 |
| [9] | AGUZZI A, O'CONNOR T. Protein aggregation diseases:pathogenicity and therapeutic perspectives[J]. Nat Rev Drug Discov, 2010, 9(3): 237–248. DOI:10.1038/nrd3050 |
| [10] | 葛鹏飞, 付双林, 罗毅男, 等. 缺血再灌注后蛋白集聚与皮层神经元延迟性死亡的关系[J]. 中华神经医学杂志, 2007, 6(6): 541–544. DOI:10.3760/cma.j.issn.1671-8925.2007.06.001 |
| [11] | LIU C L, GE P, ZHANG F, et al. Co-translational protein aggregation after transient cerebral ischemia[J]. Neuroscience, 2005, 134(4): 1273–1284. DOI:10.1016/j.neuroscience.2005.05.015 |
| [12] | JUNG T, HOHN A, GRUNE T. The proteasome and the degradation of oxidized proteins:Part Ⅱ-protein oxidation and proteasomal degradation[J]. Redox Biol, 2014, 2: 99–104. DOI:10.1016/j.redox.2013.12.008 |
| [13] | GLICKMAN M H, CIECHANOVER A. The ubiquitin-proteasome proteolytic pathway:destruction for the sake of construction[J]. Physiol Rev, 2002, 82(2): 373–428. DOI:10.1152/physrev.00027.2001 |
| [14] | GE P F, ZHANG F, ZHAO J W, et al. Protein degradation pathways after brain ischemia[J]. Cur Drug Targets, 2012, 13(2): 159–165. DOI:10.2174/138945012799201694 |
| [15] | MELLER R. The role of the ubiquitin proteasome system in ischemia and ischemic tolerance[J]. Neuroscientist, 2009, 15(3): 243–260. DOI:10.1177/1073858408327809 |
| [16] | 李亮, 邓文祥, 何军锋, 等. 人参皂苷Rg1对局灶性脑缺血再灌注大鼠的神经保护作用[J]. 神经损伤与功能重建, 2016, 11(2): 95–98. |
| [17] | SHI X W, YU W J, YANG T T, et al. Panax notoginseng saponins provide neuroprotection by regulating NgR1/RhoA/ROCK2 pathway expression, in vitro and in vivo[J]. J Ethnopharmacol, 2016, 190: 301–312. DOI:10.1016/j.jep.2016.06.017 |
| [18] | SUN C H, LAI X Q, HUANG X Y, et al. Protective effects of ginsenoside Rg1 on astrocytes and cerebral ischemic-reperfusion mice[J]. Biol Pharmaceut Bull, 2014, 37(12): 1891–1898. DOI:10.1248/bpb.b14-00394 |
| [19] | WANG L, ZHAO H, ZHAI Z Z, et al. Protective effect and mechanism of ginsenoside Rg1 in cerebral ischaemia-reperfusion injury in mice[J]. Biomed Pharmacother, 2018, 99: 876–882. DOI:10.1016/j.biopha.2018.01.136 |
| [20] | SCHABITZ W R, SOMMER C, ZODER W, et al. Intravenous brain-derived neurotrophic factor reduces infarct size and counterregulates Bax and Bcl-2 expression after temporary focal cerebral ischemia[J]. Stroke, 2000, 31(9): 2212–2217. DOI:10.1161/01.STR.31.9.2212 |
| [21] | GINET V, PUYAL J, MAGNIN G, et al. Limited role of the c-Jun N-terminal kinase pathway in a neonatal rat model of cerebral hypoxia-ischemia[J]. J Neurochem, 2009, 108(3): 552–562. DOI:10.1111/jnc.2009.108.issue-3 |
| [22] | ZHANG HA, WANG M, ZHOU J, et al. Protective effect of ginsenoside against acute renal failure and expression of tyrosine hydroxylase in the locus coeruleus[J]. Physiol Res, 2010, 59(1): 61–70. |
 2019, Vol. 45
2019, Vol. 45


