扩展功能
文章信息
- 卢亚东, 金巨楼, 刘定坤, 杨楠, 高尚, 刘志辉
- LU Yadong, JIN Julou, LIU Dingkun, YANG Nan, GAO Shang, LIU Zhihui
- 锂掺杂聚癸二酸甘油酯复合支架的制备及其性能
- Preparation of lithium-doped poly-glycerol sebacate scaffold and its properties
- 吉林大学学报(医学版), 2019, 45(01): 190-196
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 190-196
- 10.13481/j.1671-587x.20190136
-
文章历史
- 收稿日期: 2018-08-15
牙骨质是牙周组织的重要组成部分,也是牙周膜纤维附着的锚点,牙骨质与骨组织的组成相类似,但其硬度较骨和牙本质低。此外,在正常生理情况下,由于缺乏神经支配和营养供应,牙骨质的再生能力十分有限,但牙骨质的再生对于牙周组织再生有重要意义,组织工程技术作为一种理想的促进牙骨质再生的方法也是近年来的研究热点[1]。
聚癸二酸甘油酯(poly-glycerol sebacate,PGS)是一种新型网络状聚酯弹性体[2],具有优良的弹性和生物相容性,可在生物体内完全吸收且不会引发周围组织的炎症反应[3-5]。此外,PGS还可通过改变合成温度及时间来改变机械性能,研究[6-8]表明:PGS的杨氏模量随合成温度及时间的增加而增加。基于这些优异的性能,PGS已在生物医学领域得到了广泛应用[9-11]。
锂(Li)离子作为经典Wnt/β-catenin信号通路的激活剂,在调节细胞增殖和分化、促进骨骼发育及维持骨内生理性稳态方面发挥了重要作用。研究[12-13]表明:Li离子可以通过经典Wnt/β-catenin信号通路诱导牙周膜细胞的成牙骨质向分化,同时又可以在一定程度上抑制成牙骨质细胞的分化,这种作用在促进牙周组织再生的同时又能避免牙骨质过度形成,防止牙根黏连。此外,Li离子还能够减少正畸过程中的牙根吸收。而本课题组前期研究[14]显示:在脂多糖存在的情况下,Li离子的应用可以抑制炎症,说明Li离子在炎症微环境下仍能发挥作用,这一观点也被CHEN等[15]的研究所证明。Li离子是诱导牙骨质再生的特异性调控因子,可以应用于组织工程支架中以促进牙骨质愈合。
目前,利用组织工程技术促进牙骨质发生的研究仍处于初级阶段,国内外尚无通过在组织工程支架中掺杂Li离子来刺激牙骨质再生的研究。本实验旨在利用Li离子对牙周膜细胞、成牙骨质细胞作用的特异性及PGS支架的优异性能,通过在PGS交联过程中加入Li离子,合成一种具有刺激牙骨质再生作用的新型支架,并通过支架表征及生物相容性等方面的研究,为后续实验及其在临床上的应用奠定基础。
1 材料与方法 1.1 主要试剂和仪器磷酸(H3PO4, 质量分数85.0%)、丙三醇(相对分子质量92.09)和氯化钠(NaCl,质量分数99.8%,均为AR级)购自北京化工厂,癸二酸(相对分子质量202.24,AR级)和溴化钾(KBr,相对分子质量119.0)购自天津市精细化工研究所,磷酸锂(Li3PO4,相对分子质量115.79,AR级)购自天津市福晨化学试剂厂,噻唑蓝(MTT,相对分子质量414.32,AR级)购自美国Sigma公司。BS10S电子分析天平(德国Sartorius公司),JE0L-6700F扫描电子显微镜(SEM,日本电子公司),ESCALAB250X射线光电子能谱仪(美国热电),VERTEX 80V傅里叶变换红外光谱仪(德国Brucker公司),iCAP7000等离子体发射光谱仪(美国Thermo公司),Waters1525凝胶渗透色谱仪(美国Waters公司),Q500热重分析仪(美国TA公司),OCA-20接触角测量仪(德国Hysics公司),Multiskan FC酶标仪(美国Thermo公司)。
1.2 PGS的合成PGS的合成见参考文献[16],与上海锐图生物材料有限公司合作并进行优化。20.2574g癸二酸和9.2037g甘油在重结晶纯化后135℃熔融,N2保护下加热24 h,135℃下抽真空(4 mbar)48 h,降至室温可得到淡黄色蜡状固体,收率72.4%。
1.3 PGS/PGS-Li系列材料细胞爬片的制备将PGS配置成1g·L-1的溶液,按预定比例加入5%当量的磷酸锂粉末,超声5 min后均匀缓慢地滴加于直径24mm的6孔板细胞爬片(每片160μL)上,溶剂挥发后,将其置入真空烘箱中150℃条件下交联24h。
1.4 PGS/PGS-Li系列材料支架的制备将氯化钠磨碎,筛选出75~150μm大小的颗粒装入10mm×10mm的模具内,置于37℃、相对湿度85%的恒温恒湿箱中,待1.5h后取出,120℃真空干燥2h,干燥后制成盐模。将PGS配成100 g·L-1的溶液,加入5%当量的磷酸锂粉末,超声振荡5min后均匀缓慢地将其滴至盐模上,待溶剂挥发后,置入真空烘箱中150℃交联24h。取出后放入蒸馏水中,4h换水1次,3次后将NaCl完全去除的支架冷冻干燥48h,得到PGS-Li支架(PGS-Li组)。PGS支架(PGS组)的制备方法同上。
1.5 材料性能测试将2组支架干燥后表面喷金,SEM下观察2种支架的表面形貌,利用Adobe Photoshop cc 2017软件的直方图功能计算支架的孔隙率。将2组支架干燥后碾成粉末,采用傅里叶变换红外光谱仪对2种支架粉体进行分析,结果以红外光谱图表示,纵坐标为吸收强度(T.m),横坐标为波长(λ)。将2组支架干燥后碾成粉末,使用X射线光电子能谱仪对2种支架粉体进行分析,结果通过能谱图表示,纵坐标为相对强度(Ⅰ),横坐标为结合能(B.E)。将2种支架在加热条件下完全溶于磷酸后,采用等离子体发射光谱仪测定PGS-Li支架中Li离子含量(ppm)。将2组支架溶于四氢呋喃后,使用凝胶渗透色谱仪测定相对分子质量(Mr)及分子分布。将2组支架干燥后碾成粉末,在N2保护下,检测温度控制在室温至800℃,升温速率10K·min-1,采用热重分析仪分析支架材料的热稳定性,结果以热重曲线(TG曲线)表示,TG曲线以质量百分率(W)作纵坐标,以温度(T)为横坐标。取2组支架的细胞爬片,每个玻片上滴加3μL蒸馏水,采用接触角测量仪测量2组支架的接触角(θ),每组3个平行样,取平均值。将2种支架完全干燥后分为8组,测其质量为记为W1,将干燥后的样品浸于PBS缓冲液中置于恒温箱内,分别于7、14、21、28、35、42、49和56d取出,干燥后测其质量W2,结果通过失重曲线表示,纵坐标为质量损失的百分率(W·L)[W·L=(W2-W1)/W1×100%],横坐标为时间(t)。
1.6 材料生物性能分析PGS组和PGS-Li组支架经环氧乙烷灭菌处理后浸入完全培养液(10%FBS,89%高糖-DMEM,1%双抗)中,48 h后离心,保留上清液,过滤后得到浸提液备用。取对数生长期的成牙骨质OCCM-30细胞,胰酶消化,离心后重悬细胞得到细胞悬液,铺板,每孔200 μL(5×103个细胞),恒温培养12 h,观察到细胞贴壁后,PGS-Li组加入200 μL PGS-Li支架浸提液,PGS组中加入200 μL PGS支架浸提液,空白对照组中加入200μL完全培养液。孵育24、48和72 h后,在每孔中加入10 μL浓度为5g·L-1的MTT,恒温箱内孵育4 h,吸取上清液,每孔中加200 μL的DMSO溶液,振荡10 min后,采用酶标仪在490 nm波长处测定各组吸光度(A)值,代表各组细胞增殖活性。接种4×103个成牙骨质细胞于6孔板中,加入1 mL无血清培养基。当细胞覆盖达到80%后,PGS-Li组细胞经含PGS-Li支架浸提液的无血清培养基处理,不含PGS-Li支架浸提液的无血清培养基作为空白对照组,避光孵育24 h,加入1 g·L-1钙黄绿素1μL,荧光显微镜下观察细胞形态。
1.7 统计学分析采用SPSS 18.0统计软件进行统计学分析。2组支架孔隙率和接触角以x±s表示,符合正态分布,组间比较采用t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 PGS和PGS-Li组支架的表征PGS和PGS-Li组支架的外观呈海绵状,具有一定的可塑性。PGS组和PGS-Li组支架材料的相对分子质量及分子分布结果显示:熔融缩聚反应合成PGS是低交联聚合体系[17](表 1)。SEM下2组支架表面比较均匀,支架中存在大小不等的孔隙,孔径20~160μm,2组支架孔隙分布不均匀,部分孔隙断裂,孔隙之间相互连通形成无规则的三维网状结构(图 1)。PGS组支架孔隙率为(53.92±2.18)%,PGS-Li组支架孔隙率为(53.58±1.73)%,2组支架孔隙率比较差异无统计学意义(P>0.05)。
| Group | Mn | Mw | Mp | Mz | Mz+1 | Mw/Mn |
| PGS | 2 107 | 3 006 | 1 644 | 4 579 | 6 546 | 1.43 |
| PGS-Li | 3 062 | 6 129 | 3 752 | 11 870 | 18 025 | 2.00 |
| Mn: number-average molecular weight; Mw: weight-average molecular weight; Mp: peak molecular weight; Mz: viscosity-average molecular weight. | ||||||

|
| A, B: PGS group; C, D:PGS-Li group; A, C: Bar=500 μm; B, D: Bar=100 μm. 图 1 PGS组和PGS-Li组支架SEM下观察结果 Fig. 1 Observation results of scaffolds in PGS group and PGS-Li group under SEM |
|
|
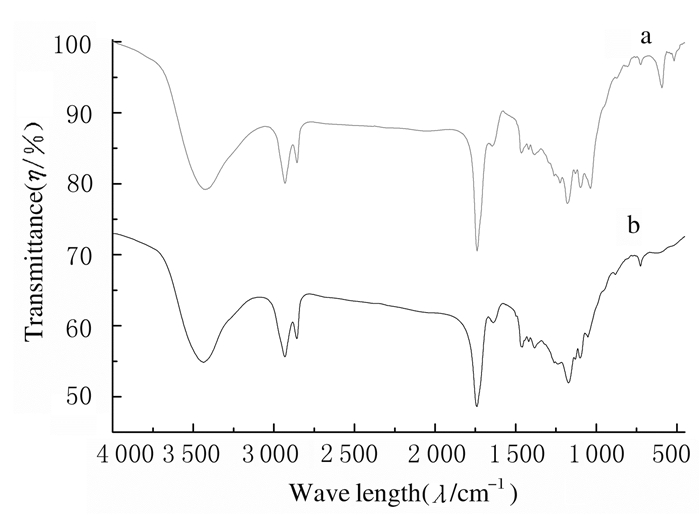
PGS和PGS-Li组支架的傅里叶红外光谱图见图 2。PGS组和PGS-Li组光谱中3425及3435 cm-1处的羟基吸收峰、2930及2857 cm-1处的亚甲基(-CH2-)特异性吸收峰、1738及1740 cm-1处的酯羰基(C=O)伸缩振动和1458 cm-1及1463cm-1处的-CH3弯曲振动峰均表明PGS为二元共聚物的链结构。而PGS-Li组光谱中514 cm-1处的磷酸根对称变角、592 cm-1处磷酸根不对称角和1035 cm-1处的磷酸根反对称伸缩表明已成功地将磷酸锂加入到了PGS支架中。
|
| a: PGS-Li group; b: PGS group. 图 2 PGS组和PGS-Li组支架傅里叶红外光谱图 Fig. 2 FTIR spectroscopy of scaffolds in PGS group and PGS-Li group |
|
|
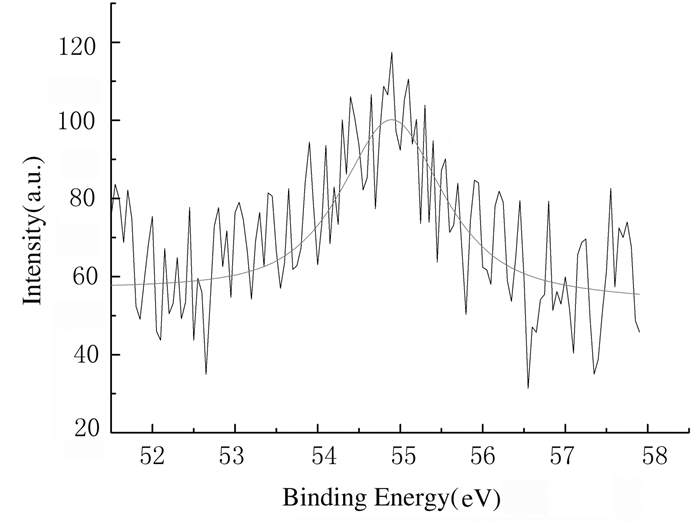
PGS组和PGS-Li组支架的XPS全谱扫描结果显示:2组支架材料主要由C和O等元素组成(图 3)。PGS-Li组支架中Li离子的XPS谱图及拟合曲线见图 4,在54.9 eV处出现的峰与Li 1 s结合能相符,说明已成功地合成了掺杂有Li离子的PGS-Li支架。通过电感耦合等离子体发射光谱仪测试结果进行计算,PGS-Li组支架的Li离子含量为0.084%(RSD < 1%)。

|
| a: PGS-Li group; b: PGS group. 图 3 PGS组和PGS-Li组支架XPS全谱扫描图 Fig. 3 XPS surveys of scaffolds in PGS group and PGS-Li group |
|
|
|
| 图 4 PGS-Li组支架中Li离子的XPS谱图 Fig. 4 XPS spectra of Li ion in scaffolds in PGS-Li group |
|
|
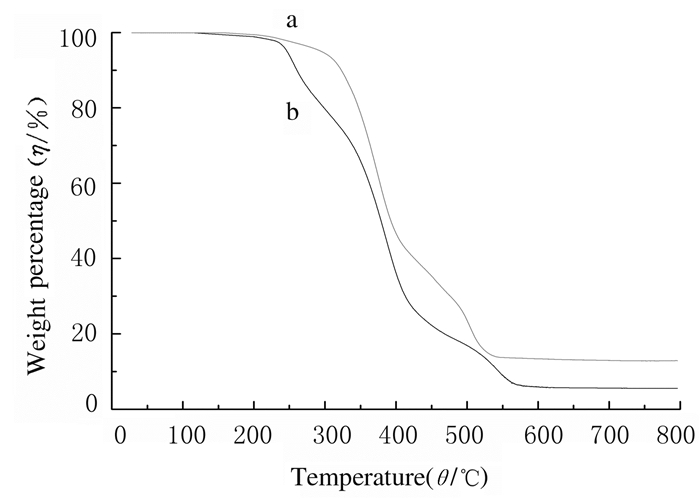
PGS组和PGS-Li组支架的TG分析曲线见图 5。在较低温度(低于100℃)下2组材料均无明显的脱水过程,主要的减重阶段发生在250℃~500℃,而当温度在500℃~550℃时,两者均为单一的降解过程。此外,PGS-Li组支架在较高温度下才开始失重,而停止失重的温度却较低,表明PGS-Li组支架的热稳定性要优于PGS组支架。
|
| a: PGS-Li group; b: PGS group. 图 5 PGS组和PGS-Li组支架TG曲线 Fig. 5 TG curves of scaffolds in PGS group and PGS-Li group |
|
|
PGS组和PGS-Li组支架的静态接触角见图 6。2组支架材料的接触角均小于90°,说明2种材料均为亲水性材料。随机抽取3个平行样进行测量,PGS组支架的接触角为78.26°±2.00°,而PGS-Li组支架的接触角为69.78°±1.15°,2组支架接触角比较差异有统计学意义(P < 0.05),表明PGS-Li组支架的亲水性能优于PGS组。

|
| A: PGS group; B: PGS-Li group. 图 6 PGS组和PGS-Li组支架接触角 Fig. 6 Contanct angles of scaffolds in PGS group and PGS-Li group |
|
|
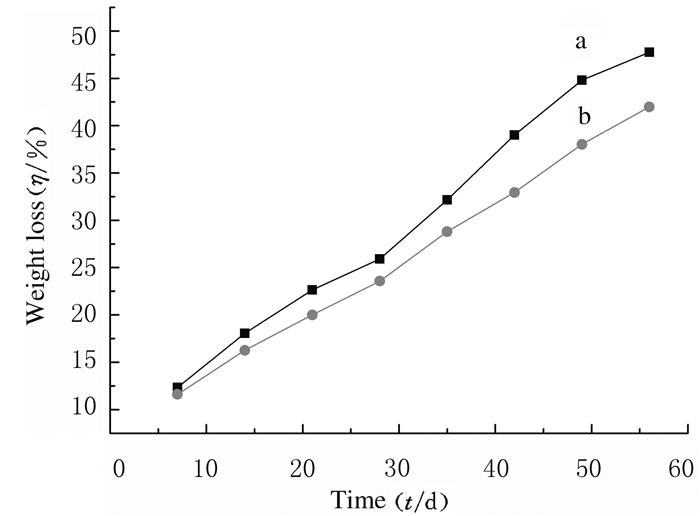
PGS组和PGS-Li组支架材料在PBS缓冲溶液中的失重曲线见图 7。PGS组和PGS-Li组支架的降解均为线性,PGS-Li组支架的降解速率较PGS组支架要快,降解4周后,PGS-Li组支架开始变成黏软的胶状,此时的降解率为25.92%,之后支架的降解速率也略有增快,并于第8周时达到47.76%,而PGS组支架在第4周时降解率为23.57%,第8周时则达到41.98%,与文献[16]报道结果相近。
|
| a: PGS-Li group; b: PGS group. 图 7 PGS组和PGS-Li组支架失重曲线 Fig. 7 Curves of weight loss of scaffolds in PGS group and PGS-Li group |
|
|
MTT结果显示:各时间点PGS-Li组细胞增殖活性与PGS组和空白对照组比较差异均无统计学意义(P>0.05)。见图 8。
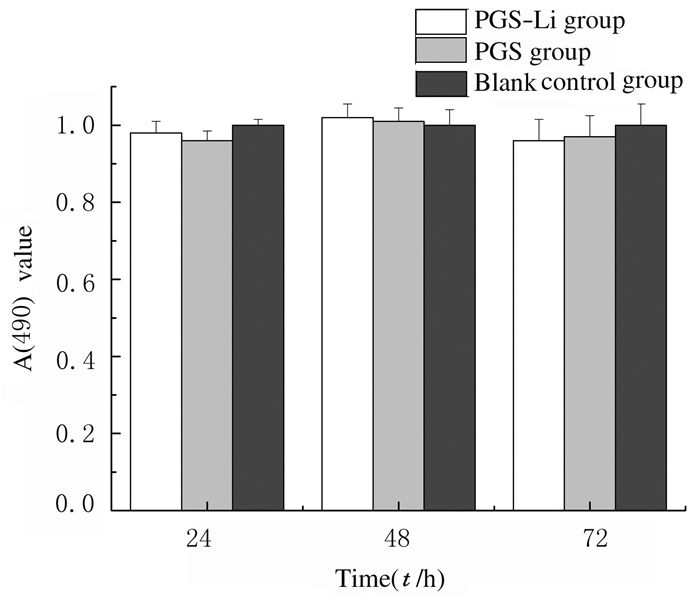
|
| 图 8 PGS组和PGS-Li组成牙骨质细胞增殖活性直条图 Fig. 8 Histogram of proliferation activities of cementoblasts in PGS group and PGS-Li group |
|
|
各组成牙骨质细胞的光镜图片和钙黄绿素-AM染色结果显示:PGS-Li组和PGS组细胞在经过钙黄绿素-AM染色后均为现绿色荧光,2组细胞均呈三角形和多边形等形态,成牙骨质细胞形态未发生明显的变化。见图 9(插页四)。
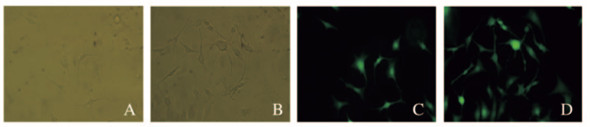
|
| A, B: Light microscope; C, D: Fluorescence microscope; A, C: PGS group; B, D: PGS-Li group. 图 9 PGS组和PGS-Li组成牙骨质细胞形态表现(×100) Fig. 9 Morphology of cementoblasts in PGS group and PGS-Li group(×100) |
|
|
如何有效地促进牙骨质的发生一直是困扰口腔科医生的难题,目前临床常用的牙周引导组织再生等技术虽然可以在一定程度上促进牙骨质的再生,但愈合方式多为长结合上皮结合或根骨黏连,导致牙周新附着难以形成。近年来研究[1]表明:利用组织工程技术促进牙骨质的发生是一种理想的方法。由于口腔内环境相对复杂,因此寻求一种具有良好可塑性及生物相容性的材料成为目前亟待解决的难题。PGS-Li支架具有良好的可塑性,在临床应用中,可以通过牙周外科手术将材料植入病损部位,PGS支架材料已被证实具有良好的弹性,可起到类似于膜性材料的隔离屏障作用,而其良好的可塑性保证了在准确地将材料植入到相对复杂的牙周组织中的同时不会对牙龈组织造成损伤。
本研究中傅里叶红外光谱仪及XPS仪扫描结果表明:本研究成功地在PGS交联过程中加入了Li离子,该结论也同时被电感耦合等离子体发射光谱仪测试结果证实,PGS-Li支架有着与PGS支架相似的组成和结构,而PGS-Li支架的相对分子质量要略大于PGS支架,可能是由于等比合成的PGS中存在大量未反应的羟基形成的氢键,磷酸锂的加入使丙三醇和癸二酸的酯化反应更加完全。
支架的孔径及孔隙率大小对组织重建有着重要影响,本研究合成的PGS-Li支架孔隙率为(53.58±1.73)%,孔径在20~160μm,而其相互连通的三维多孔结构则可以为细胞的增殖提供三维空间,有利于细胞的新陈代谢,从而促进组织再生[18-20]。
本研究中TG曲线及接触角测试结果显示:PGS-Li支架在热学性能及亲水性方面优于PGS支架。本研究结果表明:磷酸锂的加入可以加快复合材料的降解,可能与四面体结构中的磷酸根离子在交联过程中氢键的形成有关,而傅里叶红外光谱结果也验证了这一观点(由图 2可以看出PGS-Li支架羟基吸收峰的谱带增宽,C=O的伸缩振动峰蓝移,而-CH3弯曲振动峰也出现了谱带的缩窄和高频方向的位移)。本研究结果表明:支架材料在PBS缓冲液中的降解方式主要为水解反应,其降解速率与聚合物的结构和材料的亲疏水性等因素有关,氢键的形成使得PGS-Li支架在热稳定性及亲水性方面表现出了更为优异的性能并加快了复合材料的降解速率,这将更有利于细胞的黏附生长,从而促进牙骨质的再生。
PGS已被证实具有良好的生物相容性,本研究中MTT法及钙黄绿素-AM染色结果显示:PGS-Li支架作为一种新型支架材料,对成牙骨质细胞的增殖活性无明显影响,并且对细胞形态也无明显影响,表明PGS-Li支架具有良好的细胞相容性。
综上所述,PGS-Li支架有着与PGS支架相似的组成和结构,并且在亲水性和热稳定性方面展现出优于PGS支架的性能;体外降解实验表明:PGS-Li支架的降解速率要快于PGS支架,可能与交联过程中氢键的形成有关。此外PGS-Li支架还具有适宜的孔隙率和孔径大小,并展现了良好的细胞相容性,在牙骨质组织工程中有着广阔的应用前景。
| [1] | CHEN F M. Periodontal tissue engineering and regeneration[J]. Chin J Stomatol, 2017, 52(10): 610–614. |
| [2] | WANG Y, AMEER G A, Sheppard B J, et al. A tough biodegradable elastomer[J]. Nat Biotechnol, 2002, 20(6): 602. DOI:10.1038/nbt0602-602 |
| [3] | HOU L, ZHANG X, MIKAEL P E, et al. Biodegradable and bioactive PCL-PGS core-shell fibers for tissue engineering[J]. ACS Omega, 2017, 2(10): 6321–6328. DOI:10.1021/acsomega.7b00460 |
| [4] | SHIRAZAKI P, VARSHOSAZ J, KHARAZI A Z. Electrospun gelatin/poly (glycerol sebacate) membrane with controlled release of antibiotics for wound dressing[J]. Adv Biomed Res, 2017, 6(1): 105. DOI:10.4103/abr.abr_197_16 |
| [5] | ZHAO X, WU H, GUO B, et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing[J]. Biomaterials, 2017, 122: 34–47. DOI:10.1016/j.biomaterials.2017.01.011 |
| [6] | WANG Z, MA Y, WANG Y X, et al. Urethane-based low-temperature curing, highly-customized and multifunctional poly (glycerol sebacate)-co-poly (ethylene glycol) copolymers[J]. Acta Biomaterialia, 2018, 71: 279–292. DOI:10.1016/j.actbio.2018.03.011 |
| [7] | DING X, WU Y L, GAO J, et al. Tyramine functionalization of poly (glycerol sebacate) increases the elasticity of the polymer[J]. J Mater Chem B, 2017, 5(30): 6097–6109. DOI:10.1039/C7TB01078H |
| [8] | MASOUDI R M, NOURI K S, GHASEMI-MOBARAKEH L, et al. Fabrication and characterization of two-layered nanofibrous membrane for guided bone and tissue regeneration application[J]. Mater Sci Eng C Mater Biol Appl, 2017, 80: 75–87. DOI:10.1016/j.msec.2017.05.125 |
| [9] | SOUZA M T, TANSAZ S, ZANOTTO E D, et al. Bioactive glass fiber-reinforced PGS matrix composites for cartilage regeneration[J]. Materials, 2017, 10(1): 83. DOI:10.3390/ma10010083 |
| [10] | WANG M, LEI D, LIU Z, et al. A poly(glycerol sebacate) based photo/thermo dual curable biodegradable and biocompatible polymer for biomedical applications[J]. J Biomater Sci Polym Ed, 2017, 28(15): 1728–1739. DOI:10.1080/09205063.2017.1348927 |
| [11] | NADIM A, KHORASANI S N, KHARAZIHA M, et al. Design and characterization of dexamethasone-loaded poly (glycerol sebacate)-poly caprolactone/gelatin scaffold by coaxial electro spinning for soft tissue engineering[J]. Mater Sci Eng C Mater Biol Appl, 2017, 78: 47–58. DOI:10.1016/j.msec.2017.04.047 |
| [12] | LIM W H, LIU B, MAN S J, et al. Alveolar bone turnover and periodontal ligament width are controlled by Wnt[J]. J Periodontol, 2015, 86(2): 319–326. DOI:10.1902/jop.2014.140286 |
| [13] | REN Y, HAN X, HO S P, et al. Removal of SOST or blocking its product sclerostin rescues defects in the periodontitis mouse model[J]. FASEB J, 2015, 29(7): 2702–2711. DOI:10.1096/fj.14-265496 |
| [14] | WANG Y, GAO S, JIANG H, et al. Lithium chloride attenuates root resorption during orthodontic tooth movement in rats[J]. Exp Ther Med, 2014, 7(2): 468. DOI:10.3892/etm.2013.1410 |
| [15] | CHEN X, H U C, WANG G, et al. Nuclear factor-κB modulates osteogenesis of periodontal ligament stem cells through competition with β-catenin signaling in inflammatory microenvironments[J]. Cell Death Dis, 2013, 4(2): e510. DOI:10.1038/cddis.2013.14 |
| [16] | POMERANTSEVA I, KREBS N, HART A, et al. Degradation behavior of poly (glycerol sebacate)[J]. J Biomed Mater Res A, 2009, 91(4): 1038–1047. |
| [17] | BODAKHE S, VENA SMGARJGAL K, et al. Injectable photocrosslinkable nanocomposite based on poly (glycerol sebacate) fumarate and hydroxyapatite:development, biocompatibility and bone regeneration in a rat calvarial bone defect model[J]. Nanomedicine, 2013, 8(11): 1777–1795. DOI:10.2217/nnm.12.192 |
| [18] | LIANG H J, LI R Y, LIU G C, et al. Design of the porous orthopedic implants:research and application status[J]. Chin Tissue Eng Res, 2017, 21(15): 2410–2417. |
| [19] | 常丽, 张玉兰, 袁源, 等. 45S5型生物活性玻璃制备及体外性能表征[J]. 中国医学物理学杂志, 2017, 34(5): 521–526. DOI:10.3969/j.issn.1005-202X.2017.05.017 |
| [20] | 黄术, 吴江怡, 杨君君, 等. 天冬氨酸修饰纳米羟基磷灰石/聚乳酸复合物制备软骨组织工程支架及其生物性能研究[J]. 中国医学物理学杂志, 2018, 35(5): 616–620. DOI:10.3969/j.issn.1005-202X.2018.05.022 |
 2019, Vol. 45
2019, Vol. 45


