扩展功能
文章信息
- 李时孟, 赵丽纯, 乔璐, 何成彦, 刘卓
- LI Shimeng, ZHAO Lichun, QIAO Lu, HE Chengyan, LIU Zhuo
- ATP5B原核表达和单克隆抗体的制备及其鉴定
- Prokaryotic expressionof ATP5B and preparation and identification of its monoclonal antibody
- 吉林大学学报(医学版), 2019, 45(01): 184-189
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 184-189
- 10.13481/j.1671-587x.20190135
-
文章历史
- 收稿日期: 2018-09-03
2. 吉林大学药学院微生物与生化药学教研室, 吉林 长春 130021;
3. 吉林大学中日联谊医院血管外科, 吉林 长春 130033
2. Department of Microbiology and Biochemical Pharmacy, School of Pharmacy, Jilin University, Changchun 130021, China;
3. Department of Vascular Surgery, China-Japan Union Hospital, Jilin University, Changchun 130033, China
肿瘤的发生发展常伴随细胞代谢的变化,WALLACE[1]指出:癌细胞中多存在线粒体基因的突变,并改变线粒体生物能量学和生物合成状态。TAN等[2]研究显示:缺失线粒体DNA的肿瘤细胞生长迟缓,同时肿瘤的形成也与其从宿主细胞获取线粒体DNA有关。FORMENTINI等[3]研究显示:细胞器的生物学活性损伤与肿瘤发展关系密切,氧化磷酸化相关的ATP合酶β亚基(ATP5B)的表达率影响肿瘤的侵袭能力。
ATP合酶在氧化磷酸化的过程中起重要作用,可产生电化学催化剂来制造线粒体内膜的质子梯度[4]。该酶由5个亚基组成,ATP5B是β亚型线粒体的H+泵合酶,是氧化磷酸化限速酶。ATP5B在多种肿瘤中表达异常,GEYIK等[5]研究显示:ATP5B在低年龄结直肠患者癌组织中表达水平较癌旁组织明显升高。XU等[6]研究表明:ATP5B在恶性胶质瘤中的表达水平较正常血管明显升高。SUN等[7]通过免疫组织化学法检测ATP5B在膀胱癌中的表达,结果显示:ATP5B阴性表达与肿瘤体积增大、高TNM分期和淋巴结转移有关联。ATP5B的异常表达关系到肿瘤的发生发展,其在肿瘤中的作用机制也在进一步研究中。LU等[8]采用肺癌细胞系的膜蛋白作为免疫原成功制备了ATP5B的多克隆抗体,该抗体在肺癌细胞系和肝癌细胞系中对ATP5B有高度的亲和性和特异性。然而,有关ATP5B单克隆抗体制备的研究较少。本文作者通过分子克隆技术构建人源ATP5B蛋白的表达载体,表达纯化的ATP5B蛋白,进一步利用杂交瘤技术制备ATP5B单克隆抗体,为下一步ATP5B蛋白功能的研究奠定基础。
1 材料与方法 1.1 细胞株、菌株和表达载体小鼠骨髓瘤细胞株(SP2/0)购于上海信裕生物科技有限公司。大肠杆菌BL21、DH5α和pET28a原核表达载体为吉林大学中日联谊医院检验科实验室保存。
1.2 工具酶、试剂、主要仪器和实验动物限制性内切酶NdeⅠ、限制性内切酶XhoⅠ、dNTP、DL2000、rTaq聚合酶和DL15000购自日本TaKaRa公司,Trizol和Cloned AMV First-Strand cDNA Synthesis Kit购自美国Invitrogen公司,质粒提取试剂盒和胶回收试剂盒购自爱思进生物技术(杭州)有限公司,T4连接酶购自约旦Biolab公司。Tris碱、胰蛋白胨、卡那霉素、山羊抗小鼠IgG(H+L)-HRP和引物购自生物工程(上海)股份有限公司,三氯甲烷、乙醇、异丙醇和氯化钙购自北京化工厂,异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、N, N-甲叉双丙烯酰胺、四甲基乙二胺(TEMED)、丙烯酰胺、十二烷基硫酸钠(SDS)、弗氏不完全佐剂、弗氏完全佐剂、PEG4000、HAT、100×HT和单克隆抗体亚类鉴定试剂盒购自美国Sigma公司,胎牛血清购自上海洛神公司,RPMI1640培养基购自美国Gibco公司,山羊抗小鼠IgG(H+L)-HRP、SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒、中分子量蛋白非预染Marker Ⅳ、SDS-PAGE上样缓冲液(5×)、SDS-PAGE电泳缓冲液和Protein Show-G250蛋白快速染色试剂购自北京康为世纪生物科技有限公司。T-25培养瓶、2mL冻存管和T-75培养瓶购自美国Corning公司,DMSO购自美国Amresco公司,超滤管购自美国Millipore公司,透析袋购自美国BLUEBIRD公司,96孔培养板、24孔培养板和6孔培养板购自香港耐思生物科技有限公司。6只Balb/C小鼠由东北师范大学实验动物中心提供。
1.3 pET28a-ATP5B表达载体的构建根据NCBI数据库上查找的ATP5B开放阅读框架的核苷酸序列,优化后合成目的基因,在目的基因上、下游分别添加Nde Ⅰ酶切位点和XhoⅠ酶切位点。应用PCR对目的蛋白进行扩增,扩增的目的基因序列用NdeⅠ和XhoⅠ双酶切后连入pET28a载体,构建重组质粒,并对重组质粒进行测序。本实验由生工生物工程(上海)股份有限公司完成。
1.4 诱导表达融合蛋白挑取表达菌株BL21(DE3)的单菌落,接种于3mL含卡那霉素(30 mg·L-1)的LB培养液中,置于37℃、200 r·min-1摇菌过夜。次日,过夜培养的菌液以1:100比例分别接种于4 mL LB培养液中,当菌液摇至吸光度(A)值为0.6时,添加终浓度为0.5 mmol·L-1的IPTG,200r·min-1、20℃诱导过夜,设37℃诱导4h未加IPTG诱导剂的菌液为阴性对照。4 000 r·min-1离心10 min收集菌体,500 μL PBS(pH7.4)缓冲液重悬,超声破碎6 min,离心收集上清和沉淀。配制12%分离胶行SDS-PAGE,分析蛋白表达情况,对阳性克隆株进行基因序列测定。
1.5 融合蛋白纯化收集菌体,用破碎Buffer溶解后冰浴中超声破碎菌体。超声完毕,4℃、12 000 r· min-1离心20 min,收集上清。将上清转入镍琼脂糖亲和层析柱中洗脱目的蛋白,收集样品行SDS-PAGE检测蛋白纯度。
1.6 单克隆抗体的纯化和鉴定 1.6.1 动物免疫及血清抗体效价测定雌性Balb/C小鼠3只,采用背部多点皮下注射方式免疫小鼠。注射佐剂与重组蛋白1:1混合的蛋白悬液,免疫剂量40 μg/只(首次免疫加倍)。首次免疫2周后行第1次加强免疫,3 d后行第2次加强免疫。3 d后取小鼠尾部静脉血,采用间接酶联免疫吸附法(ELISA法)检测血清中ATP5B抗体效价:每孔加入2mg·L-1 ATP5B抗原,4℃过夜,加封闭液150 μL,37℃封闭2 h。将血清进行稀释,稀释倍数分别为1:1 000、1:2 000、1:4 000、1:8 000、1:16 000、1:32 000和1:64 000(设空白和阴性孔对照),37℃水浴30 min,每孔加入HRP标记羊抗鼠IgG(1:5 000稀释)100 μL,37℃水浴30 min,洗板拍干后每孔加100 μL的1×TMB,37℃水浴15 min,每孔加入50 μL的2 mol·L-1 H2SO4终止反应。应用酶标仪在波长450 nm处测各孔A值,计算目的蛋白孔与阴性对照孔A值比值(P/N),以P/N>2.1作为确定效价的临界点。选出血清效价最高的小鼠,3 d后再次加强免疫(剂量同前),2周后行脾内加强免疫(80 μg/只)。
1.6.2 杂交瘤的建立首先制备饲养层细胞,取1只未免疫的Balb/C小鼠,处死后置于75%乙醇中浸5 min,无菌操作暴露腹膜。预热RPMI-1640细胞培养液,用其冲洗腹腔并收集冲洗液,1 000 r·min-1离心5 min,弃上清,用含10%胎牛血清的RPMI-1640培养液重悬细胞,将细胞浓度调至1×105 mL-1,96孔板每孔加入100 μL,在37℃、5%CO2培养箱中过夜。然后取对数生长期SP2/0细胞,离心重悬后计数细胞数量。另取血清效价最高的Balb/C小鼠,脱颈处死后75%乙醇浸泡5 min,取脾脏研磨,200目滤网过滤,收集脾细胞。脾细胞和SP2/0细胞以10:1的比例混合,离心弃上清,滴入50%的PEG 1 mL,静置45s后,加入RPMI-1640细胞培养液终止PEG作用。用含10%胎牛血清和HAT的RPMI-1640细胞选择培养液重悬,96孔板中每孔加入200 μL,在37℃、5%CO2培养箱培养。待细胞融合后,每3 d更换培养液,第7天筛选融合细胞(取细胞上清,采用间接ELISA法筛选融合细胞),酶标仪测定A值,以P/N>2.1为阳性细胞,对阳性细胞进行单克隆化培养。对阳性细胞行核型分析,采用常染色体制备法制备杂交瘤细胞的染色体,吉姆萨染色,计数细胞的染色体数。
1.6.3 杂交瘤细胞制备腹水模型并检测效价取2只12周龄Balb/C小鼠,腹腔注射0.5 mL灭菌石蜡油,1周后腹腔接种杂交瘤细胞(1×106个细胞/0.5 mL注射),观察腹水产生情况,10~14 d后,收集腹水,离心取上清,用间接ELISA法检测效价并用SDS-PAGE检测抗体纯度。
1.6.4 抗体亚型分析用PBS稀释待测单克隆抗体和阴性对照,包被ELISA板,37℃孵育1 h,用PBS 1:10稀释亚型抗体(IgA、M、G1、2a、2b和G3),每孔加入100 μL,室温反应30 min,每孔加入100 μL 0.02% TWEEN-20-PBS稀释(1:500)HRP标记二抗,室温反应15 min,每孔加入100 μL显色底物缓冲液室温避光10 min后加50 μL终止液,用酶标仪在波长490 nm处测定各孔A值。
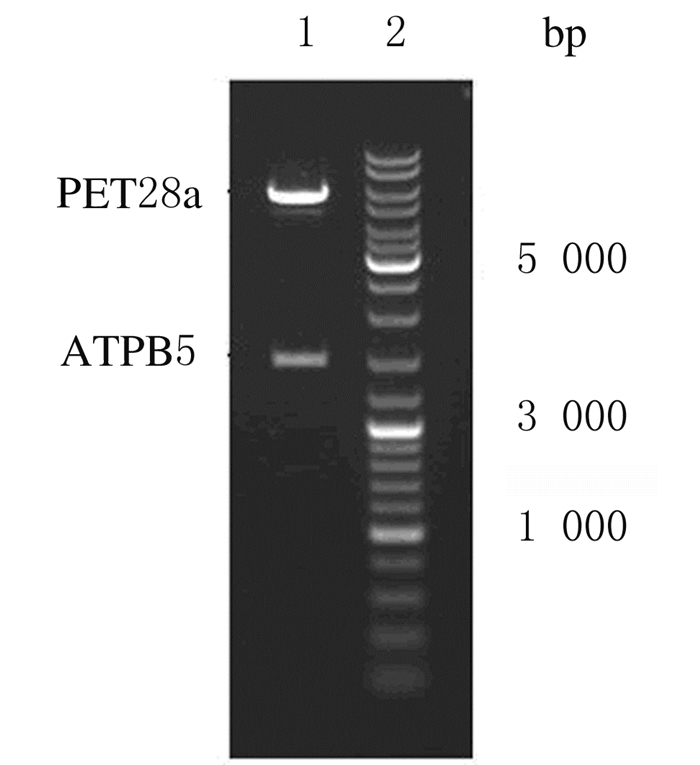
2 结果 2.1 重组pET28a/ATP5B表达载体的构建和鉴定PCR扩增后得到1 455 bp的特异性条带,片段大小与理论值相符。分别回收经NdeⅠ和XhoⅠ双酶切的目的基因片段及pET28a空载体,连接后转化,获得重组pET28a/ATP5B表达载体,经酶切鉴定及DNA序列测定证实重组表达载体构建成功。见图 1。
|
| Lane 1:PET28a/ATP5B; Lane 2: GeneRuler DNA Ladder Mix. 图 1 重组pET28a/ATP5B表达载体NdeⅠ和XhoⅠ酶切琼脂糖凝胶电泳图 Fig. 1 Agarose gel electrophoregram of recombinant pET28a/ATP5B expression vector digested with NdeⅠ and XhoⅠ |
|
|
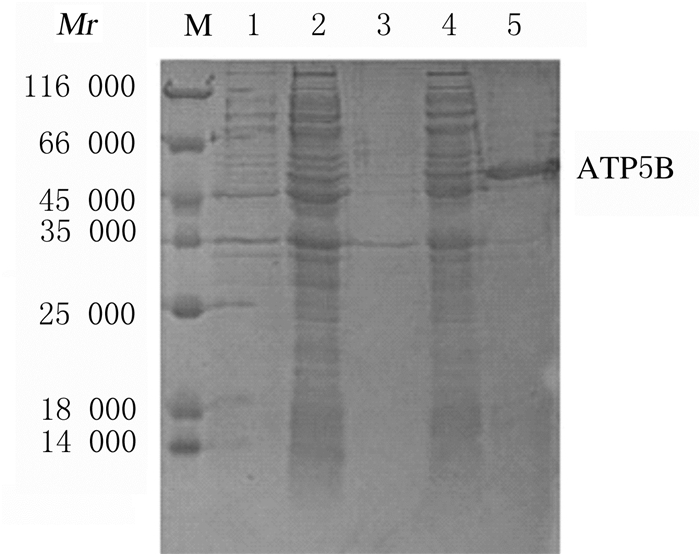
含pET28a/ATP5B质粒的转化菌液经IPTG诱导表达后,SDS-PAGE分析结果显示:在相对分子质量约51 000处出现明显的诱导蛋白条带,与预期一致。经Ni-NTA纯化后获得高纯度目的蛋白。见图 2和3。
|
| M: Protein marker; Lane 1: Total protein before induction; Lane 2: 20℃ supernatant; Lane 3: 20℃ precipitation; Lane 4: 37℃ supernatant; Lane 5: 37℃ precipitation. 图 2 ATP5B融合蛋白的诱导表达电泳图(SDS-PAGE) Fig. 2 Electrophoregram of expressions of ATP5B fusion protein (SDS-PAGE) |
|
|

|
| M: Protein marker; Lane 1: Loading; Lane 2: Outflow; Lane 3: 20 mmol·L-1 imidazole elution component; Lane 4: 500 mmol·L-1 imidazole elution component. 图 3 镍琼脂糖亲和层析纯化ATP5B融合蛋白电泳图(SDS-PAGE) Fig. 3 Electrophoregram of ATP5B fusion protein purified by Ni-agarose affinity chromatography (SDS-PAGE) |
|
|
应用间接ELISA法筛选出血清效价最高的小鼠,血清效价达到1:64 000,对该小鼠行脾内加强免疫,取其脾脏进行细胞融合,图 4A(插页四)为融合后在HAT选择性培养基中生长的杂交瘤细胞。细胞经亚克隆后,显微镜下观察细胞生长达板底30%时,再次行间接ELISA法筛选出阳性杂交瘤细胞株。染色体核型分析结果显示:染色体总数约为骨髓瘤细胞与正常小鼠脾细胞之和,为二者融合细胞的核型(图 4B,见插页四)。

|
| 图 4 HAT选择性培养基中生长的杂交瘤细胞(A, ×40)和杂交瘤细胞ABC核型(吉姆萨染色, ×1 000)(B) Fig. 4 Hybrid tumor cells grown in HAT selective medium (A, ×40) and ABC karyotypes of hybridoma cells (Giemsa staining, ×1 000) (B) |
|
|
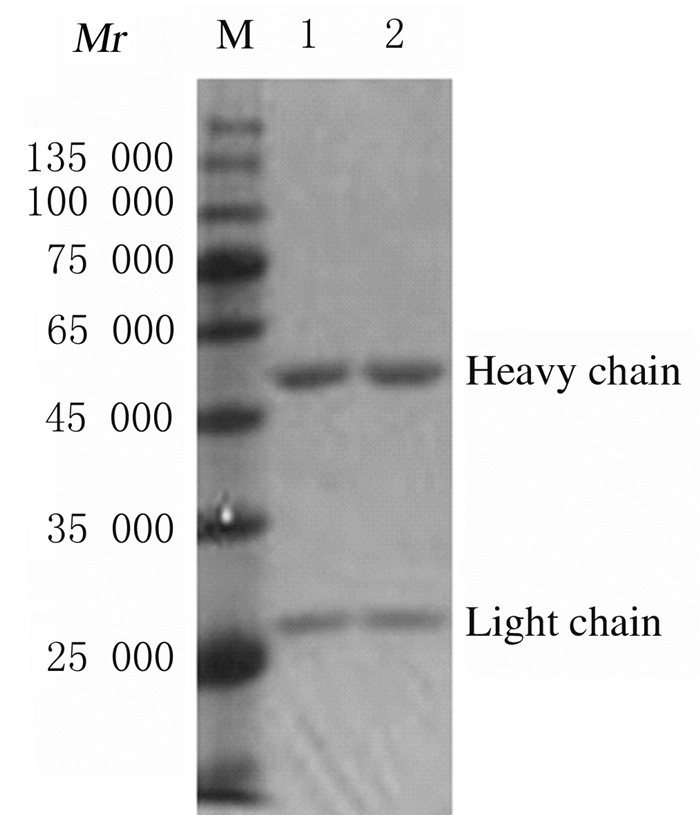
选取杂交瘤细胞株制备腹水小鼠,10 d后纯化收集的腹水,检测效价,抗体最高效价为1:240 000。应用SDS-PAGE分析纯化抗体的纯度(图 5)。ELISA法检测:该株杂交瘤细胞产生的单克隆抗体亚型为IgG1。
|
| M: Protein marker; Lane 1, 2: Purified monoclonal antibody. 图 5 纯化的单克隆抗体分析电泳图(SDS-PAGE) Fig. 5 Electrophoregram of analysis of purified monoclonal antibody (SDS-PAGE) |
|
|
随着恶性肿瘤发病率的逐年增高,肿瘤的治疗方法也在不断进步。对于不能手术治疗的肿瘤晚期患者,除放化疗外,单克隆抗体和小分子抑制剂等新型药物也不断涌现。单克隆抗体是重组蛋白药物中占比最大的一种,既可用于体内的成像诊断,也可用于疾病的治疗[9]。单克隆抗体具有靶向性强和不良反应少的特点,被认为是目前最有希望的治疗方式。晚期或转移性结直肠癌患者采用常规化疗治疗虽可一定程度的提高疗效,但患者的中位生存期仍不足2年[10]。SALTZ等[11]研究表明:单克隆抗体与放化疗联合治疗可明显延长结直肠癌患者的生存期。
目前,单克隆抗体已在临床广泛应用于肿瘤的治疗。表皮生长因子受体(EGFR)单克隆抗体可用于治疗脑胶质瘤,包括帕尼单抗、尼妥珠单抗和西妥昔单抗等[12]。临床试验[13]结果显示:埃罗妥珠单抗、达雷木单抗或帕姆单抗联合其他抗肿瘤药物,对多发性骨髓瘤患者疗效显著。用于转移性结直肠癌治疗的靶向单抗药物主要包括贝伐单抗、西妥昔单抗、帕尼单抗和雷莫芦单抗[14]。贝伐单抗和雷莫芦单抗属抗血管内皮细胞生长因子受体(VEGFR)类靶向药物,其中雷莫芦单抗可直接结合VEGFR-2的配体以阻断VEGF-A、VEGF-C和VEGF-D的结合,从而抑制下游血管生成的相关通路,以减少肿瘤内血管生成,发挥抗肿瘤的作用[15]。GREENING等[16]研究表明:西妥昔单抗和帕尼单抗作用于EGFR,在结直肠癌异种移植小鼠模型中,西妥昔单抗和帕尼单抗治疗可致肿瘤内ATP5B异常表达。
ATP5B是一种跨膜酶,参与肿瘤的能量代谢。SÁNCHEZ-ARAGÓ等[17]研究显示:在结直肠癌细胞中,抑制ATP合酶表达可促进肿瘤的发展,侵袭性强的细胞表型有高效的糖分解能力,同时可导致调控细胞代谢、细胞周期、细胞凋亡、血管生成及细胞黏附的基因表达下调。REN等[18]研究表明:在卵巢癌细胞中,NEU1与细胞氧化磷酸化有关联,抑制其表达可同时导致ATP5B表达减低,进一步抑制肿瘤细胞的增殖、凋亡和侵袭能力。FLIEDNER等[19]研究显示:ATP5B在副神经节瘤细胞表面表达,可促进细胞的生存和增殖,细胞表面的ATP合酶有望成为转移性副神经节瘤的新型治疗靶点。LI等[20]研究发现:ATP5B与前列腺癌的转移有关,抑制ATP5B的表达可导致肿瘤细胞的增殖、侵袭和转移能力降低。同时,ATP5B的表达也与鼻咽癌对放化疗的敏感性相关,LYNAM-LENNON等[21]研究表明:ATP5B高表达的肿瘤患者对新型辅助放化疗的病理学反应不佳。在急性髓系白血病中,复发或难治性患者体内ATP5B表达下调,与肿瘤原始细胞对阿霉素的反应性呈正相关关系[22-23]。
本研究采用大肠杆菌原核表达系统实现了ATP5B高效表达,纯化鉴定结果显示:该单克隆抗体具有高效价、高纯度和高特异性的优点,可用于组织中ATP5B蛋白水平检测、肿瘤诊断、靶向治疗及预后评估的研究。后续实验将依托制备的单克隆抗体验证ATP5B的表达与肿瘤发生发展的关系。
| [1] | WALLACE D C. Mitochondria and cancer[J]. Nat Rev Cancer, 2012, 12(10): 685–698. DOI:10.1038/nrc3365 |
| [2] | TAN A S, BATY J W, DONG L F, et al. Mitochondrial genome acquisition restores respiratory function and tumorigenic potential of cancer cells without mitochondrial DNA[J]. Cell Metab, 2015, 21(1): 81–94. DOI:10.1016/j.cmet.2014.12.003 |
| [3] | FORMENTINI L, MARTÍNEZ-REYES I, CUEZVA J M. The mitochondrial bioenergetic capacity of carcinomas[J]. IUBMB Life, 2010, 62(7): 554–560. |
| [4] | SENIOR A E. ATP synthase:motoring to the finish line[J]. Cell, 2007, 130(2): 220–221. DOI:10.1016/j.cell.2007.07.004 |
| [5] | GEYIK E, IGCI Y Z, PALA E, et al. Investigation of the association between ATP2B4 and ATP5B genes with colorectal cancer[J]. Gene, 2014, 540(2): 178–182. |
| [6] | XU G, LI J Y. ATP5A1 and ATP5B are highly expressed in glioblastoma tumor cells and endothelial cells of microvascular proliferation[J]. J Neurooncol, 2016, 126(3): 405–413. DOI:10.1007/s11060-015-1984-x |
| [7] | SUN J, YANG Z L, MIAO X, et al. ATP5b and β2-microglobulin are predictive markers for the prognosis of patients with gallbladder cancer[J]. J Mol Histol, 2015, 46(1): 57–65. DOI:10.1007/s10735-014-9597-9 |
| [8] | LU Z, SONG Q, SONG Q, et al. Preparation of monoclonal antibody against lung cancer and identification of its targeting antigen[J]. J Biomed Engineering, 2010, 27(1): 147–151. |
| [9] | 刘素霞. 重组单克隆抗体生产的宿主细胞系的研究进展[J]. 科技风, 2018, 9(25): 36. |
| [10] | SALTZ L. Systemic therapy for metastatic colorectal cancer[J]. J Natl Compr Canc Netw, 2013, 11(Suppl 5): 649–652. |
| [11] | SALTZ L B, LENZ H J, KINDLER H L, et al. Randomized phase Ⅱ trial of cetuximab, bevacizumab and irinotecan compared with cetuximab and bevacizumab alone in irinotecan-refractory colorectal cancer:the BOND-2 study[J]. J Clin Oncol, 2007, 25(29): 4557–4561. DOI:10.1200/JCO.2007.12.0949 |
| [12] | 邓云秋. EGFR单克隆抗体靶向药物治疗脑胶质瘤的研究进展[J]. 中国处方药, 2018, 16(8): 22–23. DOI:10.3969/j.issn.1671-945X.2018.08.013 |
| [13] | 朱慧, 李春蕊. 多发性骨髓瘤的免疫治疗进展[J]. 医药导报, 2018, 37(10): 1160–1165. |
| [14] | 赵源浩. 靶向抗肿瘤单克隆抗体类药物联合常规化疗方案治疗转移性结直肠癌的临床进展[J]. 中国药房, 2018, 29(14): 2012–2016. DOI:10.6039/j.issn.1001-0408.2018.14.31 |
| [15] | 刘志, 赵春清, 张彬, 等. VEGF、Bmi-1在结肠癌组织中的表达及意义[J]. 河北医药, 2016, 38(20): 3104–3106. |
| [16] | GREENING D W, LEE S T, JI H, et al. Molecular profiling of cetuximab and bevacizumab treatment of colorectal tumoursreveals perturbations in metabolic and hypoxic response pathways[J]. Oncotarget, 2015, 6(35): 38166–38180. |
| [17] | SÁNCHEZ-ARAGÓ M, CHAMORRO M, CUEZVA JM. Selection of cancer cells with repressed mitochondria triggers colon cancer progression[J]. Carcinogenesis, 2010, 31(4): 567–576. DOI:10.1093/carcin/bgq012 |
| [18] | REN L R, ZHANG L P, HUANG S Y, et al. Effects of sialidase NEU1 siRNA on proliferation, apoptosis, and invasion in human ovarian cancer[J]. Mol Cell Biochem, 2016, 411(1/2): 213–219. |
| [19] | FLIEDNER S M, YANG C, THOMPSON E, et al. Potential therapeutic target for malignant paragangliomas:ATP synthase on the surface of paraganglioma cells[J]. Am J Cancer Res, 2015, 5(4): 1558–1570. |
| [20] | LI W, LI Y, LI G, et al. Ectopic expression of the ATP synthase β subunit on the membrane of PC-3M cells supports its potential role in prostate cancer metastasis[J]. Int J Oncol, 2017, 50(4): 1312–1320. DOI:10.3892/ijo.2017.3878 |
| [21] | LYNAM-LENNON N, Maher SG, Maguire A, et al. Altered mitochondrial function and energy metabolism is associated with a radioresistant phenotype in oesophageal adenocarcinoma[J]. PLoS ONE, 2014, 9(6): e100738. DOI:10.1371/journal.pone.0100738 |
| [22] | XIAO X, YANG J, LI R, et al. Deregulation of mitochondrial ATPsyn-β in acute myeloid leukemia cells and with increased drug resistance[J]. PLoS ONE, 2013, 8(12): e83610. DOI:10.1371/journal.pone.0083610 |
| [23] | 蒋灵旭, 罗颖婉, 佟红艳. 急性髓系白血病靶向治疗新进展[J]. 中国实用内科杂志, 2018, 38(12): 1198–1202. |
 2019, Vol. 45
2019, Vol. 45


