扩展功能
文章信息
- 张客松, 徐晓麟, 韩青, 邹运, 陈炳鹏, 杨科荣, 姜浩, 王金成
- ZHANG Kesong, XU Xiaolin, HAN Qing, ZOU Yun, CHEN Bingpeng, YANG Kerong, JIANG Hao, WANG Jincheng
- 骨科去金属伪影技术在人工关节置换术CT检查中的应用
- Application of orthopedic metal artifact reduction technology in CT examination of arthroplasty
- 吉林大学学报(医学版), 2019, 45(01): 179-183
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 179-183
- 10.13481/j.1671-587x.20190134
-
文章历史
- 收稿日期: 2018-03-19
2. 吉林大学第二医院放射科, 吉林 长春 130041
2. Department of Radiology, Second Hospital, Jilin University, Changchun 130041, China
CT检查具有高空间分辨率的优势,在人工髋关节和人工膝关节置换术后的临床诊疗工作中有着不可或缺的作用[1-3]。然而人工关节假体在进行CT扫描时会产生严重的金属伪影从而干扰临床诊断治疗。金属伪影是由于金属与人体组织密度相差过大导致的,其中主要包括射束硬化金属伪影、光子饥饿伪影和散射伪影[4-5]。上述类型的金属伪影具有不同的产生原因、CT值及形态特征。金属伪影会对人工关节置换术并发症的诊断造成严重干扰,其中最主要的影响为伪影遮挡骨与假体交界面、假体周围骨折线、假体周围血管和神经等[6]。为了降低金属伪影对CT数据及诊断精度的影响,近年来关于去除伪影的研究层出不穷,其中加入去伪影算法被认为可以明显降低CT金属伪影[1-6],PHILIP 256排螺旋CT具有特有的骨科金属去伪影(orthopedics metal artifact reduction, O-MAR)技术。O-MAR技术是一种为消除骨科金属植入物产生的金属伪影而开发的迭代后处理技术,可减轻射束硬化伪影和光子饥饿伪影。近年来O-MAR技术开始应用于人工关节置换术、骨折内固定术和肿瘤放疗划分靶区过程中。本研究旨在探索O-MAR技术在人工髋关节和人工膝关节置换术后CT检查中去金属伪影效果,以期为关节外科临床诊疗工作提供合理的CT检查方案。
1 资料与方法 1.1 临床资料对2017年3月—2018年1月于吉林大学第二医院就诊的20例带有人工髋关节和人工膝关节假体的患者行PHILIPS 256排螺旋CT扫描,其中男性4例,女性16例,年龄39~78岁,平均年龄(63.1±10.5)岁;全髋关节置换术患者13例(单侧9例,双侧4例),全膝关节置换术患者7例(单侧6例,双侧1例)。
1.2 CT扫描方式使用256排螺旋CT (日本PHILIPS公司)对受检者进行CT扫描。每组CT数据包括2种电子管电压120和140千电子伏特(Kev),每个管电压组分别包括非O-MAR(-O-MAR)组和O-MAR(+O-MAR)组,每例患者CT数据中共包括4个分组CT数据,即120Kev/-O-MAR、120Kev/+O-MAR、140Kev/ -O-MAR和140Kev/+O-MAR组。每组扫描管电流固定为232mA,扫描层厚0.9mm,重建增量0.45 mm,扫描视野400 mm,准直宽度64 ×0.625,X线管旋转速度0.75s/周。120Kev组容积CT剂量指数(CTDIvol)为20.8mSv,剂量长度乘积(DLP)为705.3 mGy·cm。140Kev组CTDIvol为30.8mSv,DLP为1402.2 mGy·cm。
1.3 定性分析由1名高年资骨科医生(10年以上骨科临床经验)独立评价CT数据质量与伪影严重程度并做出评分,计算平均分,进行统计学分析。金属伪影评分标准:G0表示没有伪影(1分); G1表示有少量伪影,或者几乎没有伪影(2分); G2表示较多的金属伪影,轻度干扰邻近结构的评价(3分); G3表示较多的金属伪影,中度干扰邻近结构的评价(4分); G4表示严重的金属伪影,严重干扰了临近结构的评价(5分)。CT数据质量评分标准:G0为具有较高的临床诊断价值,良好的图像质量(1分); G1为满意的图像质量,较高的临床诊断价值(2分); G2为不满意的图像质量,临床诊断价值相对较差(3分); G3为严重损害图像质量,几乎无临床诊断价值(4分)。
1.4 定量分析三维测量方面,采用Mimics 21.0软件(比利时Materilase公司)对患者CT数据进行三维重建,测定每组数据射束硬化伪影和骨组织体积总和并进行统计学分析。研究以软件默认的骨组织窗位(226~2914 HU)进行划分阈值操作,重建后得到的三维模型为选定范围内骨组织、人工关节假体和射束硬化金属伪影体积总和,以布尔运算(Boolean calculation)减掉人工关节假体得出选定范围内骨组织和射束硬化金属伪影体积总和。由于选定范围内骨组织体积恒定,三维重建模型体积减小说明金属伪影体积减小(图 1,见插页四)。
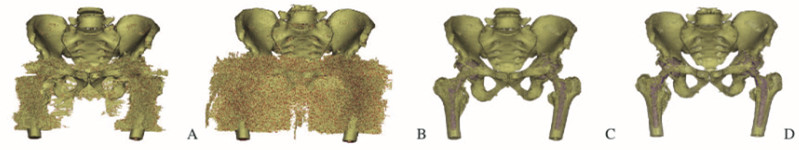
|
| A:120 Kev/-O-MAR group; B:140 Kev/-O-MAR group; C:120 Kev/+O-MAR group; D:140 Kev/+O-MAR group. 图 1 双侧全髋关节置换术患者CT数据的三维重建 Fig. 1 Three-dimensional reconstruction of CT data in patient with bilateral hip prostheses |
|
|
二维测量方面,采用Mimics软件分别对每组CT数据在相同层面和位置框选2个面积为104.3 mm2的矩形感兴趣区(region of interest, ROI), ROI 1选择在射束硬化金属伪影(放射状高密度伪影)严重的位置, ROI 2选择在光子饥饿伪影(条带状低密度伪影)严重的位置(图 2)。二维测量后对比ROI区域内平均CT值和标准差(SD)值,SD值代表CT噪声。
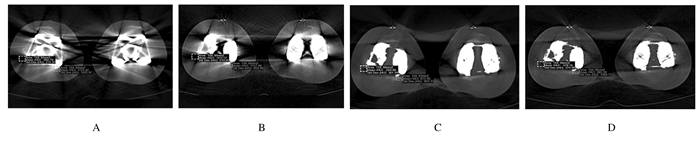
|
| A: 120 Kev/-O-MAR group; B: 140 Kev/-O-MAR group; C: 120 Kev/+O-MAR group; D: 140 Kev/+O-MAR group. 图 2 1例双侧膝关节置换术患者CT数据中平均CT值的测量 Fig. 2 Measurement of average CT values of CT data in a patient underwent bilateral knee arthoplastry |
|
|
采用SPSS 20.0统计软件进行统计学分析。金属伪影体积和ROI内平均CT值及SD均以x±s表示,组间比较采用配对t检验。以P<0.05表示差异有统计学意义。
2 结果 2.1 各组CT图像伪影严重程度和图像质量评分CT图像伪影严重程度评分:120Kev/-O-MAR组平均分为4.35分,140Kev/-O-MAR组平均分为4.10分,120Kev/+O-MAR组平均分为2.90分,140Kev/+O-MAR组平均分为2.25分。整体CT图像质量评分:120Kev/-O-MAR组平均分为2.75分,140Kev/-O-MAR组平均分为2.70分,120Kev/+O-MAR组平均分为1.80分,140Kev/+O-MAR组平均分为1.65分。见表 1。
| (x±s) | |||||||
| Group | Artifact score | CT quality score | Volume* (V/cm3) | ROI 1 CT value (HU) | ROI 2 CT value (HU) | ROI 1 SD(HU) | ROI 2 SD(HU) |
| 120 Kev/-O-MAR | 4.35±0.81 | 2.75±0.64 | 531.9±268.5 | 783.4±589.5 | -517.8±269.6 | 430.2±209.8 | 385.1±119.0 |
| 140 Kev/-O-MAR | 4.10±0.85 | 2.70±0.73 | 509.3±281.9 | 684.6±528.0 | -510.4±268.6 | 415.1±207.4 | 426.3±109.6 |
| 120 Kev/+O-MAR | 2.90±1.17 | 1.80±0.70 | 390.1±223.4 | 260.3±268.5 | -190.4±181.6 | 367.2±258.7 | 334.6±125.4 |
| 140 Kev/+O-MAR | 2.25±1.11 | 1.65±0.59 | 360.0±200.4 | 196.0±222.9 | -154.0±131.5 | 266.8±231.0 | 309.7±128.4 |
| *Volume: Summation volume of beam-hardening artifact and bone. | |||||||
CT图像伪影体积三维测量结果:120Kev/-O-MAR组射束硬化伪影和骨组织体积总和为(531.9±268.5)cm3(以120Kev/-O-MAR组体积为100%),140Kev/-O-MAR组为(509.3±281.9)cm3(95.8%),120Kev/+O-MAR组为(390.1±223.4)cm3(73.3%),140Kev/+O-MAR组为(360.0±200.4)cm3(67.7%)。除120Kev/-O-MAR组与140Kev/-O-MAR组间伪影体积比较差异无统计学意义(P=0.062)外,其余各组间伪影体积比较差异均有统计学意义(P < 0.05)。见表 1和2。
| Group | Volume | ROI 1 CT value | ROI 2 CT value | ROI 1 SD value | ROI 2 SDvalue |
| 120 Kev/-O-MAR vs 140 Kev/-O-MAR | 0.062 | 0.001* | 0.069 | 0.489 | 0.151 |
| 120 Kev/-O-MAR vs 120 Kev/+O-MAR | 0.010* | 0.000* | 0.000* | 0.134 | 0.189 |
| 140 Kev/-O-MAR vs 140 Kev/+O-MAR | 0.000* | 0.000* | 0.000* | 0.001* | 0.001* |
| 120 Kev/+O-MAR vs 140 Kev/+O-MAR | 0.000* | 0.001* | 0.034* | 0.000* | 0.359 |
| *P < 0.05 was considered significant difference. | |||||
二维测量ROI 1中平均CT值:120Kev/-O-MAR组为(783.4±589.5)HU,140Kev/-O-MAR组为(684.6±528.0)HU,120Kev/+O-MAR组为(260.3±268.5)HU,140Kev/+O-MAR组为(196.0±222.9)HU;ROI 2中平均CT值:120Kev/-O-MAR组为(―517.8±269.6)HU,140Kev/-O-MAR组为(-510.4±268.6) HU,120Kev/+O-MAR组为(-190.4±181.6) HU,140Kev/+O-MAR组为(-154.0±131.5) HU。除ROI 2中120Kev/-O-MAR组与140Kev/-O-MAR组间平均CT值比较差异无统计学意义(P=0.069)外,其余各组间平均CT值比较差异均有统计学意义(P < 0.05)。见表 1和2。
3 讨论金属伪影可对CT图像质量造成破坏并降低数据的临床诊断意义。人工关节置换术患者在进行CT扫描时产生的金属伪影会遮挡骨组织及假体周围重要结构,掩盖假体周围骨折、假体松动和假体下沉等并发症,严重干扰骨科的临床诊疗工作。
在众多去金属伪影方法里,加入金属去伪影算法可以明显减小CT金属伪影[1-6]。TANG等[2]对48例需要进行翻修手术的非骨水泥全髋关节置换术患者分别应用X线、普通CT扫描和层析合成去金属伪影技术(TMAR)重建CT扫描进行假体松动的术前评估,TMAR、X线和CT对股骨柄假体松动的诊断正确率分别为82.6%、44.6%和39.6%。TMAR可以明显提高全髋关节置换术假体松动诊断的准确率。HAN等[7]对33例全髋关节置换术患者进行了CT去伪影研究发现加入去金属伪影(MAR)技术后CT数据质量明显提高,代表CT噪声的SD值明显降低。以往关于MAR的研究主要集中于二维水平对ROI内CT值和SD的测量,单一层面的测量往往忽略了整体CT数据金属伪影情况的评估[8-17]。本研究对金属伪影严重程度和整体CT数据质量进行了定性与定量分析,同时进行CT三维重建体积测量和二维图像ROI内CT值和SD的测量。
本研究采用O-MAR技术使CT数据质量和临床诊断价值得到明显改善和提高,同时证明O-MAR技术具有消除射束硬化金属伪影和光子饥饿伪影的能力。KOMLOSI等[4]指出:传统的多能CT仅对于去除射束硬化金属伪影有效,而不能去除光子饥饿伪影。在本研究测量金属伪影体积方面,由于射束硬化伪影CT值近似于骨组织,三维模型分离难度大,所以本研究分析射束硬化伪影和骨组织体积总和,在应用O-MAR技术重建后,120Kev组三维模型体积由531.9cm3(100%)降低至390.1cm3(73.3%),三维模型体积减少部分为O-MAR技术去除的射束硬化伪影体积。本研究结果显示:电子管电压由120 Kev增加至140 Kev时同样可以减少射束硬化金属伪影的体积。在二维测量方面,本研究中ROI 1和ROI2分别选择在射束硬化伪影和光子饥饿伪影严重的区域。由于射束硬化伪影的高CT值和光子饥饿伪影的低CT值,ROI 1区域内CT值的降低和ROI 2区域CT值的升高表示金属伪影减少。本研究结果显示:加入O-MAR算法后各组ROI 1平均CT值明显降低,ROI 2平均CT值明显升高,本研究通过对平均CT值的还原效果证实了O-MAR技术对于射束硬化伪影和光子饥饿伪影的去除作用。
本研究采用O-MAR技术去除CT金属伪影同时发现:O-MAR技术的加入会使骨皮质和骨小梁的成像变得模糊。另外本研究尚有以下不足之处:①本研究仅收集了20例带有人工髋关节和人工膝关节假体患者CT数据,且男女比例不均衡,未来应纳入更多的CT数据,并对男女比例进行调整。②在数据测量方面没有对CT图像信噪比和噪声比等数据进行计算和分析。③O-MAR技术可以降低CT图像的对比度和骨组织的显影强度,但是对于这一现象本研究未进行详细的量化分析。④ROI的选择只能靠操作者主观判断金属伪影严重的区域进行划分,在一定程度影响了结果的客观性。
综上所述,O-MAR技术可以明显降低人工关节假体在CT扫描时产生的射束硬化和光子饥饿金属伪影,同时可以提高整体CT数据质量和临床诊断价值。O-MAR技术虽然可以降低CT图像的噪声(即SD值),但是尚未达到研究预期的效果。
| [1] | KATSUMURA S, SATO K, IKAWA T, et al. "High-precision, reconstructed 3D model" of skull scanned by conebeam CT:Reproducibility verified using CAD/CAM data[J]. Leg Med (Tokyo), 2016, 18: 37–43. DOI:10.1016/j.legalmed.2015.11.007 |
| [2] | TANG H, YANG D, GUO S, et al. Digital tomosynthesis with metal artifact reduction for assessing cementless hip arthroplasty:a diagnostic cohort study of 48 patients[J]. Skeletal Radiol, 2016, 45(11): 1523–1532. DOI:10.1007/s00256-016-2466-8 |
| [3] | NARDI C, BORRI C, REGINI F, et al. Metal and motion artifacts by cone beam computed tomography (CBCT) in dental and maxillofacial study[J]. Radiol Med, 2015, 120(7): 618–626. DOI:10.1007/s11547-015-0496-2 |
| [4] | KOMLOSI P, GRADY D, SMITH J S, et al. Evaluation of monoenergetic imaging to reduce metallic instrumentation artifacts in computed tomography of the cervical spine[J]. J Neurosurg Spine, 2015, 22(1): 34–38. |
| [5] | BOUNDABBOUS S, ARDITI D, PAULIN E, et al. Model-based iterative reconstruction (MBIR) for the reduction of metal artifacts on CT[J]. AJR Am J Roentgenol, 2015, 205(2): 380–385. DOI:10.2214/AJR.14.13334 |
| [6] | JEONG S, KIM S H, HWANG E J, et al. Usefulness of a metal artifact reduction algorithm for orthopedic implants in abdominal CT:phantom and clinical study results[J]. AJR Am J Roentgenol, 2015, 204(2): 307–317. DOI:10.2214/AJR.14.12745 |
| [7] | HAN S C, CHUNG Y E, LEE Y H, et al. Metal artifact reduction software used with abdominopelvic dual-energy CT of patients with metal hip prostheses:assessment of image quality and clinical feasibility[J]. AJR Am J Roentgenol, 2014, 203(4): 788–795. DOI:10.2214/AJR.13.10980 |
| [8] | ELLIOTT M J, SLAKEY J B. CT provides precise size assessment of implanted titanium alloy pedicle screws[J]. Clin Orthop Relat Res, 2014, 472(5): 1605–1609. DOI:10.1007/s11999-014-3494-0 |
| [9] | WINKLHOFER S, BENNINGER E, SPROSS C, et al. CT metal artefact reduction for internal fixation of the proximal humerus:value of mono-energetic extrapolation from dual-energy and iterative reconstructions[J]. Clin Radiol, 2014, 69(5): e199–206. DOI:10.1016/j.crad.2013.12.011 |
| [10] | FILLI L, LUECHINGER R, FRAUENFERLDER T, et al. Metal-induced artifacts in computed tomography and magnetic resonance imaging:comparison of a biodegradable magnesium alloy versus titanium and stainless steel controls[J]. Skeletal Radiol, 2015, 44(6): 849–856. DOI:10.1007/s00256-014-2057-5 |
| [11] | RADZI S, COWIN G, ROBINSON M, et al. Metal artifacts from titanium and steel screws in CT, 1.5T and 3T MR images of the tibial Pilon:a quantitative assessment in 3D[J]. Quant Imaging Med Surg, 2014, 4(3): 163–172. |
| [12] | MANOLIU A, HO M, NANZ D, et al. MR neurographic orthopantomogram:Ultrashort echo-time imaging of mandibular bone and teeth complemented with high-resolution morphological and functional MR neurography[J]. J Magn Reson Imaging, 2016, 44(2): 393–400. DOI:10.1002/jmri.25178 |
| [13] | KAEWLEK T, KOOLPIRUCK D, THONGVIGITMANEE S, et al. Metal artifact reduction and image quality evaluation of lumbar spine CT images using metal sinogram segmentation[J]. J Xray Sci Technol, 2015, 23(6): 649–666. |
| [14] | XIE S, LI C, LI H, et al. A level set method for cupping artifact correction in cone-beam CT[J]. Med Phys, 2015, 42(8): 4888–4895. DOI:10.1118/1.4926851 |
| [15] | FRAGA-MANTEIGA E, SHAW D J, Dennison S, et al. An optimized computed tomography protocol for metallic gunshot head trauma in a seal model[J]. Vet Radiol Ultrasound, 2014, 55(4): 393–398. DOI:10.1111/vru.2014.55.issue-4 |
| [16] | ZIEMANN C, STILLE M, CREMERS F, et al. The effects of metal artifact reduction on the retrieval ofattenuation values[J]. J Appl Clin Med Phys, 2017, 18(1): 243–250. |
| [17] | WELLENBERG R H H, DONDERS J C E, KLOEN P, et al. Exploring metal artifact reduction using dual-energy CT with pre-metal and post-metal implant cadaver comparison:are implant specific protocols needed?[J]. Skeletal Radiol, 2017, 47(6): 839–845. |
 2019, Vol. 45
2019, Vol. 45


