扩展功能
文章信息
- 林元强, 姜博, 李鹤群, 金春香, 王辉
- LIN Yuanqiang, JIANG Bo, LI Hequn, JIN Chunxiang, WANG Hui
- 肝脏渡越时间在门静脉高压-食管胃底静脉曲张患者门静脉压力评估中的应用
- Application of hepatic transit time in portal vein pressure assessment in patients with portal hypertension and esophago gastric varices
- 吉林大学学报(医学版), 2019, 45(01): 170-174
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 170-174
- 10.13481/j.1671-587x.20190132
-
文章历史
- 收稿日期: 2018-05-28
2. 吉林大学中日联谊医院南湖院区普通外科, 吉林 长春 130012
2. Department of General Surgery, Nanhu Hospital, China-Japan Union Hospital, Jilin University, Changchun 130012, China
门脉高压症是肝硬化患者常见的并发症,容易引起上消化道大出血,是导致肝硬化患者死亡的主要原因之一[1]。因此,门静脉压升高被认为是肝硬化患者预后不良的因素[2-3]。门静脉压力的测量有多种方法,其中肝静脉压力梯度(hepatic vein pressure gradient, HVPG)是反映门静脉压力的金标准,但该方法测出的结果为间接反映门静脉压力的指标,且该有创方法无法对病情进行日常监测,其他检测方式的可靠性仍有争议,因此寻找一种简单易行观察门静脉压力的方式就成为临床研究的重点之一[4]。超声检查是临床最常用的肝脏检查方法,研究[5-9]显示:超声造影测量出的肝脏渡越时间与纤维化程度呈反比,而肝硬化程度和门静脉的压力呈正比。既往研究[10]多关注肝脏渡越时间与肝静脉压力梯度的关系,不够客观准确,而本研究探讨了肝脏渡越时间评估门静脉高压-食管胃底静脉曲张患者自由门静脉压(free portal pressure, FPP)的临床意义,以期为门脉高压症患者的诊断和治疗方案的制定提供依据。
1 资料与方法 1.1 研究对象选择2015年1月—2017年12月在吉林大学中日联谊医院因门静脉高压-食管胃底静脉曲张行食管胃底曲张静脉栓塞术的住院患者50例作为观察组,其中男性34例,女性16例,平均年龄(57.31±8.82)岁;其中乙型肝炎肝硬化32例,丙型肝炎肝硬化10例,酒精性肝硬化8例。选择无肝病病史及肝病临床表现患者(住院或门诊)50例作为对照组,其中男性32例,女性18例,平均年龄(58.06±7.72)岁。观察组与对照组患者性别构成和年龄分布比较差异均无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会研究并予以通过。
观察组患者纳入标准:确诊为门静脉高压-食管胃底静脉曲张;确诊为肝硬化;对本次研究知情同意。对照组患者纳入标准:肝功能和胆红素指标正常;消化道检查无异常;乙型肝炎和丙型肝炎免疫学检查均为阴性;对本次研究知情同意。
观察组和对照组患者排除标准:肝脏占位性病变或肝脏手术史;门静脉有血栓或支架;有脾切除术+分流或断流等对门静脉血流动力学产生影响的手术史;1周内有消化道出血症状;3个月内有普萘洛尔等影响血流动力学药物服用史;超声无法对第一肝门结构及肝静脉清晰显示。
1.2 方法2组患者均行肝脏超声造影,观察组患者在超声引导下行门静脉穿刺,置管至肝门部门静脉主干内直接测量FPP。
1.2.1 肝脏造影方法超声诊断仪为日立ARIETTA 70(日立阿洛卡医疗株式会社),具有造影谐波成像技术及造影分析软件(TOSHIBA CHI-Q),探头型号为3.5C,机械指数为0.08~0.12。造影剂为意大利Bracco公司生产的微泡声学造影剂SonoVue,检查前在SonoVue冻干粉末中注入5 mL生理盐水,震荡使其成为混悬液。先对患者肝脏进行常规超声检查,选取右肋间同时显示肝动脉、门静脉及肝右静脉的切面为造影切面,然后经肘静脉团注造影剂0.04 mL·kg-1,快速尾随推注5mL生理盐水,造影过程中嘱患者平静呼吸,不要深呼吸,不要活动。从造影剂注射时开始计时,采集图像,脱机进行分析,分别绘制肝动脉、门静脉、肝实质和肝静脉的时间-强度曲线,以造影强度达到基础强度的110%时为造影剂到达时间,分别测量肝动脉、门静脉、肝实质和肝静脉造影剂到达时间:肝动脉造影剂到达时间与肝静脉造影剂到达时间之差,即为肝动脉-肝静脉渡越时间(hepatic arteryhepatic vein transit time,HA-HVTT),门静脉造影剂到达时间与肝静脉造影剂到达时间之差,即为门静脉-肝静脉渡越时间(hepatic portal vein-hepatic vein transit time,PV-HVTT),肝实质造影剂到达时间与肝静脉造影剂到达时间之差,即为肝实质-肝静脉渡越时间(liver parenchyma-hepatic vein transittime,PA-HVTT)。
1.2.2 FPP测量仪器及方法M7便携式彩色多普勒超声诊断系统(深圳迈瑞生物医疗公司),Artis zee floor落地式血管造影系统(德国SIEMENS公司),16GA 5.25IN一次性使用静脉留置针(美国BD公司),RF*GA35153M导丝、5Fr静脉穿刺鞘和5Fr COBRA导管(日本Terumo公司),IntelliVue MP5多参数监护仪[荷兰PHILIPS公司, 心电监护仪选择有创血压测定模块,因模块中无门静脉压力测量选项,所以选择测量中心静脉压的(CVP)选项]。患者仰卧于介入手术台上,超声择点定位,术区及周围皮肤常规强力碘消毒,铺无菌巾单。2%利多卡因局麻生效后,超声引导下以静脉留置针经皮经肝穿刺肝内门静脉,穿刺成功后X线透视下注射造影剂证实,至局部门静脉显示清晰后引入导丝,使用静脉穿刺鞘扩张,引入6F造影导管至肝门部门静脉内,注射造影剂证实后连接自动测压装置,嘱患者平静呼吸,测量患者FPP,反复测量3次取平均值。
1.2.3 分析指标观察2组患者HA-HVTT、PV-HVTT和PA-HVTT数值,并进行比较。分析观察组患者HA-HVTT、PV-HVTT和PA-HVTT与FPP的相关性, 得出Pearson相关系数(r)。对观察组患者HA-HVTT、PV-HVTT和PA-HVTT与FPP的线性关系进行回归分析。
1.3 统计学分析采用SPSS 19.0统计软件进行统计学分析。观察组患者HA-HVTT、PV-HVTT、PA-HVTT和FPP数据以x±s表示,2组间样本均数比较采用两独立样本t检验。观察组患者HA-HVTT、PV-HVTT和PA-HVTT与FPP的相关性采用Pearson相关性分析,HA-HVTT、PV-HVTT和PA-HVTT与FPP的线性关系采用回归分析法。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者肝脏超声造影2组患者经超声造影、采集图像和脱机分析均可得出肝动脉、门静脉、肝实质和肝静脉的时间-强度曲线,进而测量出HA-HVTT、PV-HVTT和PA-HVTT数值。观察组典型病例超声造影见图 1(插页四)。观察组和对照组患者HA-HVTT、PV-HVTT和PA-HVTT均呈正态分布,观察组患者HA-HVTT、PV-HVTT和PA-HVTT较对照组明显缩短,2组间比较差异均有统计学意义(P < 0.01)。见表 1。

|
| A:Measurement of HA-HVTT; B:Measurement of PV-HVTT; C: Measurement of PA-HVTT. 图 1 观察组患者超声造影结果和肝脏渡越时间测量 Fig. 1 Contrast enhanced ultrasound result and hepatic transit time of patients in observation group |
|
|
| (n=50, x±s, t/s) | |||
| Group | HA-HVTT | PV-HVTT | PA-HVTT |
| Control | 12.218±2.199 | 9.597±1.553 | 3.868±0.933 |
| Observation | 9.987±2.194 | 5.427±1.862 | 3.221±1.452 |
| t | 5.078 | 12.163 | 2.649 |
| P | <0.01 | <0.01 | <0.01 |
观察组患者需行食管胃底曲张静脉栓塞术,超声引导下经皮经肝穿刺肝内门静脉,一次性穿刺成功率100%,穿刺成功后引入造影导管至门静脉主干内,注入造影剂证实导管位置,连接自动测压装置,测量FPP。典型病例门静脉FPP测量见图 2,该例患者FPP值为(4.7±0.4)kPa。
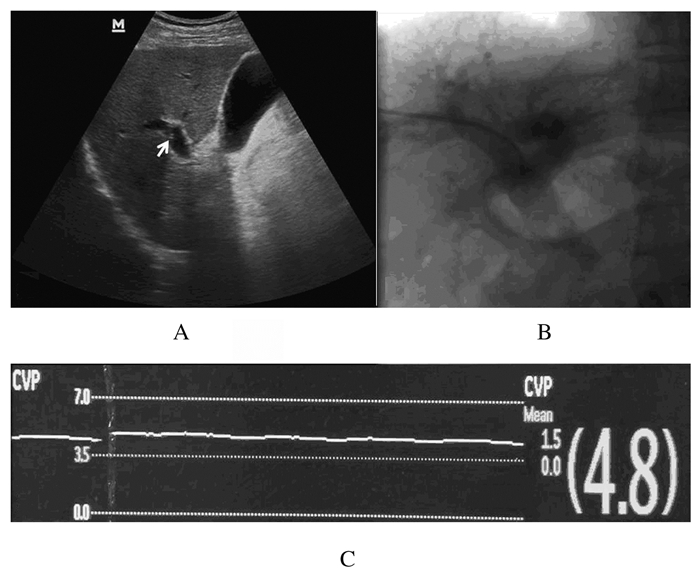
|
| A: Ultrasound guided percutaneous transhepatic puncture of the right hepatic portal vein, the tip of the vein indwelling needle (arrowed) was successfully inserted into the portal vein; B:The contrast catheter was successfully introduced into the portal vein trunk; C:The other end of the catheter was connected with an automatic pressure measuring device to directly measure the FPP. 图 2 超声造影测量观察组患者FPP Fig. 2 FPP of patient in observation group detected with contrast enhanced ultrasound |
|
|
对观察组患者HA-HVTT、PV-HVTT和PA-HVTT与FPP进行相关性分析,HA-HVTT、PV-HVTT和PA-HVTT与FPP均呈负相关关系(r=-0.799,P < 0.01;r=-0.554,P < 0.01;r=-0.735,P < 0.01)。
应用回归分析法判断观察组患者HA-HVTT、PV-HVTT和PA-HVTT与FPP的线性关系,HA-HVTT与FPP的线性关系为Y=-0.410X+7.254,PV-HVTT与FPP的线性关系为Y=-0.355X+4.983,PA-HVTT与FPP的线性关系为Y=-0.566X+4.997。
2.4 2组患者的并发症2组患者行超声造影检查前后生命体征均无明显变化,观察组患者测量FPP后继续行食管胃底曲张静脉栓塞术,术后患者生命体征平稳,无相关并发症发生。
3 讨论门静脉压力是衡量肝硬化患者病情进展及预后的重要指标,其测定有多种方法,HVPG是临床评估门静脉高压的金标准。既往的研究已经证实肝脏渡越时间与HVPG呈负相关关系,本研究通过分析食管胃底静脉曲张患者肝脏渡越时间和FPP之间的关系,也进一步证明了上述观点,且更为客观准确。
HVPG实际测量的是肝窦压,并不是门静脉直接压力,两者之间存在着一定的差异, KUMAR等[11]在报道中指出:HVPG=12 mmHg是曲张静脉破裂出血的一个临界值,而临床通常认为FPP≥22 mmHg是食管胃底曲张静脉破裂出血的阈值。另外,HVPG是一种有创性操作[12],技术要求高,价格昂贵,无法作为日常监测手段[13]。其他间接测量门静脉压力的方法准确性差,影响因素多,一直受到质疑[14]。传统直接测量门静脉压力的方法仅局限于术中,操作性差,且容易受麻醉药物和应激状态的影响。本研究采用超声引导下穿刺肝内门静脉,穿刺成功后引入造影导管至门静脉主干内,连接测压装置测量FPP,该方法优点如下:①使用超声引导下穿刺,穿刺针实时进入门脉内,准确率高,本研究50例患者一次性穿刺成功率100%;引入导管后放射线造影可以确认导管位置;连接自动测压装置后测量FPP,测量结果更加客观准确。②获取FPP,可客观真实反应门静脉实际压力,受影响小,为进一步的研究提供准确材料。本研究中测压装置测出的门静脉压力曲线为一伴轻微波动的曲线。③超声引导下穿刺肝内门静脉,可以避免损伤其他组织,安全性高;放射线引导下可以封堵穿刺路径,预防出血,并发症少,本研究50例患者均无相关并发症。
本研究结果显示:观察组患者HA-HVTT、PV-HVTT和PA-HVTT均明显短于对照组。分析其原因可能是:一方面肝组织纤维化、结节再生、血管闭塞会使肝内的微循环发生明显改变;另一方面,去甲肾上腺素等血管收缩剂明显升高,从而导致肝脏血管的血流动力学发生变化。上述两方面的原因使患者门静脉压力增高,肝脏血管出现了代偿,在肝内出现大量的侧支循环和异常血管通路,将肝动脉、肝静脉和门静脉密切联系在一起,血液经过时间明显缩短,因此造影剂经过时间也明显缩短[15-17]。在肝外出现门体侧支循环开放和静脉曲张,患者以上消化道出血、腹水和脾脏增大为主要临床表现[18-19]。
超声造影为超声的临床应用提供了更广阔的空间[20]。临床研究[6-8]显示:HA-HVTT、PV-HVTT和PA-HVTT随着纤维化程度的加重而缩短。正常情况下,门静脉压力随着纤维化程度的加重而增加,因此HA-HVTT、PV-HVTT和PA-HVTT与门静脉压力之间应该具有一定的相关性[21]。本研究结果显示:观察组患者HA-HVTT、PV-HVTT、PA-HVTT与FPP均呈负相关关系,说明HA-HVTT、PV-HVTT和PA-HVTT均随着FPP的升高而降低,该趋势在HA-HVTT中表现最为明显;通过回归分析也证明了这一点,HA-HVTT与FPP线性关系为Y=-0.410X+7.254,PV-HVTT与FPP线性关系为Y=-0.355X+4.983,PA-HVTT与FPP线性关系为Y=-0.566X+ 4.997。HA-HVTT、PV-HVTT、PA-HVTT与FPP呈负相关关系的原因目前尚未完全明确,考虑可能随着肝硬化病情发展,肝窦挤压变形程度加大,门静脉系统的压力进一步升高,使得侧支循环更加丰富,异常吻合支更多,从而使得HA-HVTT、PV-HVTT和PA-HVTT变得更短。
肝脏渡越时间与门静脉压力之间关系的确定对门脉高压症患者的临床诊断、治疗、预后分析和病情监测均具有重要意义[22]。肝脏渡越时间能够反映门静脉压力的情况,从而为后续治疗方案的制定提供重要依据。对于较高的门静脉压力,尽早进行相关治疗,防止消化道出血等严重并发症的发生。而对于治疗的患者,检测肝脏渡越时间就能够观察治疗方案是否有效,从而能够及时调整方案。
综上所述,与无肝病患者比较,门静脉高压-食管胃底静脉曲张患者肝脏渡越时间明显缩短,且与门静脉压力呈负相关关系,随门静脉压力的升高而变短。因此肝脏渡越时间可以作为判断门静脉压力的有效指标,为门静脉高压患者的诊断和治疗方案的制定提供理论依据。
| [1] | SIRLI R, SPOREA I, POPESCU A, et al. Ultrasound-based elastography for the diagnosis of portal hypertension in cirrhotics[J]. World J Gastroenterol, 2015, 21(41): 11542–11551. DOI:10.3748/wjg.v21.i41.11542 |
| [2] | THABUT D, MOREAU R, LEBREC D. Noninvasive assessment of portal hypertension in patients with cirrhosis[J]. Hepatology, 2011, 53(2): 683–694. DOI:10.1002/hep.24129 |
| [3] | ADDLEY J, THAM T C, CASH W J. Use of portal pressure studies in the management of variceal haemorrhage[J]. World J Gastrointest Endosc, 2012, 4(7): 281–289. DOI:10.4253/wjge.v4.i7.281 |
| [4] | RINCON D, LOIACONO O, TEJEDOR M, et al. Prognostic value of hepatic venous pressure gradient in patients with compensated chronic hepatitis C-related cirrhosis[J]. Scand Gastroenterol, 2013, 48(4): 487–495. DOI:10.3109/00365521.2012.711848 |
| [5] | QIU L, ZHANG X, LIU D, et al. Contrast-enhanced ultrasonography diagnostic evaluation of esophageal varices in patients with cirrhosis[J]. Ultrasound Q, 2016, 32(2): 136–143. |
| [6] | KIM M Y, SUK K T, BAIK S K, et al. Hepatic vein arrival time as assessed by contrast-enhanced ultrasonography is useful for the assessment of portal hypertension in compensated cirrhosis[J]. Hepatology, 2012, 56(3): 1053–1062. DOI:10.1002/hep.25752 |
| [7] | TAVANGAR S M, NASER RAKHSHANI N, GHODRAT MONTAZERI, et al. The effect of NAFLD(non-alcoholic fatty liver disease)on long-term outcome of chronic hepatitis B in Iranian patients[J]. Open J Gastroenterol, 2012, 2(1): 218–221. |
| [8] | GOBEL T, ERHARDT A, HERWIG M, et al. High prevalence of significant liver fibrosis and cirrhosis in chronic hepatitis B patients with normal ALT in central Europe[J]. JMed Virol, 2011, 83(6): 968–973. |
| [9] | BOLOGNESI M, PASCOLI M D, SACERDOTI D. Clinical role of non-invasive assessment of portal hypertension[J]. World J Gastroenterol, 2017, 23(1): 1–10. DOI:10.3748/wjg.v23.i1.1 |
| [10] | KOLLER T, PIESTANSKA Z, HLAVATY T, et al. Hepatic transit times and liver elasticity compared with meld in predicting a 1 year adverse clinical outcome of a clinically diagnosed cirrhosis[J]. Vnitr Lek, 2016, 62(5): 351–359. |
| [11] | KUMAR A, SHARMA P, SARIN S K. Hepatic venous pressure gradient measurement:time to learn![J]. Indian J Gastroenterol, 2008, 27(2): 74–80. |
| [12] | RIPOLL C, GROSZMANN R, GARCIA-TSAO G, et al. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis[J]. Gastroenterology, 2007, 133(2): 481–488. DOI:10.1053/j.gastro.2007.05.024 |
| [13] | WANG T, LIANG F, ZHOU Z, et al. Global sensitivity analysis of hepatic venous pressure gradient (HVPG) measurement with a stochastic computational model of the hepatic circulation[J]. Comp Biol Med, 2018, 97(1): 124–136. |
| [14] | BERZIGOTTI A, PISCAGLIA E. Ultrasound in portal hypertension-part2-and EFSUMB recommendations for the performance and reporting of ultrasound examinations in portal hypertension[J]. Ultraschall Med, 2012, 33(1): 8–32. DOI:10.1055/s-0031-1299145 |
| [15] | ABBATTISTA T, RIDOLFI F, CONSALVO G T, et al. Hepatic vein arrival time for diagnosis of liver cirrhosis:A 10-year single-center experience with contrast-enhanced sonography[J]. J Ultrasound Med, 2016, 35(10): 2121–2128. DOI:10.7863/ultra.15.09026 |
| [16] | MARUYAMA H, YOKOSUKA O. Ultrasonography for noninvasive assessment of portal hypertension[J]. Gut Liver, 2017, 11(4): 464–473. DOI:10.5009/gnl16078 |
| [17] | MARUYAMA H, SHIHA G, YOKOSUKA O, et al. Non-invasive assessment of portal hypertension and liver fibrosis using contrast-enhanced ultrasonography[J]. Hepatol Int, 2016, 10(2): 267–276. DOI:10.1007/s12072-015-9670-9 |
| [18] | GARCIA-TSAO G, SANYAL A J, GRACE N D, et al. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis[J]. Hepatology, 2007, 46(3): 922–938. DOI:10.1002/hep.v46:3 |
| [19] | GARCÍA-PAGÁN J C, GRACIA-SANCHO J, BOSCH J. Functional aspects on the pathophysiology of portal hypertension in cirrhosis[J]. J Hepatol, 2012, 57(2): 458–461. DOI:10.1016/j.jhep.2012.03.007 |
| [20] | ZHANG C X, HU J, HU K W, et al. Noninvasive analysis of portal pressure by contrast-enhanced sonography in patients with cirrhosis[J]. J Ultrasound Med, 2011, 30(2): 205–211. DOI:10.7863/jum.2011.30.2.205 |
| [21] | LUISA S, VITALE G, SORBO A R, et al. Hepatic vein transit time of second-generation ultrasound contrast agent:new tool in the assessment of portal hypertension[J]. J Ultrasound, 2017, 20(1): 43–52. DOI:10.1007/s40477-016-0226-1 |
| [22] | ABBATTISTA T, RIDOLFI F, CIABATTONI E, et al. Diagnosis of liver cirrhosis by transit-time analysis at contrast-enhanced ultrasonography[J]. Radio Med, 2008, 113(6): 860–874. DOI:10.1007/s11547-008-0292-3 |
 2019, Vol. 45
2019, Vol. 45


