扩展功能
文章信息
- 鲁明月, 李静
- LU Mingyue, LI Jing
- 中国胃癌患者癌组织中IGF-1表达与临床病理参数关联性的Meta分析
- Relationships between expression of IGF-1 in cancer tissue of gastric cancer patients and clinicopathological parameters in China: A Meta-analysis
- 吉林大学学报(医学版), 2019, 45(01): 137-142
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 137-142
- 10.13481/j.1671-587x.20190125
-
文章历史
- 收稿日期: 2018-07-10
胃部恶性肿瘤是全世界癌症相关死亡的主要原因之一,每年约有99万人被诊断为胃癌,约73.8万例患者疾病的结局为死亡。中国胃癌的发生率和死亡率分别占全世界胃癌发生率和死亡率的42.6%和45.0%,居全世界范围内的第5和第6位[1]。目前化学药物治疗仍然是治疗癌症最有效的手段之一,所以探寻高度特异性与敏感性的分子生物学检测指标对胃癌的诊断和治疗有着非常重要的意义。胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)是一种由肝脏合成和分泌的在分子结构上与胰岛素类似的多肽蛋白物质,是人体内非常重要的细胞有丝分裂促进剂,在外周组织发挥作用,通过增加DNA合成和刺激特异性周期蛋白-D1表达发挥其促有丝分裂活性,加快G1期细胞向S期转变。此外,IGF-1还激发癌基因Bcl-2编码产物的表达,抑制促凋亡基因Bax的表达,Bcl-2/Bax的比例升高,阻滞肿瘤细胞凋亡,同时促进肿瘤细胞增殖,对肿瘤细胞的耐药性起关键作用[2-3],故IGF-1作为内分泌激素及其信号转导系统对肿瘤发生具有重要意义。国内外研究[4-5]显示:IGF-1与胃癌的发生、发展、浸润和转移过程有密切关联,但对IGF-1表达与胃癌患者临床病理因素联系的研究结果不尽一致,可能与研究目标、方式、前提及统计方法等因素有关。动物实验和临床试验均已证实IGF-1参与胃癌的发生发展[6],但目前尚无相关领域的Meta分析。因此,本文作者对关于IGF-1表达与胃癌关联性的文献资料进行全面检索,采用Meta分析的方法对文献资料进行系统评价,进一步明确IGF-1在胃癌中表达的意义,以期为胃癌的病因研究和临床治疗新靶点提供循证医学的依据。
1 资料与方法 1.1 纳入和排除标准 1.1.1 纳入标准① 研究对象:包括中国胃癌患者癌组织中IGF-1表达与胃癌患者临床病理参数关系的国内外已发表并提供原始数据的病例对照研究;②所有病例均有完整的临床病理资料,取材前均未行化学治疗或放射治疗;所有研究对象均不受年龄和种族限制;③IGF-1检测为免疫组织化学二步法,阳性判别标准为细胞质有棕黄色颗粒出现,同时染色程度着色适中以上,着色细胞占总计数细胞的百分比>5%为阳性;④统计方法恰当,数据质量可靠,对于重复发布或资料雷同的研究仅保留方法学质量较好的研究。
1.1.2 排除标准① 未在研究中给出原始数据;②病例诊断标准不明确;③IGF-1检测判断标准不一致者;④重复报告或资料雷同、质量较差等无法利用的文献;⑤综述和摘要。
1.2 文献检索计算机检索PubMed、中国知网、维普中文科技期刊数据库、万方数据库和中国生物医学文献数据库等,收集包含中国胃癌患者癌组织中IGF-1表达与临床病理参数关系的病例对照研究,检索时限均从建库至2018年2月28日。英文检索式为IGF-1、insulin-like growth factor-1和gastric cancer、gastric carcinoma、stomach neoplasms、stomach cancer。中文检索式为IGF-1、胰岛素样生长因子1和胃癌、胃肿瘤、胃恶性肿瘤或胃部恶性肿瘤。同时采用百度学术等搜索引擎查找相关文献,并追溯已纳入文献的参考文献,以期扩大检索范围。
1.3 文献筛选和资料提取选用统一的资料提取表,由2名研究人员独立地根据纳入标准与排除标准筛选文献、提取资料并进行数据整理,不一致的部分进行讨论商议,最终达到一致。内容主要包括:①一般资料:题目、作者、发表日期和文献来源;②研究特征:各组患者的基本资料,胃癌组织与非肿瘤胃黏膜组织IGF-1的阳性表达率、组织学分级、浸润深度、淋巴结转移和临床分期。
1.4 方法学质量评价参考LICHTENSTEIN等[7]的质量评价指南,从下列几个方面对各独立的病例对照研究进行质量评价,判断各个研究是否存在偏倚及其偏倚的影响程度:①纳入文献的研究对象病理明确诊断为胃癌的患者,其基本构成特征如胃癌组织与非肿瘤的胃黏膜组织、组织学分级、浸润深度、淋巴结转移和TNM分期等是否明确;②IGF-1检测是否采用免疫组织化学法进行;③统计学方法是否得当,如胃癌组织与对照组中IGF-1的阳性表达率比较是否采用χ2检验,相关性检验是否采用Spearman等级相关分析;④纳入文献的实验设计是否为病例对照研究;⑤是否讨论了本研究可能存在的偏倚。上述5项,每符合一项算1分,总分≥3分者为质量可靠文献,研究者对质量评分低的部分文献讨论后剔除。
1.5 统计学分析采用Review Manager 5.2软件进行Meta分析。计算比值比(OR)及其95%置信区间(95%CI)作为效应量表示结果。采用χ2检验和I2判断各研究结果之间有无异质性,当P>0.10、I2≤50%,可认为多个同类研究具有同质性,选择固定效应模型计算合并数据;当P<0.10、I2>50%,可认为多个研究间存在异质性,采用随机效应模型计算合并数据。采用漏斗图评估纳入文献的发表偏倚。以P<0.05为差异有统计学意义。
2 结果 2.1 文献筛选流程通过检索PubMed、中国知网、维普中文科技期刊数据库、万方数据库和中国生物医学文献数据库初步筛选文献705篇,阅读标题和摘要进行初筛,排除无关文献486篇,符合基本入选条件文献219篇。阅读全文排除:无对照组52篇,非免疫组织化学法104篇,重复收录或资料雷同33篇,无法获取阴性数据10篇,质量评价<3分9篇。最终共有11篇文献纳入Meta分析,均为中文文献,累计病例993例,9篇文献提供了IGF-1阳性表达率与胃癌分化程度关联性的研究结果,7篇文献提供了IGF-1表达率与肿瘤浸润深度关联性的研究结果,10篇文献提供了IGF-1阳性表达率与淋巴结转移关联性的研究结果,8篇文献提供了IGF-1阳性表达率与TNM分期关联性的研究结果。
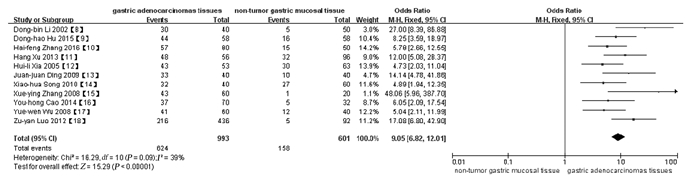
2.2 Meta分析 2.2.1 胃癌组织和非肿瘤胃黏膜组织中IGF-1阳性表达率纳入文献[8-18]中研究对象的基本特征见表 1。993例胃癌组织标本中IGF-1阳性表达624例,而非肿瘤胃黏膜组织对照组601例中IGF-1阳性表达158例。经异质性检验,P=0.09, I2=39%,采用固定效应模型。Meta分析结果显示:胃癌组织中IGF-1阳性表达率明显高于非肿瘤胃黏膜组织(OR=9.05,95%CI:6.82~12.01,P<0.01)。见图 1。
| Author | Year | Positive expression of IGF-1(η/%) | Clinicopathological parameter | Quality score |
| LI, et al.[8] | 2002 | 75.00 | Tissue differentiation, depth of invasion, lymphatic metastasis, TNM stage | 5 |
| HU, et al.[9] | 2015 | 75.86 | Tissue differentiation, lymphatic metastasis, TNM stage | 4 |
| ZHANG, et al.[10] | 2016 | 71.25 | Tissue differentiation, lymphatic metastasis, TNM stage | 4 |
| XU,et al.[11] | 2013 | 85.71 | Lymphatic metastasis, TNM stage | 4 |
| XIA, et al.[12] | 2005 | 81.13 | Tissue differentiation, depth of invasion, lymphatic metastasis, TNM stage | 5 |
| DING, et al.[13] | 2009 | 82.50 | Tissue differentiation, depth of invasion, lymphatic metastasis, TNM stage | 5 |
| SONG, et al.[14] | 2010 | 80.00 | Lymphatic metastasis | 3 |
| ZHANG, et al.[15] | 2008 | 71.67 | Tissue differentiation, depth of invasion, lymphatic metastasis, TNM stage | 4 |
| CAO, et al.[16] | 2014 | 52.86 | Tissue differentiation, depth of invasion, lymphatic metastasis, TNM stage | 4 |
| WU, et al.[17] | 2008 | 68.33 | Tissue differentiation, depth of invasion | 4 |
| LUO, et al.[18] | 2012 | 49.54 | Tissue differentiation, depth of invasion, lymphatic metastasis | 4 |
|
| 图 1 胃癌组织和非肿瘤胃黏膜组织中IGF-1阳性表达率的Meta分析森林图 Fig. 1 Forest plot of Meta-analysis of positive expression rates of in IGF-1 gastric cancer tissue and non-tumor gastric mucosal tissue |
|
|
共纳入9篇文献[8-10, 12-13, 15-18],其中中和高分化组359例,低分化组529例。各研究间无异质性(P=0.06,I2=46%),故采用固定效应模型进行Meta分析,结果显示:低分化组胃癌组织中IGF-1阳性表达率高于中和高分化组(OR=1.53,95%CI:1.14~2.06,P=0.004)。
2.2.3 不同浸润深度胃癌组织中IGF-1阳性表达率共纳入7篇文献[8, 12-13, 15-18],其中未累及组织全层组605例,累及全层组157例。各研究间无异质性(P=0.88,I2=0%),采用固定效应模型进行Meta分析,结果显示:累及全层组胃癌组织中IGF-1阳性表达率高于未累及全层组(OR=0.16,95%CI:0.09~0.28,P<0.01)。
2.2.4 有无淋巴结转移胃癌组织中IGF-1阳性表达率共纳入10篇文献[8-16, 18],其中无淋巴结转移组343例,有淋巴结转移组520例。各研究间无异质性(P=0.95,I2=0%),采用固定效应模型进行Meta分析,结果显示:有淋巴结转移组胃癌组织中IGF-1阳性表达率高于无淋巴结转移组(OR=0.10,95%CI:0.07~0.15,P<0.01)。
2.2.5 不同TNM分期胃癌组织中IGF-1阳性表达率共纳入8篇文献[8-13, 15-16],其中TNMⅠ-Ⅱ期组202例,TNMⅢ-Ⅳ期组255例。各研究间无异质性(P=0.71,I2=0%),采用固定效应模型进行Meta分析,结果显示:TNM Ⅲ-Ⅳ期组胃癌组织中IGF-1阳性表达率高于TNMⅠ-Ⅱ期组(OR=0.21,95%CI:0.13~0.33,P<0.01)。
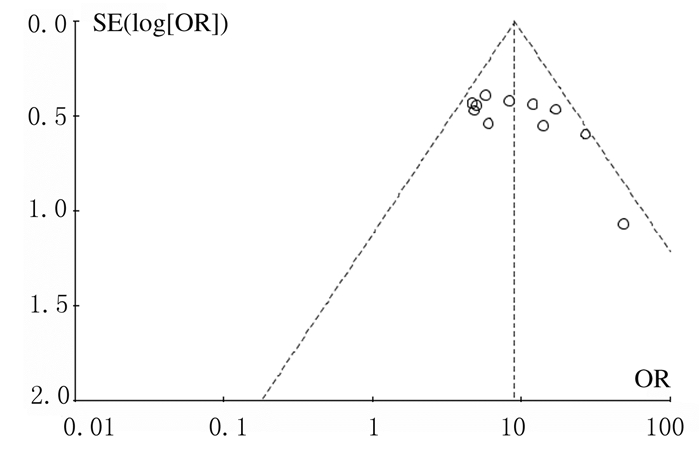
2.3 纳入研究的偏倚评估IGF-1在胃癌组织和非肿瘤胃黏膜组织中阳性表达率的Meta分析漏斗图显示:以研究的OR值作为横坐标,用其自然对数的标准误作为纵坐标,绘制漏斗图,大部分的散点在漏斗的中轴附近或较对称地分布在中轴两边,表明本研究受发表偏倚的影响较小,研究结论较为可靠。见图 2。
|
| 图 2 胃癌组织和非肿瘤胃黏膜组织中IGF-1阳性表达率的Meta分析漏斗图 Fig. 2 Funnel plot of Meta-analysis on positive expression rates of IGF-1 in gastric cancer tissue and non-tumor gastric mucosal tissue |
|
|
IGF-1是一种活性蛋白多肽物质, 由IGF-1基因编码生成,因与胰岛素的结构相似而被命名,也是一种生长激素产生生理作用过程中所必需的介质,故又称生长激素介质。机体多种组织器官可以合成分泌IGF-1, 但最主要是肝脏和骨髓。IGF-1是由70个氨基酸组成的多肽链,具有内分泌、自分泌和旁分泌等特性。IGF-1通过磷脂酰肌醇3激酶(PI3K)/蛋白激酶B途径和丝裂原激活蛋白激酶途径促进细胞增殖、分化和血管形成,促进细胞生长,抑制细胞凋亡[19],在肿瘤的发生发展过程中发挥重要作用[20]。胃癌的发生和进展与多种因素的调控有关,其确切机制尚未完全阐明。目前, 随着分子生物学在临床领域中应用的不断深化, IGF-1及其受体与多种肿瘤的关系成为研究热点。国内外研究[21-25]显示:胃癌、非小细胞肺癌、乳腺癌、结直肠癌、子宫内膜癌和卵巢癌等多种恶性肿瘤中IGF-1高表达,并发现其与恶性肿瘤细胞的增殖和转移有关。
本研究采用Meta分析的方法,综合分析了IGF-1在胃癌组织和非肿瘤胃黏膜组织间的表达差异,进一步表明胃癌组织中IGF-1高表达,IGF-1阳性表达率的上调可能与胃癌的发生、发展有关。本研究结果与WANG等[26]的研究结果一致。本研究分析IGF-1阳性表达率与胃癌的组织学分化程度、浸润深度、淋巴结转移和TNM分期之间的关系结果显示:低分化较中高分化、累及全层较未累及全层、有淋巴结转移较无淋巴结转移以及TNM Ⅲ-Ⅳ期较TNMⅠ-Ⅱ期的胃癌组织中IGF-1表达阳性率更高。与XU等[27]、ZHANG等[28]和SU等[4]的研究结果相符合,故可认为IGF-1是导致胃癌患者预后不良的独立因素。本次Meta分析对近年来包含IGF-1表达与胃癌关联性研究内容的多个医学研究进行综合评价,较单个医学研究病例数量多,样本含量大,提高了检验效能,使结论具有更高的准确性及可信度。但本次Meta分析也有一定的局限性:①涉及单因素研究,未考虑IGF-1与其他因素的交互作用,其他混杂因素的影响也难以避免;②由于临床病理特征、数据分析、研究人员技术和检测的敏感性等原因,各个研究之间存在不可消除的异质性;③所纳入的文献数量少,且按照纳入与排除标准,质量评分≥3分的文献多为2016年以前发表文献,缺少符合条件的近2年文献,可能会影响最终结果;④虽然漏斗图结果未发现明显偏倚,但是阳性结果的研究较阴性结果的研究更容易发表,且未进行P值计算,对结果有影响。所以有必要对IGF-1表达与胃癌的关系进行更深入的研究,以期得到更科学可靠的结论。
综上所述,鉴定在胃癌病因和侵袭中发挥明确功能的生物标志物是改善胃癌结局的关键。本研究结果提示:IGF-1在胃癌中高表达可增加肿瘤恶性生物学行为的发生,因此IGF-1可作为胃癌早期诊断、临床治疗的肿瘤标志物。本研究结果为深入研究多种干扰IGF-1表达的技术产品提供了新思路和新靶点。
| [1] | KARIMI P, ISLAMI F, ANANDASABAPATHY S, et al. Gastric cancer:descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5): 700–713. DOI:10.1158/1055-9965.EPI-13-1057 |
| [2] | ALBEROBELLO A T, D'ESPOSITO V, MARASCO D, et al. Selective disruption of insulin-like growth factor-1(IGF-1) signaling via phosphoinositide-dependent kinase-1 prevents the protective effect of IGF-1 on human cancer cell death[J]. J Biol Chem, 2010, 285(9): 6563–6572. DOI:10.1074/jbc.M109.097410 |
| [3] | SCARTOZZI M, MANDOLESI A, GIAMPIERI R, et al. Insulin-like growth factor 1 expression correlates with clinical outcome in K-RAS wild type colorectal cancer patients treated with cetuximab and irinotecan[J]. Int J Cancer, 2010, 127(8): 1941–1947. DOI:10.1002/ijc.25193 |
| [4] | SU C, WANG W, WANG C. IGF-1-induced MMP-11 expression promotes the proliferation and invasion of gastric cancer cells through the JAK1/STAT3 signaling pathway[J]. Oncol Lett, 2018, 15(5): 7000–7006. |
| [5] | GANGULY S, BASU B, SHOME S, et al. Dopamine, by acting through its D2 receptor, inhibits insulin-like growth factor-I (IGF-I)-induced gastric cancer cell proliferation via up-regulation of Kruppel-like factor 4 through down-regulation of IGF-IR and AKT phosphorylation[J]. Am J Pathol, 2010, 177(6): 2701–2707. DOI:10.2353/ajpath.2010.100617 |
| [6] | ZHAO Q, TRAN H, DIMITROV D S, et al. A dual-specific anti-IGF-1/IGF-2 human monoclonal antibody alone and in combination with temsirolimus for therapy of neuroblastoma[J]. Int J Cancer, 2015, 137(9): 2243–2252. DOI:10.1002/ijc.29588 |
| [7] | LICHTENSTEIN M J, MULROW C D, ELWOOD P C. Guidelines for reading case-control studies[J]. J Chronic Dis, 1987, 40(9): 893–903. DOI:10.1016/0021-9681(87)90190-1 |
| [8] | 李冬斌, 韩锦胜, 王英霞, 等. 胃癌中IGF-Ⅰ、Ⅱ及IGF-ⅠR的表达与临床病理关系的研究[J]. 河北医药, 2013, 35(8): 1125–1128. |
| [9] | 胡东昊. 胰岛素样生长因子-1及其结合蛋白-3在胃癌诊断中的应用[J]. 中国慢性病预防与控制, 2015, 23(3): 211–213. |
| [10] | 张海峰, 申兴斌, 刘莎莎, 等. IGF-1及IGF-1R在胃癌中的表达及意义[J]. 中国微生态学杂志, 2016, 28(12): 1440–1442. |
| [11] | 徐航. Klotho和IGF-1在胃癌中的表达及意义[D].长沙: 中南大学, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=y2423545 |
| [12] | 夏惠丽. IGF-1与bcl-2在胃癌组织中的表达及其相关性[D].郑州: 郑州大学, 2005. http://cdmd.cnki.com.cn/article/cdmd-10459-2006144125.htm |
| [13] | 丁娟娟, 王邦茂, 方维丽, 等. 胰岛素样生长因子-Ⅰ及其受体在胃癌的表达和意义[J]. 胃肠病学和肝病学杂志, 2009, 18(2): 103–105. DOI:10.3969/j.issn.1006-5709.2009.02.004 |
| [14] | 宋晓华. IGF-Ⅰ、IGF-Ⅱ在胃癌中的表达及临床意义[J]. 河北医学, 2010, 16(6): 654–657. DOI:10.3969/j.issn.1007-3205.2010.06-014 |
| [15] | 张雪英, 吉兆宁. 胃癌中IGFBP-2、IGFI、IGFIR的表达及意义[J]. 皖南医学院学报, 2008, 27(2): 98–101. DOI:10.3969/j.issn.1002-0217.2008.02.006 |
| [16] | 曹友红, 许春芳, 马平, 等. 胰岛素样生长因子-1及其受体在胃癌中的表达及临床意义[J]. 世界华人消化杂志, 2014, 22(22): 3307–3315. |
| [17] | 吴跃文, 何杨, 吉兆宁, 等. 胃癌中胰岛素样生长因子结合蛋白-2, 胰岛素样生长因子-1和增殖细胞核抗原的表达和临床意义[J]. 中国临床医学, 2008, 15(1): 70–72. |
| [18] | 罗祖炎, 李博, 徐文娟, 等. IGF-1在胃癌组织中的表达及其与浸润转移的关系[J]. 肿瘤学杂志, 2012, 18(4): 254–258. |
| [19] | DANG X, LI X, WANG L, et al. MicroRNA-3941 targets IGF-1 to regulate cell proliferation and migration of breast cancer cells[J]. Int J Clin Exp Pathol, 2017, 10(7): 7650–7660. |
| [20] | HADDADI N, LIN Y, TRAVIS G, et al. PTEN/PTENP1:'Regulating the regulator of RTK-dependent PI3K/Akt signalling', new targets for cancer therapy[J]. Mol Cancer, 2018, 17(1): 37. DOI:10.1186/s12943-018-0803-3 |
| [21] | 张海峰, 赵杨, 刘莎莎, 等. IGF-1、IGF-1R及VEGF在胃癌中的表达及其与浸润转移的关系[J]. 标记免疫分析与临床, 2018, 25(3): 360–364. |
| [22] | 刘勇进, 俞列群, 叶帆. 非小细胞肺癌组织中HIF-1α、EGFR、IGF-1的表达及临床意义[J]. 医学研究杂志, 2018, 47(5): 78–82. |
| [23] | JU J, HAN C, ZAN L, et al. Expression of insulin-like growth factor 1 and its receptors in colorectal cancer and their significances[J]. Int J Clin Exp Pathol, 2017, 29(9): 593–597. |
| [24] | 徐红, 郭明华, 吕旻彦, 等. IGF-1及IGFBP-3在子宫内膜癌组织中的表达及意义[J]. 实用妇产科杂志, 2011, 27(12): 901–904. DOI:10.3969/j.issn.1003-6946.2011.12.010 |
| [25] | TANG J, JUN-JUN L I, ZHANG Y, et al. Expression and clinical significance of IGF-1 and IGF-1R in epithelial ovarian cancer patients[J]. China J Modern Med, 2014, 24(27): 54–58. |
| [26] | WANG H, WANG C, TIAN W, et al. The crucial role of SRPK1 in IGF-1-induced EMT of human gastric cancer[J]. Oncotarget, 2017, 8(42): 72157–72166. |
| [27] | XU L, ZHOU R, YUAN L, et al. IGF1/IGF1R/STAT3 signaling-inducible IFITM2 promotes gastric cancer growth and metastasis[J]. Cancer Lett, 2017, 393: 76–85. DOI:10.1016/j.canlet.2017.02.014 |
| [28] | ZHANG H F, SHEN X B, LIU S S, et al. Effects of IGF-1 down-regulation on proliferation, migration and invasion of human gastric cancer cells[J]. Chin J Cancer Prevent Treatment, 2017, 24(1): 16–22. |
 2019, Vol. 45
2019, Vol. 45


