扩展功能
文章信息
- 王艳丽, 黄鸣宇, 张鹏
- WANG Yanli, HUANG Mingyu, ZHANG Peng
- 阿托伐他汀对HepG2细胞中脂代谢相关基因表达的影响
- Effects of atorvastatin on expression of lipid metabolism-related genes in HepG2 cells
- 吉林大学学报(医学版), 2019, 45(01): 77-82
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 77-82
- 10.13481/j.1671-587x.20190115
-
文章历史
- 收稿日期: 2018-04-15
动脉粥样硬化(atherosclerosis, AS)是心血管系统疾病的主要病理学基础。AS的发生与脂质代谢紊乱、高血压、糖尿病和胰岛素抵抗等多种因素有关[1-2],其中脂代谢紊乱是AS的主要致病因素。流行病学资料[3-4]显示:高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)与AS的发生呈负相关关系,因此升高HDL-C抗AS的策略亦是研究者致力探索的目标。目前研究[5]表明:HDL-C颗粒组成比HDL-C水平更重要。HDL-C颗粒包含磷脂、胆固醇、载脂蛋白A1(apolipoprotein A1, apoA1)、apoA2、apoC和apoE等成分,其中apoA1约占70%,为HDL-C颗粒的主要成分[6-7]。apoA1在胆固醇逆转运(reverse cholesterol transport, RCT)过程中发挥重要作用。经典的RCT过程:外周组织游离胆固醇经ATP结合盒式转运体A1(ATP binding cassette transporter A1, ABCA1)及ATP结合盒式转运体G1(ATP binding cassette transporter G1, ABCG1)受体流出,与apoA1结合,apoA1可激活卵磷脂胆固醇酰基转移酶(lecithincholesterol acyltransferase, LCAT),并在LCAT催化下形成前β高密度脂蛋白(pre β-HDL),再经LCAT进一步酯化形成成熟的HDL-C,最后经肝脏表面的清道夫受体B1(scavenger receptor-class B type 1, SRB1)摄取代谢。因此,apoA1在HDL-C形成及RCT过程中发挥重要作用[8]。
近年来,随着分子生物学技术的发展,长链非编码RNA (long non-coding RNAs, lncRNAs)在心血管系统疾病研究中越来越受到关注[9]。目前研究[10]显示:存在一段lncRNA为apoA1的天然反义转录(apoA1 natural antisense transcripts,apoA1-NAT),可与apoA1基因结合而抑制其转录。然而apoA1-NAT在AS发生发展中的作用目前尚不清楚。
阿托伐他汀(atorvastatin)是目前应用最广泛的降血脂保护心血管药物,可降低血浆低密度脂蛋白(low density lipoprotein, LDL)及甘油三酯水平,还可刺激肝脏表面LDL受体(LDL receptor, LDLR),使其数目增多和活性增强[11]。本研究利用阿托伐他汀干预HepG2细胞,观察其是否能抑制apoA1-NAT表达,进而升高apoA1,促进脂代谢相关基因表达,为探索抗AS新的治疗靶点提供理论依据。
1 材料与方法 1.1 主要试剂阿托伐他汀购自美国Sigma公司,胎牛血清购自美国Gibco公司,RPMI-1640和双抗购于美国康宁公司,RNA提取试剂盒购于天根生化科技(北京)有限公司,反转录及荧光定量试剂盒购于大连宝生物TaKaRa公司。
1.2 HepG2细胞培养取西安医学院基础医学研究所中心实验室液氮冻存的HepG2细胞,于37℃水浴快速溶化,将冻存管中的液体转移至已加入10mL培养液的离心管中离心,弃上清液,加入1mL培养液,吹打细胞使之成为单细胞悬液,将离心管中的细胞转移至25cm2培养瓶中于37℃、5%CO2的培养箱中培养。待细胞密度至90%时传代培养。传代细胞密度至90%时,选取1瓶细胞进行冻存,未冻存细胞继续传至3~5代时用于实验。
1.3 细胞计数将计数板和盖玻片擦拭干净,并将盖玻片盖在计数板上。将细胞悬液吸出少许,滴加在盖玻片和计数板之间,静置3min,用计数板记录计数板四个大格细胞总数。当细胞数达到1×106 mL-1时用于实验。
1.4 引物设计登录NCBI网站,检索各基因登录号及基因序列。apoA1-NAT,登录号为NR_126362;ApoA1 mRNA,登录号为NM_001318021;SRB1 mRNA,登录号为BC112037;ABCA1 mRNA,登录号为AB055982;LDLR mRNA,登录号为AY114155;内参GAPDH mRNA,登录号为DQ403057。根据检索到的上述基因序列,采用Primer 5.0设计引物(表 1),引物由上海捷瑞生物工程有限公司合成,用于下一步分子生物学实验。
| Gene name | Primer sequence | Product size(bp) |
| ApoA1-NAT | F 5′- TCCATCTCCTCCTGCCACTTCTTCT-3′ | 107 |
| R 5′-CGTAGGTTTCCAGCAATAAGTAGCC-3′ | ||
| ApoA1 | F 5′-CCAGGACCAGTGAGCAGCAACAG-3′ | 176 |
| R 5′-GAAGAGCACGGCCAAGGTCAGCA-3′ | ||
| SRB1 | F 5′-GCGGCGGTGATGATGGAGAATAA-3′ | 228 |
| R 5′-GAAGAGCCCAGAGTCGGACTTGT-3′ | ||
| ABCA1 | F 5′-AGTCCTCTTTCCCGCATTATCTG-3′ | 212 |
| R 5′-AGGTCCATTTCTTGGCTGTTCTC-3′ | ||
| LDLR | F 5′-ACCTGGAGGGTGGCTACAAGTGC-3′ | 131 |
| R 5'-CGTACTCTTCCTGACCTCGTGCC-3′ | ||
| GAPDH | F 5′-ACAACAGCCTCAAGATCATCAGCA-3′ | 104 |
| R 5′-CATGAGTCCTTCCACGATACCAAA-3′ |
取处于对数生长期的HepG2细胞用0.25%的胰酶消化使之脱壁。收集细胞团, 加入RPMI-1640重悬HepG2细胞。在6孔板中加入2 mL单细胞悬液,摇匀,培养箱中过夜培养。用DMSO溶解阿托伐他汀,配制含不同浓度阿托伐他汀的培养液,使加入6孔板中阿托伐他汀的终浓度分别为0、1、10和100 nmol·L-1,以0nmol·L-1阿托伐他汀组为对照组,吸弃6孔板孔中的RPMI-1640,加入溶解了阿托伐他汀的培养液2 mL继续培养6、12、24和48h。
1.6 RNA提取、逆转录及Real-time PCR法检测取上述各组HepG2细胞,用天根试剂盒(DP430)提取总RNA。得到的总RNA在核酸蛋白检测仪上测其浓度,测定260及280nm处吸光度(A)值,A(260)/A(280)为1.8~2.0,取1.0 μg总RNA逆转录合成cDNA。逆转录流程按照试剂盒说明书进行。按荧光定量试剂盒说明配制Real-time PCR反应体系20 μL,检测HepG2细胞中apoA1-NAT及脂代谢相关基因表达水平。反应条件:95℃预变性3 min;95℃变性10 s,54℃退火40 s,两步法变性和退火重复进行39次;72℃延伸10 min。反应结束后进行扩增曲线和熔解曲线分析,并采用2-△△Ct法计算目的基因的mRNA表达水平。
1.7 统计学分析采用SPSS 18.0统计软件进行统计学分析。各组HepG2细胞中apoA1-NAT、apoA1、LDLR、SRB1和ABCA1mRNA表达水平以x±s表示,多组间样本均数比较采用单因素方差分析(One-Way ANOVA)和Tukey’s检验。以P<0.05表示差异有统计学意义。
2 结果 2.1 不同浓度阿托伐他汀处理24h后HepG2细胞形态表现采用不同浓度阿托伐他汀孵育HepG2细胞24h,当药物浓度增加到100nmol·L-1时,细胞形态逐渐变为圆形,并逐渐开始脱壁。而在阿托伐他汀浓度为1和10nmol·L-1时细胞形态正常,因此本研究重点观察1和10nmol·L-1阿托伐他汀干预HepG2细胞24h的结果。见图 1(插页三)。
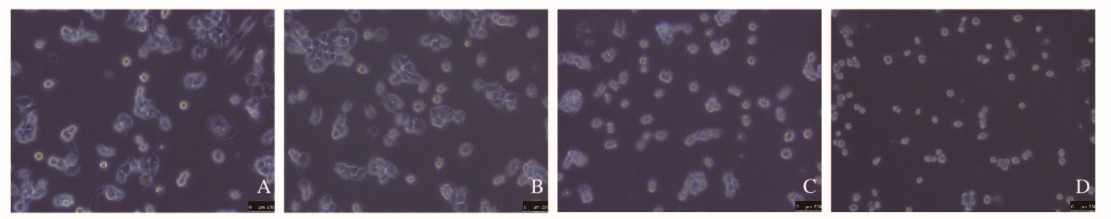
|
| A:Control group; B-D: 1,10, and 100 nmol·L-1 atorvastatin groups. 图 1 处理24 h后各组HepG2细胞形态表现(Bar=250 μm) Fig. 1 Morphology of HepG2 cells after treated for 24 h in various groups (Bar=250 μm) |
|
|
与对照组比较,作用12 h时1和10nmol·L-1阿托伐他汀组HepG2细胞中apoA1-NAT表达水平明显降低(P < 0.01), apoA1 mRNA表达水平明显升高(P < 0.05或P < 0.01),而100 nmol·L-1阿托伐他汀组HepG2细胞中apoA1-NAT和apoA1mRNA表达水平无明显变化(P>0.05);与1和10nmol·L-1阿托伐他汀组比较,100 nmol·L-1阿托伐他汀组HepG2细胞中apoA1-NAT和apoA1mRNA表达水平差异有统计学意义(P < 0.05或P < 0.01)。见表 2。
| (n=4, x±s) | ||
| Group | ApoA1-NAT | ApoA1 mRNA |
| Control | 1.00±0.00 | 1.00±0.00 |
| Atorvastatin(nmol·L-1) | ||
| 1 | 0.29±0.19** | 1.27±0.12* |
| 10 | 0.18±0.08** | 1.39±0.13** |
| 100 | 0.74±0.12△# | 0.85±0.07△# |
| *P < 0.05, **P < 0.01compared with controlgroup; △P < 0.05 compared with 1nmol·L-1 atorvastatin group; #P < 0.01 compared with 10nmol·L-1 atorvastatin group. | ||
与6 h比较,12、24和48h时10nmol·L-1阿托伐他汀组HepG2细胞中apoA1-NAT表达水平明显降低(P < 0.01),且呈明显的时间依赖性;随着时间的延长,HepG2细胞中apoA1 mRNA表达水平逐渐升高,与6、12和24h时比较,48 h时HepG2细胞中apoA1 mRNA表达水平明显升高(P < 0.01)。见表 3。
| (n=4, x±s) | ||
| Time | ApoA1-NAT | ApoA1 mRNA |
| 6 h | 1.00±0.00 | 1.00±0.00 |
| 12 h | 0.61±0.16* | 1.01±0.24 |
| 24 h | 0.21±0.14*△ | 1.25±0.15 |
| 48 h | 0.08±0.04*△ | 2.24±0.27*△# |
| *P < 0.01compared with 6 h; △P < 0.01 compared with 12 h; # P < 0.01 compared with 24 h. | ||
阿托伐他汀作用24 h,HepG2细胞中LDLR mRNA表达水平呈浓度依赖性升高,与对照组和1及10nmol·L-1阿托伐他汀组比较,100nmol·L-1阿托伐他汀组HepG2细胞中LDLR mRNA表达水平明显升高(P < 0.01)。与6 h比较,10nmol·L-1阿托伐他汀作用12 h时HepG2细胞中LDLR mRNA表达水平无明显变化(P>0.05);与6和12 h比较,作用24和48 h时HepG2细胞中LDLR mRNA表达水平明显升高(P < 0.01)。见表 4和5。
| (n=4, x±s) | |
| Group | LDLR mRNA |
| Control | 1.00±0.00 |
| Atorvatatin(nmol·L-1) | |
| 1 | 1.39±0.13 |
| 10 | 2.23±0.30 |
| 100 | 12.09±1.78*△# |
| *P < 0.01 compared with control group; △P < 0.01 compared with 1nmol·L-1 atorvastatin group; #P < 0.01 compared with 10nmol·L-1 atorvastatin group. | |
| (n=4, x±s) | |
| Time | LDLR mRNA |
| 6 h | 1.00±0.00 |
| 12 h | 0.83±0.09 |
| 24 h | 3.15±0.38*△ |
| 48 h | 3.29±0.31*△ |
| *P < 0.01 compared with 6 h; △P < 0.01 compared with 12 h. | |
与对照组和1nmol·L-1阿托伐他汀组比较,10nmol·L-1阿托伐他汀组SRB1 mRNA表达水平明显升高(P < 0.01);与1和10nmol·L-1阿托伐他汀组比较,100nmol·L-1阿托伐他汀组SRB1 mRNA表达水平明显降低(P < 0.05或P < 0.01)。与6和12 h比较,1nmol·L-1阿托伐他汀作用24和48h时HepG2细胞中SRB1表达水平明显升高(P < 0.01);与24h比较,48h时HepG2细胞中SRB1表达水平进一步升高(P < 0.01)。见表 6和7。
| (n=4, x±s) | |
| Group | SRB1 mRNA |
| Control | 1.00±0.00 |
| Atorvastatin(nmol·L-1) | |
| 1 | 1.23±0.12 |
| 10 | 1.72±0.20*△ |
| 100 | 0.61±0.30△# |
| *P < 0.01 compared with control group; △P < 0.05 compared with 1nmol·L-1 atorvastatin group; #P < 0.01 compared with 10nmol·L-1 atorvastatin group. | |
| (n=4, x±s) | |
| Time | SRB1 mRNA |
| 6 h | 1.00±0.00 |
| 12 h | 0.81±0.19 |
| 24 h | 1.50±0.11*△ |
| 48 h | 2.54±0.21*△# |
| *P < 0.01 compared with 6 h; △P < 0.01 compared with 12 h; #P < 0.01 compared with 24 h. | |
与对照组比较,1和10nmol·L-1阿托伐他汀组HepG2细胞中ABCA1 mRNA表达水平明显升高(P < 0.01);与1和10nmol·L-1阿托伐他汀组比较,100nmol·L-1阿托伐他汀组HepG2细胞中ABCA1 mRNA表达水平明显降低(P < 0.01)。1nmol·L-1阿托伐他汀作用6~48 h,ABCA1mRNA表达水平呈时间依赖性升高(P < 0.05或P < 0.01);与6 h比较,1nmol·L-1阿托伐他汀作用12、24和48 h时HepG2细胞中ABCA1 mRNA表达水平明显升高(P < 0.05或P < 0.01);与12和24 h比较,作用48 h时HepG2细胞中ABCA1 mRNA表达水平进一步升高(P < 0.05)。见表 8和9。
| (n=4, x±s) | |
| Group | ABCA1 mRNA |
| Control | 1.00±0.00 |
| Atorvastatin(nmol·L-1) | |
| 1 | 1.46±0.19* |
| 10 | 1.51±0.19* |
| 100 | 0.73±0.2△# |
| *P < 0.01 compared with controlgroup; △P < 0.01 compared with 1nmol·L-1 atorvastatin group; #P < 0.01 compared with 10nmol·L-1 atorvastatin group. | |
| (n=4, x±s) | |
| Time | ABCA1 mRNA |
| 6 h | 1.00±0.00 |
| 12 h | 1.53±0.09* |
| 24 h | 1.66±0.16** |
| 48 h | 2.03±0.29**△# |
| *P < 0.05,**P < 0.01compared with 6 h; △P < 0.05 compared with 12 h; #P < 0.05 compared with 24 h. | |
apoA1在HDL-C形成和RCT过程中发挥重要作用。人apoA1基因位于染色体11q23,包含4个外显子,3个内含子,80%在肝脏表达,其次为小肠。成熟的apoA1多肽由243个氨基酸组成,相对分子质量约为28000。ApoA1在促进胆固醇外流及抗AS中的作用已在多项实验中得到了验证。RUBIN等[12]发现:给予小鼠过表达人apoA1基因,可抑制早期AS。ZHANG等[13]发现:给予小鼠过表达apoA1基因可促进胆固醇从巨噬细胞向肝脏逆转运,并通过肝脏代谢排出。DUVERGER等[14]给予家兔转入人apoA1基因,同样发现其血浆HDL-C水平升高,减轻AS。近年来研究[10]显示: apoA1-NAT可与apoA1基因结合而抑制其转录。NAT是从蛋白编码基因的反义链转录而来,能与编码基因配对,至少在一个外显子区有基因重叠,可上调或下调蛋白编码基因表达[15]。超过70%的哺乳动物存在该种反义转录[16],可调节编码基因表达,不仅表明NATs在生物体内的重要性,也预示着其存在多方面的治疗意义[17-18]。本研究选用目前应用最广泛的降血脂药物阿托伐他汀干预HepG2细胞,结果显示:阿托伐他汀可以调节HepG2细胞中apoA1-NAT表达,使其受到明显抑制的同时apoA1表达水平明显升高,并且apoA1-NAT和apoA1mRNA表达水平的变化与时间同步对应。然而,阿托伐他汀抑制apoA1-NAT表达的机制仍需进一步研究。
本研究还显示:阿托伐他汀可影响RCT过程相关基因表达,促进胆固醇代谢。在RCT过程中,ABCA1是游离胆固醇外流的主要通道。在本研究中,ABCA1表达水平在小浓度阿托伐他汀作用6h即可升高,有利于加快外周组织游离胆固醇外流,外流的游离胆固醇可与apoA1结合;而在1和10 nmol·L-1阿托伐他汀作用12h时HepG2细胞中apoA1mRNA表达水平明显升高,同时apoA1-NAT表达受到了明显的抑制而下降,说明apoA1-NAT被抑制后apoA1 mRNA表达水平可升高。RCT过程中形成的HDL要通过肝脏表面的SRB1选择性摄取代谢其中的胆固醇酯。本研究结果显示:10 nmol·L-1阿托伐他汀作用6h时,即可观察到HepG2细胞中SRB1表达水平明显升高;1nmol·L-1阿托伐他汀作用24和48h,可观察到HepG2细胞中SRB1表达水平明显升高。HDL-C在胆固醇酯转移蛋白(cholesteryl ester transfer protein, CETP)作用下与LDL发生脂质交换[19-20],形成的LDL可经过细胞表面的LDLR摄取代谢。本研究结果显示:100nmol·L-1阿托伐他汀作用24h后HepG2细胞中LDLR表达水平明显升高,可增加对LDL的摄取。
本研究结果表明:阿托伐他汀可以影响RCT过程相关基因表达,促进胆固醇代谢,尤其是阿托伐他汀在抑制HepG2细胞中apoA1-NAT表达的同时apoA1mRNA表达水平升高。本研究结果为进一步研究抗AS新的治疗靶点提供了实验依据。
| [1] | KAPURIA D, TAKYAR V K, ETZION O, et al. Association of hepatic steatosis with subclinical atherosclerosis:systematic review and Meta-analysis[J]. Hepatol Commun, 2018, 2(8): 873–883. DOI:10.1002/hep4.1097 |
| [2] | GAO S, ZHAO D, WANG M, et al. Association between circulating oxidized LDL and atherosclerotic cardiovascular disease:A Meta-analysis of observational studies[J]. Can J Cardiol, 2017, 33(12): 1624–1632. DOI:10.1016/j.cjca.2017.07.015 |
| [3] | FADAEI R, POUSTCHI H, MESHKANI R, et al. Impaired HDL cholesterol efflux capacity in patients with non-alcoholic fatty liver disease is associated with subclinical atherosclerosis[J]. Sci Rep, 2018, 8(1): 11691. DOI:10.1038/s41598-018-29639-5 |
| [4] | KYPREOS K E, GKIZAS S, RALLIDIS L S, et al. HDL particle functionality as a primary pharmacological target for HDL-based therapies[J]. Biochem Pharmacol, 2013, 85(11): 1575–1578. DOI:10.1016/j.bcp.2013.03.004 |
| [5] | MORA S, GLYNN R J, RIDKER P M. High-density lipoprotein cholesterol, size, particle number, and residual vascular risk after potent statin therapy[J]. Circulation, 2013, 128(11): 1189–1197. DOI:10.1161/CIRCULATIONAHA.113.002671 |
| [6] | WANGY, NIIMIM, NISHIJIMAK, et al. Human Apolipoprotein A-Ⅱ protects against diet-Induced atherosclerosis in transgenic rabbits[J]. Arterioscler Thromb Vasc Biol, 2013, 33(2): 224–231. DOI:10.1161/ATVBAHA.112.300445 |
| [7] | ROSENSON R S, BREWER HB, DAVIDSON W S, et al. Cholesterol efflux and atheroprotection:advancing the concept of reverse cholesterol transport[J]. Circulation, 2012, 125(15): 1905–1919. DOI:10.1161/CIRCULATIONAHA.111.066589 |
| [8] | COOKE A L, MORRIS J, MELCHIOR J T, et al. A thumbwheel mechanism for APOA1 activation of LCAT activity in HDL[J]. J Lipid Res, 2018, 59(7): 1244–1255. DOI:10.1194/jlr.M085332 |
| [9] | UCHIDA S, DIMMELER S. Long noncoding RNAs in cardiovascular diseases[J]. Circ Res, 2015, 116(4): 737–750. DOI:10.1161/CIRCRESAHA.116.302521 |
| [10] | HALLEY P, KADAKKUZHA B M, FAGHIHI M A, et al. Regulation of the apolipoprotein gene cluster by a long noncoding RNA[J]. Cell Rep, 2014, 6(1): 222–230. DOI:10.1016/j.celrep.2013.12.015 |
| [11] | COVEY S D, KRIEGER M, WANG W, et al. Scavenger receptor class B type Ⅰ-mediated protection against atherosclerosis in LDL receptor-negative mice involves its expression in bone marrow-derived cells[J]. Arterioscler Thromb Vasc Biol, 2003, 23(9): 1589–1594. DOI:10.1161/01.ATV.0000083343.19940.A0 |
| [12] | RUBIN E M, KRAUSS R M, SPANGLER E A, et al. Inhibition of early atherogenesis in transgenic mice by human apolipoprotein AI[J]. Nature, 1991, 353(6341): 265–267. DOI:10.1038/353265a0 |
| [13] | ZHANG Y, ZANOTTI I, REILLY M P, et al. Overexpression of apolipoprotein A-Ⅰ promotes reverse transport of cholesterol from macrophages to feces in vivo[J]. Circulation, 2003, 108(6): 661–663. DOI:10.1161/01.CIR.0000086981.09834.E0 |
| [14] | DUVERGER N, KRUTH H, EMMANUEL F, et al. Inhibition of atherosclerosis development in cholesterol-fed human apolipoprotein A-Ⅰ-transgenic rabbits[J]. Circulation, 1996, 94(4): 713–717. DOI:10.1161/01.CIR.94.4.713 |
| [15] | IKENAGA M, HIGAKI Y, SAKU K, et al. High-density lipoprotein mimetics:a therapeutic tool for atherosclerotic diseases[J]. J Atheroscler Thromb, 2016, 23(4): 385–394. DOI:10.5551/jat.33720 |
| [16] | FAGHIHI M A, WAHLESTEDT C. Regulatory roles of natural antisense transcripts[J]. Nat Rev Mol Cell Biol, 2009, 10(9): 637–643. DOI:10.1038/nrm2738 |
| [17] | WAHLESTEDT C. Natural antisense and noncoding RNA transcripts as potential drug targets[J]. Drug Discov Today, 2006, 11(11/12): 503–508. |
| [18] | LEHNER B, WILLIAMS G, CAMPBELL R D, et al. Antisense transcripts in the human genome[J]. Trends Genet, 2002, 18(2): 63–65. DOI:10.1016/S0168-9525(02)02598-2 |
| [19] | 张鹏, 王艳丽, 郭世文, 等. 家兔胆固醇酯转移蛋白基因克隆及其真核表达载体的构建[J]. 吉林大学学报:医学版, 2013, 39(4): 837–840. |
| [20] | SHRESTHA S, WU B J, GUINEY L, et al. Cholesteryl ester transfer protein and its inhibitors[J]. J Lipid Res, 2018, 59(5): 772–783. DOI:10.1194/jlr.R082735 |
 2019, Vol. 45
2019, Vol. 45


