扩展功能
文章信息
- 苗向霞, 郭蕊, 张璎, 卫银银, 罗正奇, 闵亚丽, 刘凯歌
- MIAO Xiangxia, GUO Rui, ZHANG Ying, WEI Yinyin, LUO Zhengqi, MIN Yali, LIU Kaige
- 白藜芦醇对肝癌HepG2细胞中脂肪合成的抑制作用及其机制
- Inhibitory effect of resveratrol on fat synthesis in liver cancer HepG2 cells and its mechanism
- 吉林大学学报(医学版), 2019, 45(01): 69-72
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 69-72
- 10.13481/j.1671-587x.20190113
-
文章历史
- 收稿日期: 2018-07-12
2. 宁夏医科大学研究生院, 宁夏 银川 750004;
3. 西安医学院第一附属医院消化内科, 陕西 西安 710077
2. Graduate School, Ningxia Medical University, Yinchuan 750004, China;
3. Department of Digestive Medicine, First Affiliated Hospital, Xi'an Medical College, Xi'an 710077, China
非酒精性脂肪肝病(non-alcoholic fatty liverdisease,NAFLD)是由于甘油三酯(triglyceride, TG)在肝细胞内大量聚集引起的慢性肝病,可发展成肝硬化或肝癌[1-2]。国内外研究[3-6]证明:在脂肪代谢中,氧链接N乙酰葡糖胺(O-GlcNAc glycosylation, O-GlcNAc)糖基化是一种蛋白质翻译后修饰,提高O-GlcNAc糖基化水平可以增加脂肪合成。白藜芦醇(resveratrol, Res)是一种非黄酮类多酚化合物,国内研究[7]表明:Res具有改善由软脂酸钠诱导的肝细胞脂肪变性的作用,但其是否通过影响O-GlcNAc糖基化水平进而抑制脂肪合成的分子机制鲜有报道。本研究采用肝癌HepG2细胞模型,探讨Res对肝细胞脂肪合成的影响及其机制。
1 材料与方法 1.1 细胞、主要试剂和仪器HepG2细胞由第四军医大学西京消化病医院肿瘤生物学国家重点实验室提供。胎牛血清(FBS)和0.25%胰酶Trypsin购自美国Gibco公司,二甲基亚砜(DMSO)和Res购自美国Sigma公司,硬脂酰辅酶A去饱和酶(SCD1)抗体购自美国Proteintech公司,乙酰辅酶A羧化酶1(ACC1)抗体、脂肪酸合成酶(FASN)抗体和O-GlcNAc抗体购自美国Abcam公司,RNA提取纯化试剂盒、逆转录试剂盒和RNA提取试剂盒购自日本TaKaRa公司,HRP-抗鼠IgG和HRP-抗兔IgG购自美国CST公司。电泳仪、垂直电泳槽、ECL化学发光试剂、全自动酶标仪和实时荧光定量PCR(qRT-PCR)仪购自美国Bio-Rad公司。
1.2 细胞培养和分组常规HepG2细胞复苏,采用含10%胎牛血清的DMEM培养基,常规培养于37℃、5% CO2培养箱中,细胞贴壁90%以上时分为Res组和对照组,Res组加入DMSO稀释的40μmol·L-1Res,对照组加入相同浓度的DMSO,作用24h后,再换无血清、无双抗培养液培养24h, 收集细胞上清。
1.3 ELISA法检测2组细胞中TG和总胆固醇(TC)水平采用ELISA法,按照试剂盒说明书要求检测2组细胞上清中TG和TC水平。
1.4 实时荧光定量PCR(qRT-PCR)法检测2组细胞中ACC1、FASN和SCD1 mRNA表达水平引物由英潍捷基(上海)贸易有限公司合成。引物序列:ACC1,上游引物5′-TTAACAGCTGTGGAGTCTGGCTGT-3′, 下游引物5′-AACACTCGATGGAGTTTCTCGCCT-3′; FASN,上游引物5′-CACAGGGACAACCTGGAGTT-3′, 下游引物5′-ACTCCACAGGTGGGAACAAG -3′; SCD1,上游引物5′-CGACGTGGCTTT TTCTTCTC-3′, 下游引物5′-CCTTCTCTTTGACAGCTGGG-3′。提取细胞总RNA, 取1 μg RNA样本, 按cDNA-链试剂盒说明合成cDNA, 以cDNA为模板扩增。反应条件:94℃、3 min;94℃、30 s,58℃、30 s,72℃、1 min, 循环35次;72℃、5 min。采用SYBR Green法进行RT-PCR,采用Bio-Rad CFX96荧光定量系统进行荧光检测。实验重复3次,采用2-△△Ct相对定量法计算mRNA表达水平。
1.5 Western blotting法检测2组细胞中ACC1、FASN、SCD1蛋白表达水平和O-GlcNAc糖基化水平细胞裂解后BCA法测定各样本蛋白浓度, 蛋白变性后上样, 8%聚丙烯酰胺凝胶电泳,转移至PVDF膜上,5%牛奶室温封闭1h, 加入一抗(1:1000)4℃过夜;次日,TBST洗膜后加入二抗(1:2000),室温孵育1h,化学发光显影,结果用Image-Lab图像软件分析。用Image J软件分析蛋白条带灰度值,目的条带的灰度值与β-actin的灰度值比值表示目的蛋白表达水平。
1.6 统计学分析采用SPSS19.0和GraphPad Prism5统计软件进行统计学分析。2组细胞中TG、TC水平,脂肪合成酶mRNA和蛋白表达水平、O-GlcNAc糖基化水平均以x±s表示,组间比较采用独立样本t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 2组细胞上清中TG和TC水平与对照组比较,Res组细胞上清中TG和TC水平有所下降,但差异无统计学意义(P>0.05)。见表 1。
| [n=3, x±s, cB/(mmol·L-1)] | ||
| Group | TG | TC |
| Control | 0.575±0.261 | 0.416±0.059 |
| Res | 0.527±0.351 | 0.326±0.229 |
与对照组比较,Res组细胞中ACC1 mRNA表达水平有所下降,但差异无统计学意义(P>0.05),FASN和SCD1 mRNA表达水平明显降低(P < 0.01)。见表 2。
| (n=3, x±s) | |||
| Group | ACC1 mRNA | FASN mRNA | SCD1 mRNA |
| Control | 1.000±0.133 | 1.000±0.040 | 3.652±0.266 |
| Res | 0.863±0.067 | 0.522±0.052* | 1.000±0.117* |
| *P < 0.01 compared with control group. | |||
与对照组比较,Res组细胞中ACC1蛋白表达水平有所下降,但差异无统计学意义(P>0.05);FASN和SCD1蛋白表达水平明显降低(P < 0.05或P < 0.01)。见图 1。

|
| Lane 1: Control group; Lane 2: Res group;*P < 0.05,**P < 0.01 compared with control group. 图 1 Western blotting法检测2组细胞中ACC1、FASN和SCD1蛋白表达电泳图(A)和直条图(B~D) Fig. 1 Electrophoregram(A)and histrogram(B-D) of expressions of ACC1, FASN, and SCD1 proteins in cells in two groups measured by Western blotting method |
|
|
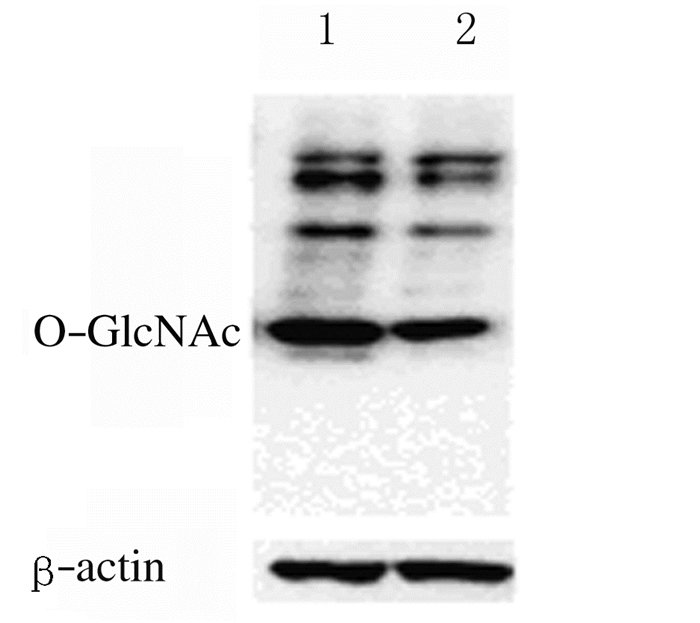
与对照组(3.515±0.413)比较,Res组细胞中O-GlcNAc糖基化表达水平(2.094±0.271)明显降低(P < 0.05)。见图 2。
|
| Lane 1: Control group; Lane 2: Res group. 图 2 Western blotting法检测2组细胞中O-GlcNAc糖基化表达电泳图 Fig. 2 Electrophoregram of expressions of O-GlcNAc glycosylation in cells in two groups measured by Western blotting method |
|
|
NAFLD发病率高,高脂饮食及脂肪代谢紊乱是NAFLD的主要危险因素[8]。在肝细胞脂肪合成过程中,脂肪合成酶ACC1、FASN和SCD1是TG主要成分的合成酶[9],起着重要作用,其中ACC1和FASN是限速酶[10],目前尚无直接影响这3种酶的药物。Res是天然多酚类化合物,具有抗氧化、调节血脂和改善脂代谢等广泛生物学效应[11-12]。研究[13]显示:Res干预后,脂肪组织和肝脏脂肪积累明显减少。胆固醇调节元件结合蛋白1(sterol-regulatory element binding proteins-1, SREBP1)是脂肪合成中的转录因子,Res通过抑制SREBP1表达和活性,下调FASN等脂肪合成基因,抑制肝脏脂肪合成,减少肝脏的脂肪蓄积和脂肪变性[14-15]。ACC1、FASN和SCD1水平增加促进肝细胞脂肪合成及脂肪酸积累,导致肝细胞脂肪变性,引起NAFLD。
本研究应用Res干预HepG2细胞结果显示:Res组细胞上清液中TG和TC水平较对照组均有下降,其中TC下降明显,但差异无统计学意义,可能与上清液的脂溶性及TG和TC被稀释有关;Res组细胞中脂肪合成酶ACC1、FASN、SCD1 mRNA和蛋白水平较对照组均降低,表明Res可能通过降低脂肪合成酶的表达减少肝细胞脂肪合成。
O-GlcNAc糖基化参与翻译、信号转导和蛋白酶解等多种生物学过程的调控[16-17],糖基化转移酶N-乙酰氨基葡萄糖转移酶(OGT)是唯一的O-GlcNAc糖基化酶,而糖苷酶N-乙酰氨基葡萄糖苷酶(OGA)是唯一的去糖基化酶[18-19]。乳腺癌MCF-7细胞中,过表达的OGT通过增加SREBP1调节脂质合成[20],因此,O-GlcNAc糖基化可能促进细胞脂肪合成。本研究结果显示:Res组细胞中O-GlcNAc糖基化水平较对照组明显降低,提示Res可以降低O-GlcNAc糖基化水平,推测Res可能通过抑制OGT或激活OGA,降低O-GlcNAc糖基化,从而抑制脂肪合成。
综上所述,Res对HepG2细胞脂肪合成具有抑制作用,其可能机制是通过减少脂肪合成酶ACC1、FASN和SCD1表达或抑制OGT、激活OGA进而降低O-GlcNAc糖基化水平达到抑制脂肪合成的作用。
| [1] | FRIEDMAN S L, NEUSCHWANDER-TETRI BA, RINELLA M, et al. Mechanisms of NAFLD development and therapeutic strategies[J]. Nat Med, 2018, 24(7): 908–922. DOI:10.1038/s41591-018-0104-9 |
| [2] | ESLAM M, VALENTI L, ROMEO S. Genetics and epigenetics of NAFLD and NASH:clinical impact[J]. J Hepatol, 2018, 68(2): 268–279. DOI:10.1016/j.jhep.2017.09.003 |
| [3] | YANG X, QIAN K. Protein O-GlcNAcylation:emerging mechanisms and functions[J]. Nat Rev Mol Cell Biol, 2017, 18(7): 452–465. DOI:10.1038/nrm.2017.22 |
| [4] | HWANG H, RHIM H. Functional significance of O-GlcNAc modification in regulating neuronal properties[J]. Pharmacol Res, 2018, 129: 295–307. DOI:10.1016/j.phrs.2017.12.006 |
| [5] | KEEMBIYEHETTY C N, KRZESLAK A, LOVE D C, et al. A lipid-droplet-targeted O-GlcNAcase isoform is a key regulator of the proteasome[J]. J Cell Sci, 2011, 124(Pt 16): 2851–2860. |
| [6] | YANG Y R, JANG H J, CHOI S S, et al. Obesity resistance and increased energy expenditure by white adipose tissue browning in Oga(+/-) mice[J]. Diabetologia, 2015, 58(12): 2867–2876. DOI:10.1007/s00125-015-3736-z |
| [7] | 王光丽, 傅玉才, 冯雅卿, 等. 白藜芦醇对软脂酸钠诱导的肝细胞脂肪变性的影响[J]. 汕头大学医学院学报, 2009, 22(1): 9–11, 67. |
| [8] | HANNAH W N, HARRISON S A. Lifestyle and dietary interventions in the management of nonalcoholic fatty liver disease[J]. Dig Dis Sci, 2016, 61(5): 1365–1174. DOI:10.1007/s10620-016-4153-y |
| [9] | PATEL V, JOHARAPURKAR A, KSHIRSAGAR S, et al. Coagonist of GLP-1 and glucagon receptor ameliorates development of non-alcoholic fatty liver disease[J]. Cardiovasc Hematol Agents Med Chem, 2018, 16(1): 35–43. DOI:10.2174/1871525716666180118152158 |
| [10] | 林义轩, 徐新. 微小核糖核酸调控脂质代谢的相关研究进展[J]. 中国心血管病研究, 2015, 13(2): 101–105. DOI:10.3969/j.issn.1672-5301.2015.02.002 |
| [11] | HEEBØLL S, THOMSEN K L, PEDERSEN S B, et al. Effects of resveratrol in experimental and clinical non-alcoholic fatty liver disease[J]. World J Hepatol, 2014, 6(4): 188–198. DOI:10.4254/wjh.v6.i4.188 |
| [12] | 李佳军, 韩金良, 田玉顺. 白藜芦醇及其衍生物药理作用的研究现状[J]. 药学研究, 2017, 36(3): 161–163. |
| [13] | 陆奇群, 张曦. 白藜芦醇通过诱导自噬改善高脂饮食小鼠非酒精性脂肪肝[J]. 浙江中西医结合杂志, 2018, 28(1): 13–15, 20, 84. DOI:10.3969/j.issn.1005-4561.2018.01.005 |
| [14] | 王光丽, 周小辉, 傅玉才. 白藜芦醇改善肝细胞脂肪变性的相关调控机制[J]. 汕头大学医学院学报, 2011, 24(4): 200–203. |
| [15] | 高燕翔, 张勇, 刘裕, 等. SREBP-1c在白藜芦醇预防大鼠非酒精性脂肪肝发生中的作用[J]. 第三军医大学学报, 2015, 37(17): 1704–1708. |
| [16] | MACHACEK M, SLAWSON C, FIELDS P E. O-GlcNAc in cancer:An Oncometabolism-fueled vicious cycle[J]. J Bioenerg Biomembr, 2018, 50(3): 223–229. |
| [17] | CORK G K, THOMPSON J, SLAWSON C. Real talk:The inter-play between the mTOR, AMPK, and hexosamine biosynthetic pathways in cell signaling[J]. Front Endocrinol (Lausanne), 2018, 9: 522. DOI:10.3389/fendo.2018.00522 |
| [18] | HART G W, SLAWSON C, RAMIREZ-CORREA G, et al. Cross talk between O-GlcNAcylation and phosphorylation:roles in signaling, transcription, and chronic disease[J]. Annu Rev Biochem, 2011, 80: 825–858. DOI:10.1146/annurev-biochem-060608-102511 |
| [19] | HARDIVILLÉ S, HART G W. Nutrient regulation of signaling, transcription, and cell physiology by O-GlcNAcylation[J]. Cell Metab, 2014, 20(2): 208–213. DOI:10.1016/j.cmet.2014.07.014 |
| [20] | SODI V L, BACIGALUPA Z A, FERRER C M, et al. Nutrient sensor O-GlcNAc transferase controls cancer lipid metabolism via SREBP-1 regulation[J]. Oncogene, 2018, 37(7): 924–934. DOI:10.1038/onc.2017.395 |
 2019, Vol. 45
2019, Vol. 45


