扩展功能
文章信息
- 王海彬, 董志军, 郭立涛, 石晶, 董薇丽
- WANG Haibing, DONG Zhijun, GUO Litao, SHI Jing, DONG Weili
- 菩人丹超微粉对糖尿病大鼠视网膜血流动力学和细胞因子表达的影响
- Effects of Purendan Superfine Powder on retinal hemodynamics and expressions of cytokines in diabetic rats
- 吉林大学学报(医学版), 2019, 45(01): 57-62
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 57-62
- 10.13481/j.1671-587x.20190111
-
文章历史
- 收稿日期: 2018-05-12
糖尿病视网膜病变(diabetic retinopathy,DR)是由糖尿病导致的微血管并发症,主要因高血糖导致视网膜毛细血管壁出现渗漏等症状引起[1]。中医学[2]认为:糖尿病属于“消渴病”的范畴,以多饮、多尿、多食、消瘦、疲乏和尿甜为主要特征。在我国,DR的发生率为44.0%~51.3%[3]。因此,找到一种有效预防和治疗糖尿病的方法一直是医学上的研究热点。菩人丹超微粉(简称PRD)具有益气生津、清解郁热的功效,主要药理作用为降脂和降糖,并且对糖尿病大血管病变具有保护作用[4-5]。研究[6-7]表明:血管内皮生长因子(vascular endothelial growth factor,VEGF)和碱性纤维细胞生长因子(basic fibroblast growth factor, bFGF)是调节视网膜新生血管形成的关键因素,在DR的发生发展过程中起重要作用。目前国内外关于PRD调节VEGF和bFGF的研究尚少。本研究结合血流动力学参数观察PRD对糖尿病大鼠视网膜VEGF和bFGF表达的影响,探讨PRD对改善糖尿病视网膜微血管病变的可能机制。
1 材料与方法 1.1 实验动物及试剂8周龄Wistar大鼠36只,体质量200~250g,由华北制药股份有限公司提供,动物许可证号:SYXK(冀)2015-0039,适应性饲养2周。链脲佐菌素(streptozotocin, STZ, 美国Sigma公司)溶于0.1 mol·L-1、pH4.4的柠檬酸盐缓冲液中,配置成10 g·L-1的溶液;兔抗大鼠VEGF和bFGF抗体(北京博尔森公司);VEGF和bFGF mRNA试剂盒(上海生工生物工程公司);PRD(河北以岭药业集团有限公司)。
1.2 实验动物模型的建立及给药方法[8]36只大鼠随机分为对照组、糖尿病组和PRD组,造模前测定大鼠体质量和血糖。糖尿病组和PRD组大鼠腹腔注射STZ溶液(65 mg·kg-1),对照组大鼠腹腔注射等体积的柠檬酸盐缓冲液。于注射后72h尾部取血测定血糖,以血糖≥16.70 mol·L-1为造模成功。造模后PRD组大鼠灌胃给予PRD(剂量为1.8 g·kg-1),对照组和糖尿病组大鼠灌胃给予等体积的生理盐水,每日1次,连续给药3个月。各组大鼠自由摄食饮水。
1.3 各组大鼠体质量、尿量、血糖、肝指数和肾指数测定各组大鼠称体质量,测尿量,尾静脉采血,采用美国One TouchⅡ血糖仪检测血糖。脱臼处死大鼠后迅速取眼球于-80℃下保存,取出肝脏和两侧肾脏称质量。按以下公式计算肝、肾指数:脏器指数=脏器质量(mg)/体质量(g)。
1.4 视网膜中央动脉(CRA)血流学参数测定各组大鼠于末次给药后腹腔注射戊巴比妥钠30 mg·kg-1麻醉,采用彩色多谱勒超声诊断仪,15 MHz探头检测大鼠CRA,将探头置于大鼠眼睑上,启动彩色多普勒超声诊断仪,在获取5个以上稳定心动周期后,检测峰值血流速度(PSV)、舒张期最低流速(EDV)和平均流速(MV),计算阻力指数(RI)和搏动指数(PI),计算公式:RI=(PSV-EDV)/PSV,PI=(PSV-EDV)/MV[9]。
1.5 RT-PCR法检测大鼠视网膜VEGF和bFGF mRNA表达水平取分离的视网膜组织,置于液氮中打碎,按照Trizol说明书提取视网膜总RNA,经检测总RNA完整未被污染,取3 μL总RNA进行逆转录(RT),RT反应条件:30℃、10 min,55℃、30 min,99℃、5 min,5℃、5 min。PCR反应条件:94℃、2 min;94℃、30 s,50℃~65℃、30s;72℃;1 min。反应后取最终产物10 μL经过1.2%琼脂糖凝胶电泳,以β-actin为内参,计算VEGF和bFGF与β-actin灰度值的比值,表示VEGF和bFGF mRNA表达水平。
bFGF引物序列:上游引物5′-GGCTTCTTCCTGCGCATCCA-3′,下游引物5′-GCTCTTAGCAGACATTGGAAGA-3′,57℃退火,35个循环,产物大小为374bp;VEGF引物序列:上游引物5′-GCGGGCTGCTGCAATG-3′,下游引物5′-TGCAACGCGAGTCTGTGTTT-3′,55℃退火,33个循环,扩增片段长度为183 bp;β-actin引物序列:上游引物5′-CATCCTGCGTCTGGACCT-3′,下游引物5′-TCAGGAGGAGCAATGATCTTG-3′,56℃退火,30个循环,扩增片段长度为510bp;
1.6 免疫组织化学染色检测大鼠视网膜组织中VEGF和bFGF蛋白表达水平取各组大鼠眼球,冰浴中细心分离视网膜,去除角膜、晶状体和玻璃体,取出视网膜组织,连续切片,片厚4μm,加入一抗(1:100),采用DAB显色,苏木素复染细胞核,阴性对照为0.01 mmol·L-1PBS代替一抗。采用阳性细胞半定量法,胞浆中出现棕黄色颗粒为阳性表达细胞,每个切片随机选取5个高倍镜视野,每个视野计数100个细胞,计算阳性细胞数占总细胞数的百分比,取平均值。阳性细胞数 < 5%为(-),5%~15%为(+),16%~50%为(╫),大于50%为(
取分离的视网膜组织,提取蛋白质,以BCA蛋白试剂盒定量蛋白浓度,蛋白上样量为50 μg,12%SDS-PAGE凝胶电泳2h,移至硝酸纤维素膜,5%脱脂奶粉TBST封闭2h;分别加入VEGF和bFGF抗体(1:200),4℃过夜,洗膜后加入二抗辣根过氧化物酶(HRP)交联物室温下摇床孵育1h,采用Super ECL Plus超敏发光液显影,对显影条带进行分析,以VEGF和bFGF条带与β-actin条带的灰度比值作为目的蛋白相对表达水平。
1.8 统计学分析采用SPSS17.0统计软件进行统计学分析。各组大鼠体质量、血糖、尿量、肝指数、肾指数、血流动力学参数、VEGF和bFGF mRNA及蛋白表达水平均以x ±s表示,数据符合正态分布且方差齐性,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠体质量、血糖、尿量、肝指数和肾指数与对照组比较,糖尿病组大鼠体质量明显降低(P < 0.05),血糖、尿量、肝指数和肾指数明显升高(P < 0.05);与糖尿病组比较,PRD组大鼠体质量明显增加(P < 0.05),血糖、尿量、肝指数和肾指数明显降低(P < 0.05)。见表 1。
| (x ±s) | ||||||
| Group | n | Body weight(m/g) | Blood glucose[cB/(mmol·L-1)] | Urine volume(V/mL) | Liver index | Renal index |
| Control | 12 | 284±23 | 7.62±2.46 | 6.4±1.8 | 3.46±1.01 | 30.06±5.62 |
| Diabetes | 9 | 193±21* | 22.81±4.52* | 28.8±6.6* | 5.62±0.67* | 42.57±6.41* |
| PRD | 12 | 269±25△ | 13.83±3.17△ | 12.0±2.4△ | 3.91±0.59△ | 36.84±3.02△ |
| *P < 0.05compared with control group; △P < 0.05compared with diabetes group. | ||||||
与对照组比较,模型组大鼠CRA的PSV、EDV和MV均明显降低(P < 0.05),RI和PI明显升高(P < 0.05);与模型组比较,PRD组大鼠CRA的PSV、EDV和MV均明显升高(P < 0.05),RI和PI明显降低(P < 0.05)。见表 2。
| (x ±s) | ||||||
| Group | n | PSV[v/(cm·s-1)] | EDV[v/(cm·s-1)] | MV[v/(cm·s-1)] | RI | PI |
| Control | 12 | 13.10±3.84 | 7.21±1.26 | 10.03±2.11 | 0.45±0.03 | 0.59±0.06 |
| Diabetes | 9 | 9.01±1.59* | 3.44±0.59* | 5.64±0.90* | 0.62±0.04* | 0.99±0.12* |
| PRD | 12 | 12.53±4.84△ | 6.02±0.31△ | 8.96±0.62△ | 0.52±0.03△ | 0.73±0.08△ |
| *P < 0.05 compared with control group; △P < 0.05compared with diabetes group. | ||||||
与对照组比较,糖尿病组大鼠视网膜VEGF和bFGF mRNA表达水平明显升高(P < 0.05);与糖尿病组比较,PRD组大鼠视网膜VEGF和bFGF mRNA表达水平明显降低(P < 0.05)。见图 1、2和表 3。
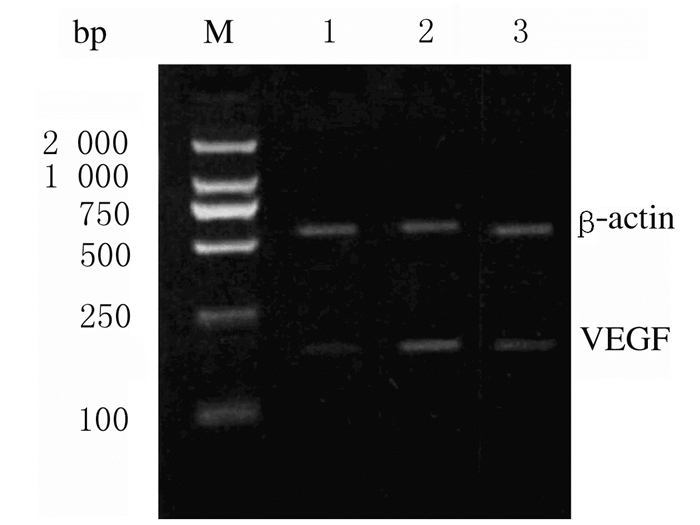
|
| M: Marker DL2000; Lane 1: Control group; Lane 2: Diabetes group; Lane 3: PRD group. 图 1 RT-PCR法检测各组大鼠视网膜组织中VEGF mRNA表达电泳图 Fig. 1 Electrophoregram of VEGF mRNA in retina tissue of rats in various groups detected with RT-PCR |
|
|

|
| M: Marker DL2000; Lane 1: Control group; Lane 2: Diabetic group; Lane 3: PRD group. 图 2 RT-PCR法检测各组大鼠视网膜组织中bFGF mRNA表达电泳图 Fig. 2 Electrophoregram of bFGF mRNA in retina tissue of rats in various groups detected with RT-PCR |
|
|
| (x ±s) | |||
| Group | n | VEGF mRNA | bFGF mRNA |
| Control | 12 | 0.575±0.045 | 0.473±0.024 |
| Diabetes | 9 | 0.907±0.101* | 0.862±0.070* |
| PRD | 12 | 0.734±0.084△ | 0.704±0.074△ |
| *P < 0.05compared with control group; △P < 0.05 compared with diabetes group. | |||
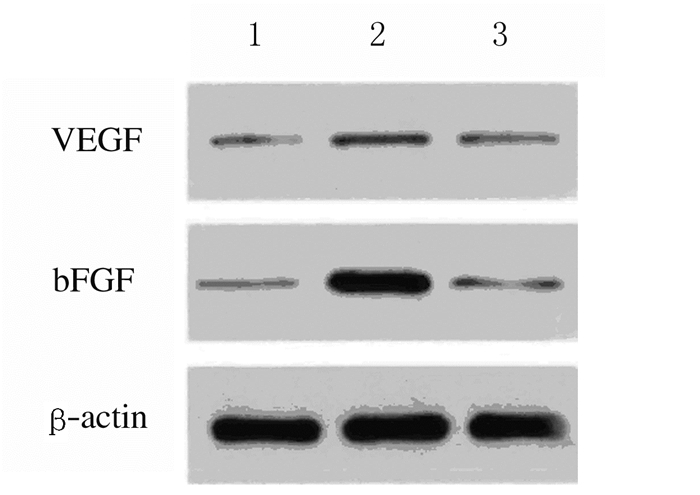
免疫组织化学染色结果显示:与对照组比较,糖尿病组大鼠视网膜内核层和神经节细胞层VEGF和bFGF蛋白呈阳性表达,阳性细胞数量明显增加(P < 0.05),灰度值比值明显降低(P < 0.05);与糖尿病组比较,PRD组大鼠VEGF和bFGF蛋白阳性细胞数量明显降低(P < 0.05),灰度值比值明显升高(P < 0.05)。见图 3(插页三)和表 4。Western blotting检测结果显示:与对照组比较,糖尿病组大鼠VEGF和bFGF蛋白表达水平明显升高(P < 0.05);与模型组比较,PRD组大鼠VEGF和bFGF蛋白表达水平明显降低(P < 0.05)。见图 4和表 5。
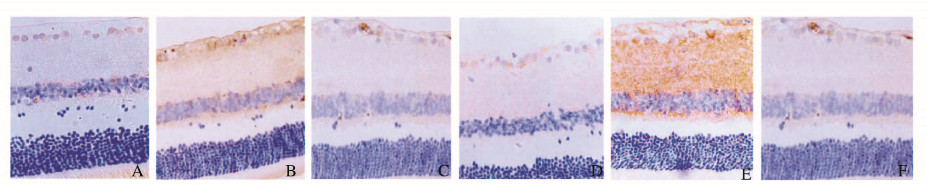
|
| A, D: Control group; B, E: Diabetes group; C, F: PRD group; A-C: VEGF protein; D-F: BFGF protein. 图 3 免疫组织化学染色检测各组大鼠视网膜组织中VEGF和bFGF蛋白表达(×400) Fig. 3 Expressions of VEGF and bFGF proteins in retina tissue of rats in various groups detected by immunohistochemstry staining (×400) |
|
|
| Group | n | VEGF | bFGF | |||||||||
| - | + | ╫ |  |
Gray value | - | + | ╫ |  |
Gray value | |||
| Control | 12 | 11 | 1 | 0 | 0 | 134.68±8.97 | 10 | 2 | 0 | 0 | 126.28±10.52 | |
| Diabetes | 9 | 1 | 2 | 5 | 1 | 110.25±6.84* | 0 | 2 | 5 | 2 | 105.35±9.51* | |
| PRD | 12 | 10 | 2 | 0 | 0 | 118.12±5.24△ | 9 | 2 | 1 | 0 | 114.37±6.42△ | |
| *P < 0.05compared with control group; △P < 0.05 compared with diabetes group. | ||||||||||||
|
| Lane 1: Control group; Lane 2: Diabetes group; Lane 3: PRD group. 图 4 Western blotting法检测各组大鼠视网膜组织中VEGF和bFGF蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of VEGF and bFGF proteins in retina tissue of rats in various groups detected with Western blotting method |
|
|
| (x ±s) | |||
| Group | n | VEGF protein | bFGF protein |
| Control | 12 | 0.146±0.026 | 0.205±0.019 |
| Diabetes | 9 | 0.547±0.041* | 0.664±0.068* |
| PRD | 12 | 0.237±0.035△ | 0.306±0.053△ |
| *P < 0.05compared with control group; △P < 0.05 compared with diabetes group. | |||
中医理论认为:DR的主要发病机制为气虚血滞,津液损耗所致。气虚引起人体帅血无力,血流凝滞不畅,津液损耗则导致脉道失润,血行涩滞,最终产生血瘀,引起毛细血管病变。中医对DR的治疗原则为益气、养阴和化瘀[10-11]。PRD由苦瓜、人参、丹参、制首乌、葛根和水蛭等组成,具有益气养阴、清热和活血化瘀通络之功效。近年来,PED在治疗糖尿病相关疾病方面具有一定疗效[5, 12]。
本研究结果显示:糖尿病组大鼠体质量下降,尿量和血糖增高,与糖尿病多饮、多尿、吸收减少、体质量下降的特征相符;另外,大鼠肝指数和肾指数明显增加,可能与肝肾损伤和炎症充血水肿有关,与糖尿病大鼠体质量降低也有一定联系,给药后PRD组大鼠肝指数和肾指数明显下降;PRD组大鼠体质量较糖尿病组升高,尿量和血糖有所下降,与前期研究中PRD能改善糖尿病大鼠血糖升高结果一致[13]。
DR的发生对患者眼动脉血流动力学有一定影响,血流动力学参数中,PSV能够反映血管充盈度和血流供应程度,EDV为远端组织血液灌注状态,MD为远端血管阻力敏感性指标,RI和PI评价远端血管床阻力大小。本研究中多普勒超声检测结果显示:糖尿病组大鼠CRA的PSV、EDV和MV较对照组大鼠降低,RI和PI较对照组大鼠升高,与糖尿病患者临床结果相似[14]。本研究结果显示:PRD组大鼠CRA的PSV、EDV和MV增加,RI和PI降低,可能与PRD降低血糖,从而降低血液黏度,使血液流速和视网膜血灌注量增加有关。研究[15]表明:视网膜血流量减少可引起视网膜缺血缺氧,从而诱发视网膜新生血管的形成。新生血管的形成受到多个细胞因子的调控,如VEGF和bFGF等,这些细胞因子与DR的发生有着密切联系。VEGF能够特异地作用于血管内皮细胞,促进细胞分裂增殖[16],对新生血管的形成是必需的。bFGF是一种促进新生血管形成的生长因子,通过上调VEGF促进血管内皮细胞增殖,能够诱导内皮细胞产生细胞因子,促进毛细血管内皮细胞的迁移形成胶原基质,促进毛细管状微管形成,最终生成新生血管[17-18]。VEGF和bFGF在微血管形成的过程中有协同增强的作用[19-20]。本研究结果显示:糖尿病组大鼠视网膜组织中VEGF和bFGF表达水平明显高于对照组,与DR视网膜血流量减少,导致视网膜缺氧有关[21];与糖尿病组比较,PRD组大鼠视网膜组织中VEGF与bFGF表达水平降低,说明PRD能够改善视网膜血流灌注量,恢复视网膜血液供应,从而降低VEGF与bFGF表达水平。
综上所述,PRD可通过降低血糖水平,降低血液黏度,增加视网膜血流量和视网膜组织血供,从而增加微循环血液灌注量,降低血管床灌注阻力,改善视网膜的微循环,对糖尿病视网膜病变起保护作用。
| [1] | 张凤俊, 易敬林, 李晶明, 等. 糖尿病视网膜病变发病机制研究进展[J]. 眼科新进展, 2016, 36(6): 584–587. |
| [2] | 左舒颖, 倪青. 2型糖尿病病证结合治疗体会[J]. 北京中医药, 2017, 36(6): 537–540. |
| [3] | 陈阳, 张丽华, 封敏. 中西医结合治疗糖尿病视网膜病变82例临床观察[J]. 实用临床医药杂志, 2015, 19(11): 180–181. |
| [4] | 庞宗然, 苏晓慧, 刘祖涵, 等. 菩人丹超微粉对T2DM大血管病变大鼠主动脉形态结构的影响[J]. 辽宁中医杂志, 2011, 38(10): 1923–1925, 2112. |
| [5] | 刘祖涵, 张梓倩. 菩人丹对T2DM胰腺微血管损伤大鼠胰岛β细胞功能及胰岛素抵抗的影响[J]. 天津中医药, 2016, 33(7): 414–418. |
| [6] | 贾明利, 李庆雨. VEGF、bFGF在糖尿病视网膜病变中的表达及意义[J]. 中国实用医药, 2017, 12(21): 37–39. |
| [7] | CHOI S M, LEE K M, KIM H J, et al. Effects of structurally stabilized EGF and bFGF on wound healing in type Ⅰ and type Ⅱ diabetic mice[J]. Acta Biomater, 2017, 66: 325–334. |
| [8] | 张自然, 董志军, 董微丽, 等. 中药菩人丹对OLETF大鼠视网膜磷酸化c-Jun氨基末端激酶和半胱氨酸天冬氨酸激酶-3表达的干预作用[J]. 中成药, 2016, 38(6): 1397–1401. |
| [9] | 刘学梅, 靳春杰, 周伟. 三七对糖尿病大鼠视网膜血流动力学影响的实验研究[J]. 辽宁中医杂志, 2017, 44(10): 2183–2186, 2240. |
| [10] | 董娜, 金智生. 论益气养阴、活血化瘀法在糖尿病治疗中的应用[J]. 中医药临床杂志, 2018, 30(1): 15–16. |
| [11] | 王鑫蕊, 郭鑫瞳, 刘广鹏, 等. 南征教授滋阴清热、益气养阴、活血化瘀法治疗消渴病[J]. 长春中医药大学学报, 2017, 33(2): 269–271. |
| [12] | 白颖慧, 杜子亮, 陈书, 等. 菩人丹改善高糖波动状态下INS-1细胞胰岛素分泌功能的分子机制[J]. 中国中医基础医学杂志, 2016, 22(12): 1620–1624, 1637. |
| [13] | 张垒, 董志军, 张铁民. 菩人丹超微粉对2型糖尿病大鼠血糖和血脂的影响[J]. 承德医学院学报, 2012, 29(1): 20–22. DOI:10.3969/j.issn.1004-6879.2012.01.010 |
| [14] | 朱汝霞, 黄炫庚, 陈冰, 等. 检测2型糖尿病患者颈动脉流体动力学和血清炎症因子的意义[J]. 海南医学院学报, 2017, 23(6): 752–754, 758. |
| [15] | 陈小红, 王云鹏, 陈梅珠. VEGF和PEDF在增殖性糖尿病视网膜病变中的研究进展[J]. 国际眼科杂志, 2015, 15(1): 55–57. |
| [16] | WANG L J, XIAO F, KONG L M, et al. Intermedin enlarges the vascular lumen by inducing the quiescent endothelial cell proliferation[J]. Arterioscler Throm Vas Biol, 2018, 38(2): 398–413. DOI:10.1161/ATVBAHA.117.310317 |
| [17] | GALLEGO-MUÑOZ P, IBARES-FRÍAS L, GARROTE A, et al. Human corneal fibroblast migration and extracellular matrix synthesis during stromal repair:Role played by platelet-derived growth factor-BB, basic fibroblast growth factor, and transforming growth factor-β1[J]. J Tissue Eng Regen Med, 2018, 12(2): 737–746. DOI:10.1002/term.v12.2 |
| [18] | WATANABE A, KURABAYASHI M, ARAI M, et al. Combined effect of retinoic acid and basic FGF on PAI-1 gene expression in vascular smooth muscle cells[J]. Cardiovasc Res, 2001, 51(1): 151–159. DOI:10.1016/S0008-6363(01)00274-7 |
| [19] | SZYBERT S, MOSZYNSKI R, MICHALAK S, et al. The associations between serum VEGF, bFGF and endoglin levels with microvessel density and expression of proangiogenic factors in malignant and benign ovarian tumors[J]. Microvasc Res, 2016, 107: 91–96. DOI:10.1016/j.mvr.2016.06.002 |
| [20] | 郑晓燕, 唐纯志. 针灸对实验性糖尿病小鼠心脏功能调节的影响[J]. 西安交通大学学报:医学版, 2018, 39(5): 765–769. |
| [21] | PAVLISA G, PAVLISA G, KUSEC V, et al. Serum levels of VEGF and bFGF in hypoxic patients with exacerbated COPD[J]. Eur Cytokine Netw, 2010, 21(2): 92–98. |
 2019, Vol. 45
2019, Vol. 45


