扩展功能
文章信息
- 贾占伟, 李凤艺, 何强, 张玉波, 韩海霞, 单春光
- JIA Zhanwei, LI Fengyi, HE Qiang, ZHANG Yubo, HAN Haixia, SHAN Chunguang
- 2型糖尿病小鼠内质网应激对耳蜗毛细胞退行性变的影响
- Influence of endoplasmic reticulum stress in degeneration of cochlear hair cells in type 2 diabetic mice
- 吉林大学学报(医学版), 2019, 45(01): 51-56
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 51-56
- 10.13481/j.1671-587x.20190110
-
文章历史
- 收稿日期: 2018-01-30
2. 河北医科大学第二医院眼科, 河北 石家庄 050000
2. Department of Ophthalmology, Second Hospital, Hebei Medical University, Shijiazhuang 050000, China
随着人们生活条件的改善,饮食结构的改变,糖尿病的发病率在全球呈现明显上升趋势[1]。而糖尿病的并发症也成为威胁人类健康、致死和致残的重大危害因素[2]。糖尿病最常引起听力减退及神经血管病变,严重者导致耳聋。研究[3]显示:50%糖尿病患者伴有听力障碍。糖尿病耳聋是以耳蜗毛细胞散失及耳蜗毛细胞发生退行性变为主要表现的一种缓慢进展性疾病[4-5]。在糖尿病耳聋的模型中,以2型糖尿病耳聋的听力损害最为明显[6]。长期高血糖容易导致氧化应激,可以激活多种凋亡的信号通路,造成耳蜗毛细胞的氧化损伤[7]。研究[8-10]表明:细胞凋亡与糖尿病并发症的发生有密切的关联。其主要分为2种途径:细胞外和细胞内的线粒体途径可以激活半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase, caspase)家族的许多因子如caspase-12等参与的细胞凋亡过程[11-12]。近年来研究[13]显示:内质网应激(endoplasmic retic-ulum stress, ERS)启动的凋亡通路在2型糖尿病耳聋中发挥着越来越重要的作用。在ERS过程中,其标志蛋白葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)的高表达,激活了内质网家族的的效应蛋白caspase-12的高表达,导致了细胞的凋亡[14]。本研究以2型糖尿病小鼠为模型,观察ERS反应是否参与介导2型糖尿病所导致的耳蜗毛细胞的凋亡及凋亡过程中耳蜗毛细胞发生退行性变的机制,揭示2型糖尿病耳聋发生发展的细胞分子机制,为其临床治疗提供新的指导方向。
1 材料与方法 1.1 实验动物及分组清洁级1月龄健康昆明小鼠20只, 雌雄各半,体质量50~120g, 由四川大学华西实验动物中心提供, 经实验动物伦理机构批准,动物合格证号: 24101113。
1.2 主要试剂及仪器链脲佐菌素(streptozotocin, STZ)(美国MP Biomedicals公司), Trizol试剂、逆转录试剂盒、实时定量PCR试剂盒和10%多聚甲醛(上海翊圣生物科技有限公司),GAPDH及caspase-12引物(深圳华大基因科技有限公司),兔抗鼠caspase-12、GRP78、p-ERK和Nrf2抗体及内参β-actin(联科生物科技有限公司)。PCR八联管(上海生工生物工程股份有限公司),血糖仪(美国强生医疗器械有限公司),Nicolet-BRAVO型诱发电位仪(美国Nicolet公司),匀浆机(上海默西科学仪器有限公司)。
1.3 2型糖尿病动物模型的建立小鼠随机分为对照组和2型糖尿病模型组,每组10只。对照组小鼠给予基础饲料,模型组小鼠给予基础饲料加20%蔗糖。各组小鼠喂养饲料4周后均禁食12h,不禁水,对照组小鼠腹腔注射生理盐水,模型组小鼠腹腔注射40 mg·kg-1STZ, 注射剂量为5 μL·g-1;1周后在相同条件下第2次模型组小鼠腹腔注射40 mg·kg-1 STZ,对照组小鼠腹腔注射等体积的生理盐水。在第2次注射后,每隔7 d测定小鼠尾静脉血糖值,空腹血糖在7.8 mmol·L-1以上为建模成功。
1.4 听觉脑干反应(auditory brainstem response, ABR)检测小鼠ABR阈值各组小鼠在隔音屏蔽室采用10%水合氯醛(0.3g·kg-1)腹腔注射麻醉,麻醉后分别将电极的正极放在小鼠的颅顶正中皮下,负极放在小鼠的耳廓后皮下。采用诱发电位仪测定小鼠的ABR阈值,滤波频率为100~3 000Hz, 刺激持续时间为20 ms,短纯音刺激频率分别为8、12和24kHz下具有1ms平段,强度从100dB SPL开始,衰减间隔10dB,至接近反应阈值以5dB递减,至刚好出现波形,ABR阈值为至少重复出现2次的ABR波Ⅲ的听力阈值。
1.5 耳声发射(otoacoustic emission,OAE)检测小鼠OAE阈值在声电屏蔽室内, 各组小鼠肌肉注射戊巴比妥钠(35 mg·kg-1)施行全身麻醉后, 在外耳道软骨部切开, 以利于探头与外耳道的准确耦合。采用美国产的HlS version3.2型耳声发射仪, 在ER-1OC探头上接合适的橡胶耳塞, 探头经导线连接放大器及DSP板, 用微机操作测试, 在噪声小于40dBSPL的隔音室内进行。刺激信号的产生、衰减和数据采集使用ILO88/92OAE系统。在低频、中频和高频的刺激下,检测小鼠OAE阈值。
1.6 小鼠耳蜗铺片标本制备及外毛细胞缺损率计算小鼠处于麻醉状态下断头处死,用耳蜗镊去除耳蜗尖附近的耳蜗骨壁,沿骨壁将螺旋韧带分离,再沿着底回基底膜分离基底膜和外侧壁组织,用微型刀尖放于骨阶与鼓螺旋板处,使基底膜与耳蜗轴分离。将分离的基底膜用镊子移到载玻片上,铺平基底膜使其处于同一方向,滴上甘油,盖玻片封片,做好铺片标本。
将做好的耳蜗基底膜铺片标本放于光学显微镜下, 从蜗底到蜗尖计数外毛细胞损失情况, 分别计算底回、中回和顶回的外毛细胞数缺损率。外毛细胞缺损率=受损外毛细胞数/总外毛细胞数×100%。
1.7 Western blotting法检测小鼠耳蜗毛细胞中GRP78、caspase-12、p-ERK和Nrf2蛋白表达水平用剪刀插入小鼠枕骨大孔,沿顶骨正中线剪开,将两块顶骨撬除,暴露脑组织。取出全部脑组织,暴露左右两侧颅中凹。取出听泡暴露耳蜗,新鲜取出的耳蜗毛细组织2个,去除骨组织,加入蛋白裂解液。超声匀浆,95℃保温10min, 12000r·min-1离心15 min, 采用BCA蛋白定量法定量,经过聚丙烯酰胺凝胶电泳,转膜,再放于10%的封闭液中,摇床封闭孵育1h, 分别加入兔抗鼠GRP78抗体(1:2000)、caspase-12抗体(1:2000)、p-ERK抗体(1:1 000)、Nrf2抗体(1:2 000)和内参β-actin(1:5 000),4℃冰箱孵育过夜,TBST缓冲液洗3次,孵育二抗1h, 曝光,用Image Pro Plus5软件计算GRP78、caspase-12、p-ERK和Nrf2蛋白相对表达水平。蛋白相对表达水平=目的蛋白灰度值/β-actin灰度值。
1.8 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠血糖水平、ABR阈值、OAE阈值、毛细胞缺失率及GRP78、caspase-12、p-ERK和Nrf2蛋白表达水平均以x±s表示, 数据符合正态分布及方差齐性,组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组小鼠空腹血糖水平与对照组比较, 模型组小鼠第2次注射STZ7和14 d时空腹血糖水平差异无统计学意义(P > 0.05);第2次注射STZ21、28和35d时空腹血糖水平明显升高(P < 0.05)达到糖尿病标准,第2次注射STZ35d达到最高值。见表 1。
| [n=10, x±s, cB/(mmol·L-1)] | |||||
| Group | Fasting blood glucose | ||||
| (t/d)7 | 14 | 21 | 28 | 35 | |
| Control | 6.12±0.45 | 6.75±4.11 | 7.42±5.12 | 7.14±3.51 | 7.63±6.23 |
| Model | 7.32±4.21 | 8.34±2.45 | 14.68±4.81* | 19.61±2.78* | 21.57±2.51* |
| *P < 0.05 compared with control group. | |||||
在8、12和24 kHz频率的刺激下,小鼠ABR阈值出现明显的变化,与对照组比较,模型组小鼠在8、12和24 kHz各个频率的刺激下ABR阈值均明显升高(P < 0.05)。见表 2。
| (n=10, x±s, dB SPL) | |||
| Group | ABR threshold | ||
| (f/kHz)8 | 12 | 24 | |
| Control | 19.72±3.12 | 25.41±3.71 | 36.73±5.11 |
| Model | 64.72±2.91* | 75.29±4.19* | 82.91±3.89* |
| *P < 0.05 compared with control group. | |||
与对照组比较,模型组小鼠在低频刺激时OAE阈值无明显变化(P > 0.05),在中频和高频刺激下OAE阈值明显升高(P < 0.05)。见表 3。
| (n=10, x±s, dB SPL) | |||
| Group | OAE threshold | ||
| Low frequency(0.6 kHz) | Mediumfrequency(2.0 kHz) | High frequency(7.0 kHz) | |
| Control | 14.35±2.24 | 26.16±5.26 | 37.31±6.71 |
| Model | 17.35±3.57 | 47.51±5.71* | 18.42±7.52* |
| *P < 0.05 compared with control group. | |||
小鼠耳蜗外毛细胞的缺损主要集中在底回端,耳蜗中回和顶回外毛细胞缺损比较少。与对照组比较,模型组小鼠耳蜗底回外毛细胞的缺损率明显升高(P < 0.05),中回和顶回外毛细胞缺损率略有升高,但差异无统计学意义(P > 0.05)。见表 4和图 1(插页二)。
| (n=10, x±s, η/%) | |||
| Group | Defect rate | ||
| Bottom ofgyrus | Middle temporalgyrus | Parietal gyrus | |
| Control | 2.94±3.12 | 1.89±4.26 | 1.28±3.25 |
| Model | 8.72±5.38* | 2.32±2.52 | 1.94±4.71 |
| *P < 0.05 compared with control group. | |||

|
| A: Control group; B: Model group. 图 1 2组小鼠耳蜗基底膜形态表现(×100) Fig. 1 Morphology of basal membrane of cochea of mice in two groups (×100) |
|
|
对照组小鼠耳蜗毛细胞中GRP78和caspase-12蛋白表达水平较低, p-ERK和Nrf2蛋白表达水平较高。与对照组比较, 模型组小鼠耳蜗毛细胞中GRP78和caspase-12蛋白表达水平升高(P < 0.05),p-ERK和Nrf2蛋白表达水平降低(P < 0.05)。见表 5和图 2。
| (n=10, x±s) | ||||
| Group | GRP78 | Caspase-12 | p-ERK | Nrf2 |
| Control | 0.34±2.33 | 0.62±1.35 | 0.89±5.21 | 1.35±3.12 |
| Model | 0.89±5.21* | 1.35±3.12* | 0.34±2.33* | 0.62±1.35* |
| *P < 0.05 compared with control group. | ||||
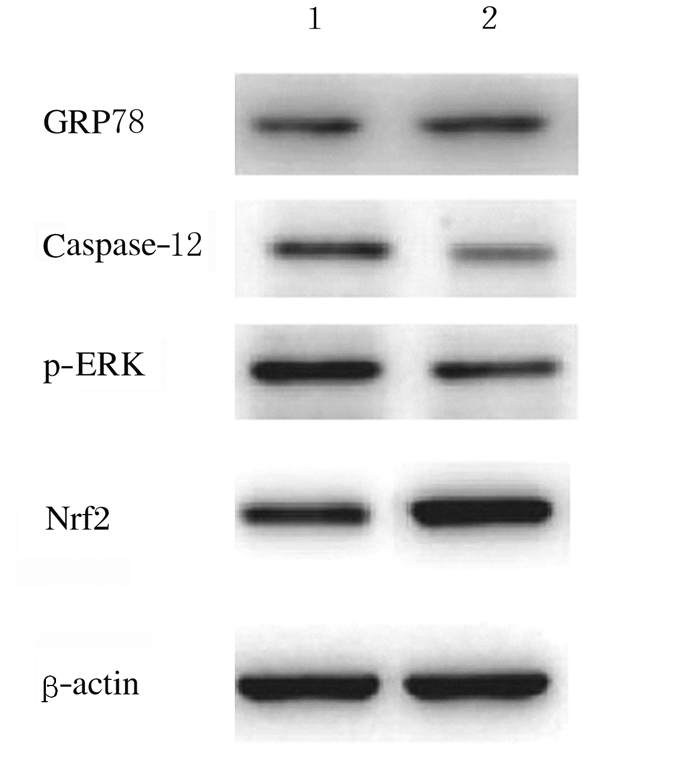
|
| Lane 1: Control group; Lane 2: Model group. 图 2 2组小鼠耳蜗毛细胞中GRP78、caspase-12、p-ERK和Nrf2蛋白表达电泳图 Fig. 2 Electrophoregram of GRP78, caspase-12, p-ERK and Nrf2 proteins in cochlear hair cells of mice in two groups |
|
|
糖尿病性耳聋主要的临床表现为耳蜗性和蜗后性耳聋,常伴有眩晕和神经功能减退等症状。糖尿病患者听力功能的改变,主要由于血糖和血脂增高引起内耳血液循环紊乱,使得耳蜗的毛细胞出现了脂滴沉积,引起了外毛细胞的缺失,导致缺血缺氧。本研究结果显示:与对照组比较,模型组小鼠空腹血糖水平明显增高,表明造模成功;从各组小鼠耳蜗外毛细胞缺失率的结果来看,耳蜗中外毛细胞的缺损主要集中在底回端,耳蜗中回和顶回的外毛细胞缺损则比较少,说明2型糖尿病会造成小鼠耳蜗的退化,可能是由于高血糖的状态下,会引起耳蜗外毛细胞的损伤,随着病情的持续发展会引起耳蜗的退化。
临床上糖尿病耳聋常用的检测方法是测定ABR阈值,对于诊断耳蜗后病变具有重要意义[15]。本研究ABR阈值测定结果显示:与对照组比较,模型组小鼠在8、12和24kHz各个频率的ABR阈值明显升高,说明2型糖尿病可以造成小鼠听力损伤。有研究[16]表明:OAE的产生与耳蜗Corti氏器外毛细胞的活动机制有密切关联,当耳蜗受损程度达中度以上时,畸变产物耳声发射(DPOAE)幅值和引出率明显异常,并发有蜗后病变。OAE联合ABR能区分感音性听力损失和神经性听力损失(蜗性和蜗后性听力损失),两者皆异常则说明既存在蜗性听力损失,又存在蜗后性听力损失。当暴露于听觉有害因素后,耳蜗外毛细胞的损伤先于行为听阈的改变,因此OAE的改变能早期发现耳蜗的损伤。本研究结果显示:在低频、中频和高频的刺激下,OAE阈值出现明显的变化,与对照组比较,模型组小鼠在低频刺激下OAE阈值变化不明显,在中频和高频的刺激下OAE阈值明显升高。
研究[17-18]表明:细胞凋亡与糖尿病的耳聋有密切关系,由于糖尿病发病过程中氧自由基生成过多,使线粒体受到破坏,进而激活了caspase, 导致细胞凋亡。体内持续的高血糖导致的氧化应激是诱发糖尿病性耳聋的关键性因素,研究[19]表明:Nrf2/ARE通路在糖尿病性耳聋方面发挥着重要的作用。机体在高糖环境下,内质网中的蛋白质会发生错误折叠,对细胞产生毒性作用,激活了机体的内质网凋亡途径,引起细胞凋亡。Nrf2是抗氧化酶链中的核心转录因子,长期的高糖状态下,由于糖基化产物(AGEs)不断聚积及硫氧环蛋白(Trx)的增多,导致活性氧簇(ROS)的大量产生,一方面抑制细胞内Trx等抗氧化因子的发生,另一方面激活细胞凋亡信号调节激酶1(ASK1)等介导的凋亡信号通路。p-ERK/Nrf2抗氧化信号通路介导糖尿病耳蜗毛细胞中的Trx表达上调,对糖尿病引起的耳蜗毛细胞的退行性变起到保护作用[20-21]。ERS通过作用于p-ERK/Nrf2通路,介导糖尿病耳蜗毛细胞中ERS的分子伴侣GRP78表达上调,从而促进caspase-12凋亡信号通路的激活,引起了糖尿病诱导的耳蜗毛细胞的退行性变。本研究结果显示:与对照组比较,2型糖尿病小鼠耳蜗毛细胞中p-ERK和Nrf2蛋白表达水平明显降低,ERS通路的GRP78和caspase-12蛋白表达水平明显升高,表明机体在高糖环境下,产生ERS,触发了小鼠耳蜗毛细胞的凋亡。
综上所述,2型糖尿病小鼠耳蜗毛细胞发生ERS,ERS能够引起糖尿病小鼠耳蜗外毛细胞缺损率升高,ABR脑干听力阈值升高,并降低p-ERK和Nrf2蛋白表达水平,ERS可促进2型糖尿病小鼠耳蜗毛细胞的退行性病变。
| [1] | INGELFINGER J R, JARCHO J A. Increase in the incidence of diabetes and its implications[J]. N Engl J Med, 2017, 376(15): 1473–1474. DOI:10.1056/NEJMe1616575 |
| [2] | 尹彦波, 袁雅生, 迟放鲁. 隐性听力下降小鼠耳蜗内毛细胞突触的病理改变[J]. 复旦学报:医学版, 2017, 44(2): 175–180. |
| [3] | 李丽, 杨家富, 黄成彬, 等. 伴有糖尿病的突发性耳聋52例临床分析[J]. 糖尿病新世界, 2015(19): 86–88. DOI:10.3969/j.issn.1672-4062.2015.19.033 |
| [4] | SHARLIN D S, NG L, VERREY F, et al. Deafness and loss of cochlear hair cells in the absence of thyroid hormone transporters Slc16a2(Mct8) and Slc16a10(Mct10)[J]. Sci Rep, 2018, 8(1): 4403. DOI:10.1038/s41598-018-22553-w |
| [5] | 黄国威, 吕萍, 于宁. 糖尿病性听力损失的特点及发生机制[J]. 听力学及言语疾病杂志, 2016, 24(6): 624–627. DOI:10.3969/j.issn.1006-7299.2016.06.022 |
| [6] | 李琦, 欧阳天斌. 伴与不伴2型糖尿病突发性聋听力受损情况及疗效的对比研究[J]. 中华耳科学杂志, 2009, 7(2): 176–177. DOI:10.3969/j.issn.1672-2922.2009.02.018 |
| [7] | 王军义, 夏源, 杨翠婵, 等. 体外培养耳蜗毛细胞氧化应激损伤的微小RNA调控网络分析[J]. 中华耳鼻咽喉头颈外科杂志, 2016, 51(10): 751–755. DOI:10.3760/cma.j.issn.1673-0860.2016.10.008 |
| [8] | HAMMES H P, FEDEROFF H J, BROWNLEE M. Nerve growth factor prevents both neuroretinal programmed cell death and capillary pathology in experimental diabetes[J]. Mol Med, 1995, 1(5): 527–534. DOI:10.1007/BF03401589 |
| [9] | 戴俏武, 徐绥宁, 王中群. 内质网应激介导的凋亡在糖尿病Apo E-/-小鼠内膜钙化中的作用[J]. 中国动脉硬化杂志, 2015, 23(11): 1093–1099. |
| [10] | 扶玉珍.萝卜硫素对2型糖尿病小鼠耳蜗毛细胞退行性变的保护作用及机制研究[D].大连: 大连医科大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10161-1015625334.htm |
| [11] | 郭云辉, 吕红梅, 陈凤江. 内质网应激的研究进展[J]. 中国保健营养, 2014, 24(7): 4399–4400. |
| [12] | BRECKENRIDGE D G, GERMAIN M, MATHAI J P, et al. Regulation of apoptosis by endoplasmic reticulum pathways[J]. Oncogene, 2003, 22(53): 8608–8618. DOI:10.1038/sj.onc.1207108 |
| [13] | ZHU M, GUO M, FEI L, et al. 4-Phenylbutyric acid attenuates endoplasmic reticulum stress-mediated pancreatic β-cell apoptosis in rats with streptozotocin-induced diabetes[J]. Endocrine, 2014, 47(1): 129–137. DOI:10.1007/s12020-013-0132-7 |
| [14] | ZHANG Q, LIU J, CHEN S, et al. Caspase-12 is involved in stretch-induced apoptosis mediated endoplasmic reticulum stress[J]. Apoptosis, 2016, 21(4): 432–442. DOI:10.1007/s10495-016-1217-6 |
| [15] | 陈雄, 林碧, 龚小花, 等. 新诊断2型糖尿病听力损害的特点及危险因素[J]. 广东医学, 2015, 34(16): 2523–2525. |
| [16] | QIAN Y, HARRIS E D, ZHENG Y, et al. Lead targets GRP78, a molecular chaperone, in C6 rat glioma cells[J]. Toxicol Appl Pharm, 2000, 163(3): 260–266. DOI:10.1006/taap.1999.8878 |
| [17] | 肖大江, 张永胜, 张玉海. 糖尿病大鼠畸变产物耳声发射的观察[J]. 中华耳鼻咽喉头颈外科杂志, 2006, 41(12): 924–927. DOI:10.3760/j.issn:1673-0860.2006.12.008 |
| [18] | MEI Y, THOMPSON M D, COHEN R A, et al. Endoplasmic reticulum stressand related pathological processes[J]. J Pharmacol Biomed Anal, 2013. DOI:10.4172/2327-4638.1000105 |
| [19] | LEE A S. The ER chaperone and signaling regulator GRP78/Bi P asa monitor of endoplasmic reticulum stress[J]. Methods, 2005, 35(4): 373–381. DOI:10.1016/j.ymeth.2004.10.010 |
| [20] | LEE J, OZCAN U. Unfolded protein response signaling and metabolic diseases[J]. J Biol Chem, 2014, 289(3): 1203–1211. DOI:10.1074/jbc.R113.534743 |
| [21] | 万爽, 王炳源, 任永成, 等. 腰身比、BMI、代谢异常组分及其组合与2型糖尿病关系的前瞻性巢式病例对照研究[J]. 郑州大学学报:医学版, 2017, 52(4): 478–483. |
 2019, Vol. 45
2019, Vol. 45


