扩展功能
文章信息
- 王睿斌, 赵艳杰, 宋清坤, 盛敏佳
- WANG Ruibin, ZHAO Yanjie, SONG Qingkun, SHENG Minjia
- 二甲双胍对糖尿病小鼠肝库普弗细胞炎症反应的抑制作用和吞噬功能的改善作用
- Inhibitory effect of metformin on inflammatory responseof Kupffer cells of liver in diabetic mice and its improvement on phagocytic function
- 吉林大学学报(医学版), 2019, 45(01): 39-44
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 39-44
- 10.13481/j.1671-587x.20190108
-
文章历史
- 收稿日期: 2018-06-27
2. 首都医科大学附属北京世纪坛医院肿瘤内科, 北京 100038;
3. 首都医科大学附属北京世纪坛医院科研处, 北京 100038;
4. 吉林大学中日联谊医院妇产科, 吉林 长春 130033
2. Department of Oncology, Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China;
3. Department of Scientific Research, Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China;
4. Department of Obstetris and Gynecology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
糖尿病是一种以高血糖为特征的慢性代谢疾病。根据2015年国际糖尿病联合会(IDF)的数据,全球糖尿病患者人数已达4.15亿,每年约500万人死于糖尿病[1]。中国的糖尿病发病率高于世界平均水平,全世界四分之一的糖尿病患者在中国[2]。有研究[3]显示:糖尿病患者并发细菌性肝脓肿的危险比无糖尿病者增加3.6倍。糖尿病患者易发生感染的原因包括对感染的遗传易感性、细胞和体液免疫防御机制的改变、局部血液供应不足和神经损伤以及与糖尿病有关的代谢改变[4]。肝库普弗细胞(Kupffer cells,KCs)是位于肝窦中的巨噬细胞。肝KCs作为肝脏抵抗胃肠道细菌的第一道屏障,在抗感染中发挥重要作用,但糖尿病患者的肝KCs处于功能减低状态[5]。全身低度炎症反应状态并有大量炎症介质激活是糖尿病已知的病理特征[6],而且高血糖导致巨噬细胞遭受缺氧应激,可能导致其损伤[7-9]。因此,肝KCs功能障碍可能是糖尿病患者易发肝脓肿的原因之一。二甲双胍不仅是常用的口服降糖药物,而且还具有抗肿瘤[10]和抗炎作用[11]。二甲双胍主要通过作用于AMPK-NF-κB信号通路抑制炎症介质释放达到抗炎作用[12]。为探讨二甲双胍对糖尿病肝KCs的保护作用,本研究应用二甲双胍作用于体外培养的糖尿病小鼠肝KCs,观察二甲双胍对其炎症反应的抑制作用及对其吞噬功能的改善情况。
1 材料与方法 1.1 实验动物及主要试剂SPF级C57BLKS/J db/db小鼠和C57BLKS/J db/m小鼠各16只,8周龄,雌性,体质量20~25g,购于常州卡文斯实验动物有限公司,动物许可证号:SCXK(苏)2016-0010。二甲双胍购自中美上海施贵宝制药有限公司(批号:20170841)。胎牛血清(FBS)、DMEM培养基、1640培养基、ICAM-1单克隆抗体和白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、γ干扰素(INF-γ)检测试剂盒均购自赛默飞世尔科技(中国)有限公司(批号分别为A3161001、10564011、61870036、MA5405、BMS603HS、BMS607-3和PMC4016)。PVDF膜购自上海源叶生物科技有限公司(批号:H22092),聚苯乙烯乳珠购自上海倍卓生物科技有限公司(批号:9003-53-6)。
1.2 实验动物分组和给药将C57BLKS/J db/db小鼠分为糖尿病组和糖尿病加二甲双胍组,将C57BLKS/J db/m小鼠分为非糖尿病组和非糖尿病+二甲双胍组,每组8只。二甲双胍干预组小鼠给予二甲双胍(500 mg·kg-1·d-1)连续灌胃1周。1周后检测各组小鼠空腹血糖水平,然后处死各组小鼠迅速无菌取出股骨和胫骨及肝脏。
1.3 小鼠肝KCs及中性粒细胞分离培养将肝组织剪碎,大小约1mm×1mm×1mm,加入0.1%Ⅳ型胶原酶37℃消化40 min,将消化液过滤离心后用完全培养基(DMEM+10%FBS+1%P/S)重悬。沿离心管壁依次缓慢加入3mL 70% Percoll、3mL 30% Percoll和2mL上述离心重悬液,400g离心20 min,30%与70% Percoll界面有薄层,吸管吸出薄层,完全培养基重悬,300g、5 min离心2次,铺瓶,置于37℃,5%CO2培养箱。4h后除去细胞上清液,PBS洗1次,除去未贴壁的细胞,贴壁细胞为KCs。
取小鼠股骨和胫骨剪去两端软骨,露出红色的骨髓腔,取1mL的无菌注射器,吸取少量的含有10%标准胎牛血清的稀释液或者是含有血清的培养基,冲洗骨髓腔以获得骨髓。最终制成2×108~1×109mL-1的单细胞悬液备用。在离心管中加入适量分离液将细胞悬液平铺到分离液液面上方,离心后将出现明显的分层:分离液中为粒细胞层。细胞用完全培养基(1640培养基+10%FBS+1%P/S)重悬,铺瓶。
1.4 透射电镜观察KCs的超微结构将小鼠肝组织转移至含有2.5%戊二醛溶液的EP管中,固定约1h,然后转移至1mol·L-1磷酸盐缓冲液中并洗涤3次,每次5 min。1%锇酸固定30 min后,用0.1 mol·L-1磷酸盐缓冲液洗涤2次。用3%~4%琼脂预包埋,在琼脂固化后,将含有肝组织的琼脂切成约1mm×1mm×1mm的小块。固定后,加入50%、70%及90%乙醇溶液和90%、10%丙酮脱水。环氧树脂浸渍,包埋,聚合,超薄切片,在FEI Tecnai G212透射电镜下观察KCs超微结构。
1.5 ELISA法定量检测KCs中IL-6、TNF-α和INF-γ水平用纯化的抗体包被微孔板,制成固相抗体,往包被有固相抗体的微孔中一次加入标准品或受检样品、生物素化的IL-6、TNF-α、INF-γ抗体和HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅与样品中IL-6、TNF-α、INF-γ水平呈正相关关系。用酶标仪在(450±2)nm波长下测定吸光度(A)值,计算样品中IL-6、TNF-α和INF-γ水平。
1.6 Western blotting法检测KCs中ICAM-1表达水平收集KCs,使用包含蛋白酶抑制剂的RIPA裂解缓冲液进行细胞裂解。提取的蛋白质通过二辛可宁酸定量分析。将样品加到SDS-PAGE凝胶的加样孔内,并转移到PVDF膜上。用5%脱脂牛奶将膜封闭2h,然后在37℃下与一抗温育过夜。用TBS-T洗涤3次,每次10 min,将膜与合适的HRP缀合的二抗在室温下孵育1.5h。将膜正面朝上放到免疫印迹仪内,拍照、记录结果。对电泳条带进行灰度值扫描,对目的蛋白进行半定量分析。以目的条带与内参照的A值的比值表示目的蛋白的相对表达水平。
1.7 Transwell小室法检测KCs的中性粒细胞趋化能力取孔径为8.0μm 24孔PC膜Transwell小室,每份中性粒细胞悬液做2个小室。在下室加入细胞密度为2×105mL-1的各组KCs悬液500 μL,待细胞汇合度达80%后弃去上清,加入细胞完全培养基(DMEM+10%FBS+1%PS)500μL,上室加入细胞密度为2×105mL-1中性粒细胞悬液200 μL,于37℃、5%CO2、饱和湿度条件下培养2h,弃去上室液体,PBS洗涤2次,用棉签擦去上室膜上未趋化细胞,移去小室,倒置,风干,在下室加入0.1%结晶紫染液500 μL,将小室浸没在染液中,37℃孵育30 min,弃去结晶紫染液,用PBS洗涤2次,随机取5个视野,计数中性粒细胞,代表其趋化能力。
1.8 倒置显微镜下观察KCs吞噬能力取接种于盖玻片的KCs,每皿中加入1×108个聚苯乙烯乳珠,培养60 min后,盖玻片用PBS漂洗3次,4%多聚甲醛固定30 min,Giemsa染色,倒置显微镜下观察肝KCs吞噬聚苯乙烯乳珠情况并计数。每片随机取5个视野,每个视野随机取10个肝KCs进行计数,KCs吞噬聚苯乙烯乳珠数的平均值代表该皿肝KCs的吞噬功能。
1.9 统计学分析采用GraphPad Prism 7.0软件进行统计学分析。各组小鼠血糖水平以x±s表示,组间比较采用单因素方差分析。小鼠肝KCs中IL-6、TNF-α、INF-γ水平和ICAM-1表达水平,KCs的中性粒细胞趋化能力,KCs吞噬能力,均以中位数表示,采用威尔科克森符号秩检验与邦费罗尼校正进行两两比较。所有检验均为双侧检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠空腹血糖水平与非糖尿病组比较,糖尿病组小鼠空腹血糖水平明显升高(P < 0.05);与非糖尿病加二甲双胍组比较,糖尿病加二甲双胍组小鼠空腹血糖明显升高(P < 0.05)。与糖尿病组比较,糖尿病加二甲双胍组小鼠空腹血糖水平明显降低(P < 0.05)。见表 1。
| [n=8, x±s,cB/(mmol·L-1)] | |
| Group | Fasting glucose |
| Non-diabetes | 7.7±0.7 |
| Diabetes | 23.1±1.8* |
| Non-diabetes + metformin | 6.7±0.9 |
| Diabetes+metformin | 11.2±1.3△# |
| *P < 0.05 compared with non-diabetes group; △P < 0.05 compared with non-diabetes+metformin group; #P < 0.05 compared with diabetes group. | |
与非糖尿病组小鼠比较,糖尿病组小鼠KCs中线粒体和RER数量减少,核呈椭圆形或肾形,偶可见核膜断裂,溶酶体稍有减少,并可见RER扩张、线粒体肿胀及脂滴增多。见图 1。

|
| 图 1 非糖尿病组(A)和糖尿病组(B)小鼠KCs超微结构(TEM,×5 000) Fig. 1 Ultrastructures of KCs of mice in non-diabetes group (A) and diabetes group(B) (TEM, ×5 000) |
|
|
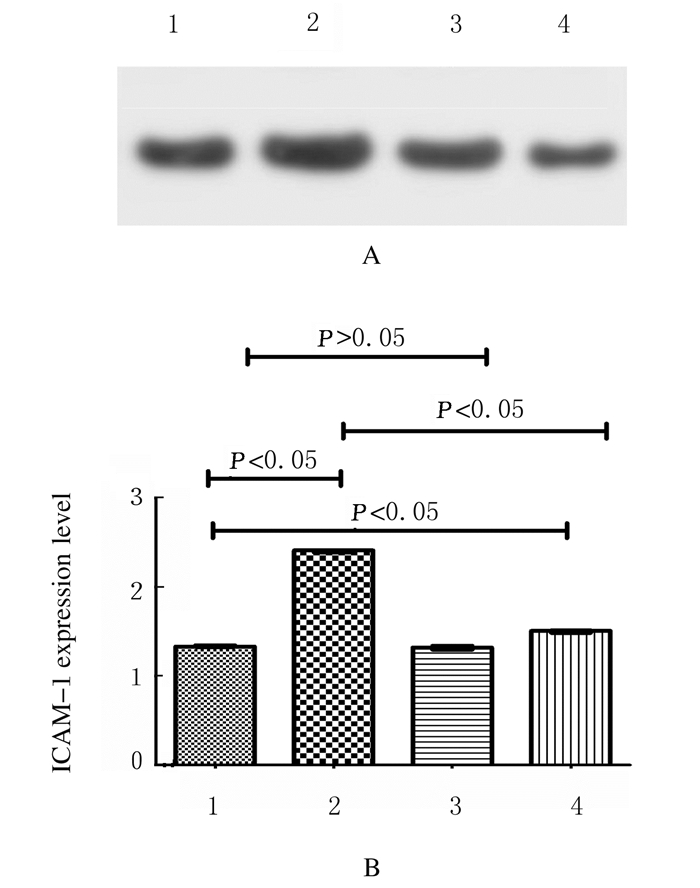
与非糖尿病组比较,糖尿病组小鼠KCs中IL-6、TNF-α和INF-γ水平和ICAM-1表达水平明显升高(P < 0.05),糖尿病加二甲双胍组小鼠KCs中IL-6、TNF-α、INF-γ水平和ICAM-1表达水平明显降低(P < 0.05)。非糖尿病组与非糖尿病加二甲双胍组上述指标比较差异无统计学意义(P > 0.05)。见图 2和3。

|
| 1: Non-diabetes group; 2: Diabetes group; 3: Non-diabetes+metformin group; 4: Diabetes+metformin group. 图 2 各组小鼠KCs中IL-6(A)、TNF-α(B)和INF-γ(C)水平 Fig. 2 Levels of IL-6(A), TNF-α(B), and INF-γ(C) in KCs of mice in various groups |
|
|
|
| Lane 1: Non-diabetes group; Lane 2: Diabetes group; Lane 3: Non-diabetes+metformin group; Lane 4: Diabetes+metformin group. 1: Non-diabetes group; 2: Diabetes group; 3: Non-diabetes+metformin group; 4: Diabetes+metformin group. 图 3 Western blotting法检测各组小鼠KCs中ICAM-1表达电泳图(A)和直条图(B) Fig. 3 Electrophoregram(A)and histogram(B) of expressions of ICAM-1 in KCs of mice in various groups detected by Western blotting method |
|
|
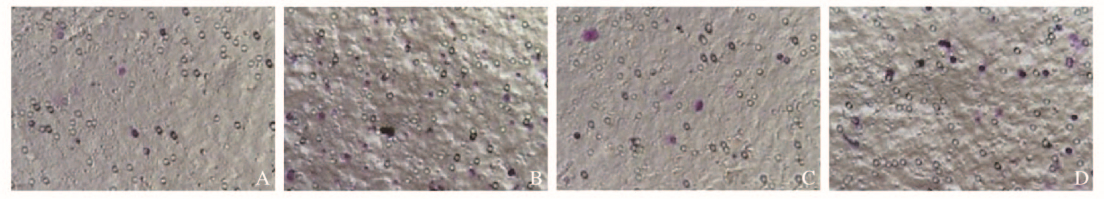
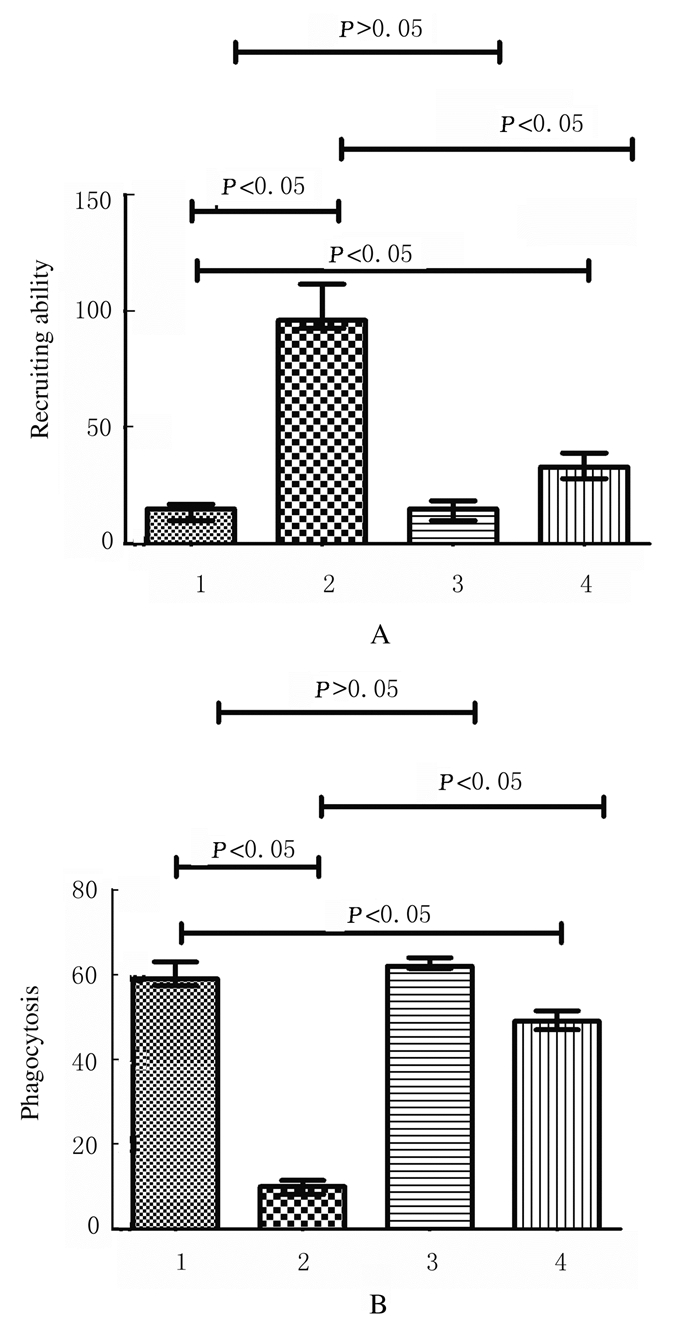
与非糖尿病组比较,糖尿病组小鼠中性粒细胞趋化能力明显增强(P < 0.05);与糖尿病组比较,糖尿病加二甲双胍组小鼠KCs的中性粒细胞趋化能力明显减弱(P < 0.05)。与非糖尿病组比较,糖尿病组小鼠KCs吞噬能力明显减弱(P < 0.05);与糖尿病对照组比较,糖尿病加二甲双胍组小鼠KCs吞噬能力明显增强(P < 0.05)。见图 4、5(插页二)和图 6。
|
| A: Non-diabetes group; B: Diabetes group; C: Non-diabetes + metformin group; D: Diabetes + metformin group. 图 4 结晶紫染色观察各组小鼠KCs的中性粒细胞趋化能力(×100) Fig. 4 Recruiting abilities of neutrophils in KCs of mice in various groups observed by crystal violet staining(×100) |
|
|

|
| A: Non-diabetes group; B: Diabetes group; C: Non-diabetes + metformin group; D: Diabetes+metformin group. 图 5 Giemsa染色观察各组小鼠KCs的吞噬能力(×100) Fig. 5 Phagocytosis of KCs in mice in various groups detected by Giemsa staining (×100) |
|
|
|
| 1: Non-diabetes group; 2: Diabetes group; 3: Non-diabetes+metformin group; 4: Diabetes+metformin group. 图 6 各组小鼠KCs的中性粒细胞趋化能力(A)和吞噬能力(B)直条图 Fig. 6 Histogram of neutrophil chemotaxis abilities (A) and phagocytic abilities (B) of KCs of mice in various groups |
|
|
糖尿病影响着全球2.84亿成年人的健康,而且患病率仍在不断的增加[13]。以慢性高血糖为特征的代谢紊乱不仅会导致糖尿病慢性并发症,如糖尿病肾病、糖尿病微血管病和糖尿病神经病等;由于高血糖有利于细菌生长,且血糖控制欠佳时可致免疫力低下,故也导致感染性疾病高发[5]。除了糖尿病患者的免疫功能障碍,还有糖尿病性神经病和循环不良,都使其处于典型和非典型感染的高风险中[14]。糖尿病患者肝脓肿发生率明显高于正常人群,而且化脓性肝脓肿(PLA)患者中35.3%为糖尿病患者[15]。肝窦细胞,特别是肝窦内皮细胞和肝KCs,在肝脏抵抗细菌和病毒入侵中起重要作用[16]。细菌进入血液后,通过门静脉输送到肝脏,在肝窦遇到肝脏的巨噬细胞防御系统[17]。因此,肝KCs的功能改变可能是糖尿病患者易患PLA的原因之一。本文作者通过透射电镜观察正常小鼠和糖尿病小鼠的肝KCs超微结构的差异发现:糖尿病小鼠肝KCs中的线粒体、溶酶体和RER数量较少,表明其吞噬能力下降,且伴有RER扩张、线粒体肿胀和脂滴增多,提示肝KCs在此环境下衰老过程加速。
病理状态下肝KCs可被内毒素和肿瘤坏死因子(TNF)等激活,释放TNF-α、转化生长因子(TGF)、干扰素(IFN)、白细胞介素(IL)、无氧自由基(OFR)和一氧化氮(NO)等炎症介质[16]; 在静息状态下,细胞表面的ICAM-1通常以低水平表达,但ICAM-1的表达可通过炎性介质的刺激迅速上调[18]。本研究结果显示:糖尿病组较非糖尿病组小鼠KCs中IL-6、TNF-α、INF-γ水平和ICAM-1表达水平明显升高,表明糖尿病小鼠KCs处于激活状态。该结果也与糖尿病是一种全身炎症性疾病的普遍认知相符。研究[19-20]表明:糖尿病患者具有全身多种组织的慢性炎症,该反应与经典炎症不同,也许可以被认为是由于营养素代谢异常或其他内在因素引发的免疫异常。还有研究[21]证实:转录因子(NF) -κB在糖尿病的发展中发挥重要作用,从而进一步明确炎症在发病过程中的关键作用。本研究结果显示:糖尿病组小鼠中性粒细胞趋化能力明显增强,但糖尿病组小鼠肝KCs吞噬能力明显减弱。虽然糖尿病小鼠的肝KCs被激活并可招募大量的粒细胞,但是其肝KCs本身处于功能失调状态,其吞噬能力明显低于非糖尿病小鼠。此前也有研究[5, 7, 9]证实:糖尿病患者巨噬细胞的功能处于抑制状态。
二甲双胍作为2型糖尿病治疗的一线首选用药,其除降低血糖作用外,还具有明显的抗炎作用。有研究[12]证实:二甲双胍通过激活腺苷酸活化蛋白激酶(AMPK)进而抑制NF-κB活性来抑制细胞因子诱导的促炎和黏附分子基因的表达。二甲双胍不仅能降低巨噬细胞炎症因子(TNF-α、IL-1β和IL-6)的分泌,还能增加抗炎因子IL-10的合成。本研究结果显示:糖尿病组小鼠给予二甲双胍后IL-6、TNF-α、INF-γ水平和ICAM-1表达水平明显降低,中性粒细胞趋化能力明显减弱,证实糖尿病小鼠肝KCs炎症反应被抑制;二甲双胍还可使糖尿病小鼠肝KCs吞噬功能明显增强,提示二甲双胍可通过改善KCs功能对其起到保护作用。
综上所述,二甲双胍通过抑制糖尿病小鼠肝KCs炎症反应,对肝KCs起到了保护作用。本研究结果为糖尿病并发肝脓肿提供了一种可选的辅助治疗方案。
| [1] | IDF. Diabetes:A global emergency[M]. 7 th ed. Belgium: International Diabetes Federation, 2015: 11-13. |
| [2] | NCD Risk Factor Collaboration (NCD-RisC)-Africa Working Group. Worldwide trends in diabetes since 1980:a pooled analysis of 751 population-based studies with 4.4 million participants[J]. Lancet, 2016, 387(10027): 1513–1530. |
| [3] | 李小刚, 杨志, 黄忠明, 等. 合并与非合并糖尿病性细菌性肝脓肿的临床比较[J]. 中国老年学杂志, 2014, 34(16): 4685–4687. DOI:10.3969/j.issn.1005-9202.2014.16.133 |
| [4] | ATREJA A, KALRA S. Infections in diabetes[J]. J Pak Med Assoc, 2015, 65(9): 1028–1030. |
| [5] | KNAPP S. Diabetes and infection:is there a link?-A mini-review[J]. Gerontology, 2013, 59(2): 99–104. |
| [6] | HOTAMISLIGIL G S. Inflammation, metaflammation and immunometabolic-disorders[J]. Nature, 2017, 542(7640): 177–185. DOI:10.1038/nature21363 |
| [7] | KANETO H, KATAKAMI N, MATSUHISA M, et al. Role of reactive oxygen species in the progression of type 2 diabetes and atherosclerosis[J]. Mediators Inflamm, 2010, 2010: 453892. |
| [8] | DASU MR, DEVARAJ S, ZHAO L, et al. High glucose induces toll-like receptor expression in human monocytes:mechanism of activation[J]. Diabetes, 2008, 57(11): 3090–3098. |
| [9] | TABET F, LAMBERT G, CUESTA TORRES L F, et al. Lipid-free apolipoprotein A-I and discoidal reconstituted high-density lipoproteins differentially inhibit glucose-induced oxidative stress in human macrophages[J]. Arterioscler Thromb Vasc Biol, 2011, 31(5): 1192–1200. DOI:10.1161/ATVBAHA.110.222000 |
| [10] | QUINN B J, KITAGAWA H, MEMMOTT R M, et al. Repositioning metformin for cancer prevention and treatment[J]. Trends Endocrinol Metab, 2013, 24(9): 469–480. |
| [11] | ISODA K, YOUNG J L, ZIRLIK A, et al. Metformin inhibits proinflammatory responses and nuclear factor-kappaB in human vascular wall cells[J]. Arterioscler Thromb Vasc Biol, 2006, 26(3): 611–617. DOI:10.1161/01.ATV.0000201938.78044.75 |
| [12] | HATTORI Y, SUZUKI K, HATTORI S, et al. Metformin inhibits cytokine-induced nuclear factor kappaB activation via AMP-activated protein kinase activation in vascular endothelial cells[J]. Hypertension, 2006, 47(6): 1183–1188. |
| [13] | SHAW J E, SICREE R A, ZIMMET P Z. Global estimates of the prevalence of diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract, 2010, 87(1): 4–14. |
| [14] | DRYDEN M, BAGUNEID M, ECKMANN C, et al. Pathophysiology and burden of infection in patients with diabetes mellitus and peripheral vascular disease:focus on skin and soft-tissue infections[J]. Clin Microbiol Infect, 2015, 21(Suppl 2): S27–32. |
| [15] | CHEN Y C, LIN C H, CHANG S N, et al. Epidemiology and clinical outcome of pyogenic liver abscess:an analysis from the National Health Insurance Research Database of Taiwan, 2000-2011[J]. J Microbiol Immunol Infect, 2016, 49(5): 646–653. |
| [16] | WOHLLEBER D, KNOLLE P A. The role of liver sinusoidal cells in local hepatic immune surveillance[J]. Clin Transl Immunol, 2016, 5(12): e117. |
| [17] | WANG X L, YANG C Y, ZHANG Z, et al. Ultramicrostructural study of pathological changes of capillary vessels in pulp tissues of diabetes mellitus patients[J]. Shanghai Kou Qiang Yi Xue, 2012, 21(5): 506–510. |
| [18] | DUSTIN M L, ROTHLEIN R, BHAN A K, et al. Induction by IL-1 and interferon-γ:tissue distribution, biochemistry, and function of a natural adherence molecule (ICAM-1)[J]. J Immunol, 2011, 186(9): 5024–5033. |
| [19] | GALASSETTI P. Inflammation and oxidative stress in obesity, metabolic syndrome, and diabetes[J]. Exp Diabetes Res, 2012, 2012: 943706. |
| [20] | ESSER N, LEGRAND-POELS S, PIETTE J, et al. Inflammation as a link between obesity, metabolic syndrome and type 2 diabetes[J]. Diabetes Res Clin Pract, 2014, 105(2): 141–150. |
| [21] | KAUPPINEN A, SUURONEN T, OJALA J, et al. Antagonistic crosstalk between NF-κB and SIRT1 in the regulation of inflammation and metabolic disorders[J]. Cell Signal, 2013, 25(10): 1939–1948. |
 2019, Vol. 45
2019, Vol. 45


