扩展功能
文章信息
- 王秀艳, 樊晨星, 赵千, 王博, 袁松, 李昆
- WANG Xiuyan, FAN Chenxing, ZHAO Qian, WANG Bo, YUAN Song, LI Kun
- 丹参酮ⅡA对人胎盘间充质干细胞向心肌细胞分化的诱导作用及其机制
- Induction of tanshinone ⅡA on differentiation of human placenta-derived mesenchymal stem cells into cardiomyocytes and its mechanism
- 吉林大学学报(医学版), 2019, 45(01): 33-38
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 33-38
- 10.13481/j.1671-587x.20190107
-
文章历史
- 收稿日期: 2018-05-30
缺血性心脏病是最常见的心血管系统疾病,其发病率和死亡率逐年增加,并呈年轻化趋势,对人类的健康造成了严重的威胁[1]。成熟的心肌细胞缺乏再生能力,心肌缺血会造成心肌细胞不可逆损伤,于损伤处形成瘢痕,严重影响心功能[2]。目前,药物治疗、介入治疗和外科搭桥等传统治疗方法虽能改善心肌缺血症状,但不能弥补丢失的心肌细胞,部分患者最终发展为心力衰竭,甚至死亡[3-4]。近年来,干细胞移植已逐渐成为心血管系统疾病治疗中的研究热点。目前,心肌再生研究常用的干细胞主要是骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),但心血管疾病在中老年人中发病率较高,而这些患者骨髓中BMSCs数量极少,限制了BMSCs在缺血性心脏病中的临床应用。人胎盘间充质干细胞(human placenta-derived mesenchymal stem cells,hPDMSCs)由于来源广泛、免疫原性较低,且能够体外大量扩增[5-7]而成为理想的可替代细胞。丹参酮ⅡA(TanⅡA)作为丹参的重要单体成分,临床上常用于缺血性心脏病的治疗。本研究采用TanⅡA干预hPDMSCs,观察其对hPDMSCs向心肌细胞分化的影响,探讨其相关作用机制,以期寻找高效低毒的心肌细胞分化诱导剂。
1 材料与方法 1.1 材料TanⅡA粉末(20mg,纯度≥98%),购于上海江莱生物科技有限公司,用二甲基亚砜(DMSO)配成贮存液,-20℃冰箱保存,实验时用低糖DMEM培养基稀释成目的浓度。胎牛血清、低糖DMEM培养基和青、链霉素购于美国Gibco公司,抗CD13、抗CD73、抗CD90、抗CD166、抗HLA-DR、抗CD14、抗CD29、抗CD31、抗CD44、抗CD45、抗CD105和抗HLA-ABC抗体均购于美国BD Biosciences公司,抗α-横纹肌肌动蛋白(α-sarcomeric actin,α-SCA)、抗心肌转录调节因子4(GATA-binding protein 4,GATA4)、抗心钠素(atrial natriuretic factor,ANF)、抗心肌肌钙蛋白I(cardiac troponin I,cTnI)、抗糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)和抗β-连环蛋白(β-catenin)抗体均购于美国Abcam公司。SDS-PAGE凝胶试剂盒购于北京鼎国昌盛生物技术有限责任公司。
1.2 hPDMSCs的分离和鉴定采用组织分离细胞培养方法获得hPDMSCs[8],37℃、5%CO2孵育箱中培养,每2d换液1次,取第3~4代细胞用于实验。细胞长满培养皿后用0.25%胰蛋白酶-EDTA消化处理,PBS洗涤2次,加预稀释的PE标记的鼠抗人的CD13、CD73、CD90、CD166、HLA-DR抗体和FITC标记的鼠抗人CD14、CD29、CD31、CD44、CD45、CD105和HLA-ABC抗体于冰上避光孵育20 min,再加入400μL PBS重悬细胞,设置空白对照组,采用流式细胞术检测细胞抗原的表达。空白对照组各抗原表达均为阴性,通过与空白对照组的比较确定细胞抗原的表达。
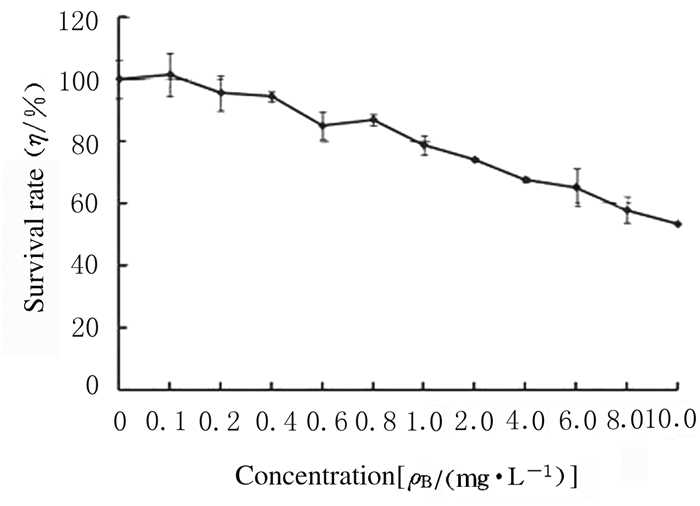
1.3 MTT法检测hPDMSCs增殖活性用低糖DMEM培养基将TanⅡA稀释成不同浓度(0.1、0.2、0.4、0.6、0.8、1.0、2.0、4.0、6.0、8.0和10.0 mg·L-1),取对数生长期hPDMSCs,调整细胞密度为1×104mL-1,按100μL/孔铺于96孔板中,分别用不同浓度TanⅡA处理细胞,4d后MTT法检测hPDMSCs存活率。MTT法检测结果显示:TanⅡA < 0.1 mg·L-1时对细胞的生长无明显影响。为了更好地评估TanⅡA对hPDMSCs分化的影响,选用0.1 mg·L-1的TanⅡA进行实验。将hPDMSCs以6×103 mL-1密度接种于96孔板内,分为对照组、5-氮胞苷(5-aza)诱导组和TanⅡA诱导组,对照组加等量的培养基,5-aza诱导组加10μmol·L-1的5-aza,TanⅡA诱导组加0.1 mg·L-1的TanⅡA,其中5-aza诱导组在诱导24h后弃去培养液,换为10%低糖DMEM培养基,各组细胞4d换液1次,培养20 d终止实验,MTT法检测各组细胞吸光度(A)值,代表细胞增殖活性。
1.4 免疫组织化学法检测细胞中α-SCA的表达于培养20d后收集各组细胞,在4%多聚甲醛中室温固定20 min,PBS洗涤3次,用0.2%Triton X-100透化细胞10 min,在血清中室温封闭5 min,加入抗α-SCA抗体(1:100稀释)4℃孵育过夜。PBS充分洗涤,加入HRP标记的山羊抗兔IgG抗体(1:100稀释)室温孵育1h,PBS充分洗涤,苏木精染核。普通光学显微镜下分析染色结果,观察α-SCA染色呈阳性的细胞数量。
1.5 免疫荧光法检测心肌细胞分化率各组细胞于培养20d后收集,在4%多聚甲醛中室温固定30 min,PBS洗涤3次,用0.2% Triton X-100透化细胞10 min,PBS洗涤3次,在无血清封闭液中室温封闭5 min,加入抗cTnI抗体(1:50稀释)4℃孵育过夜,PBS充分洗涤,加入FITC标记的山羊抗兔IgG抗体(1:50稀释)室温孵育1h,PBS充分洗涤,DAPI染核10 min。荧光显微镜下计数中央及四周5个视野的cTnI阳性表达细胞,取平均值。心肌细胞分化率=cTnI阳性表达细胞数/视野下总的细胞数×100%[9]。
1.6 Westernblotting法检测各组细胞中GATA4、ANF、cTnI、GSK-3β和β-catenin蛋白表达水平各组细胞于培养20d后收集,PBS洗涤2次,冰上裂解30 min,12000r·min-1、4℃离心25 min后提取总蛋白,测定相应蛋白浓度并稀释至相同终浓度。取等量蛋白经SDS-PAGE电泳、转膜,封闭1h,加入抗GAPDH、抗GATA4、抗ANF、抗cTnI、抗GSK-3β和抗β-catenin抗体,4℃摇床过夜,加入HRP标记的二抗室温孵育1h。用增强的化学发光检测试剂盒显色,自动电泳凝胶成像分析仪采集图像,以目的蛋白与GAPDH条带A值的比值表示目的蛋白表达水平。
1.7 统计学分析采用SPSS16.0统计软件进行统计学分析。各组细胞中GATA4、ANF、cTnI、GSK-3β和β-catenin蛋白表达水平符合正态分布,均以x±s表示,2组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
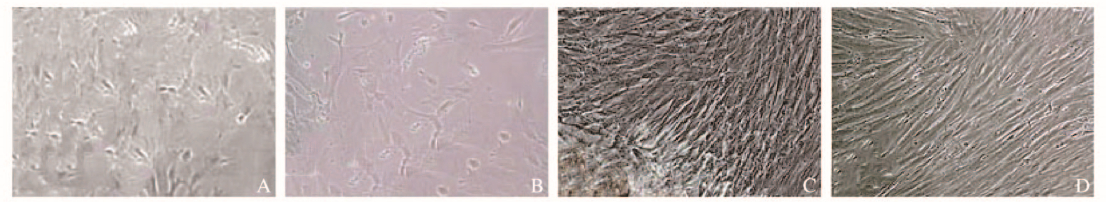
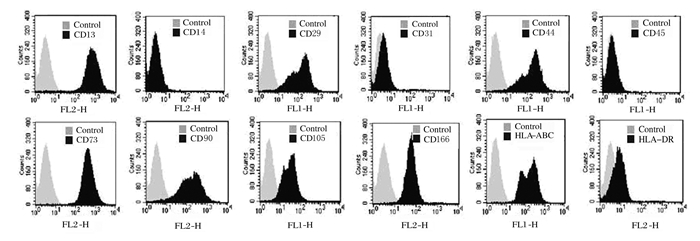
2 结果 2.1 hPDMSCs的生物学特性培养3 d时,有少量短梭形细胞沿组织块周边爬出;5d时,短梭形细胞有所增多;随着细胞缓慢生长,逐渐长成长梭形,类似成纤维细胞,并形成集落;培养至20d左右,细胞已达到80%~90%融合;传代后细胞又重新长成成纤维状细胞并形成集落(图 1,见插页二)。流式细胞术检测结果显示:人胎盘来源细胞的CD13、CD29、CD44、CD73、CD90、CD105、CD166和HLA-ABC表达阳性,而CD14、CD31、CD45和HLA-DR表达阴性(图 2),与之前报道过的骨髓和脐血来源的间充质干细胞抗原表达相同[10]。
|
| A:Primary culture for 3 d; B:Primary culture for 5 d; C:Primary culture for 20 d; D:Second generation. 图 1 培养不同时间hPDMSCs的形态表现(×100) Fig. 1 Morphology of hPDMSCs cultured for different time(×100) |
|
|
|
| 图 2 hPDMSCs的流式细胞术检测结果 Fig. 2 Detection results of flow cytometry of hPDMSCs |
|
|
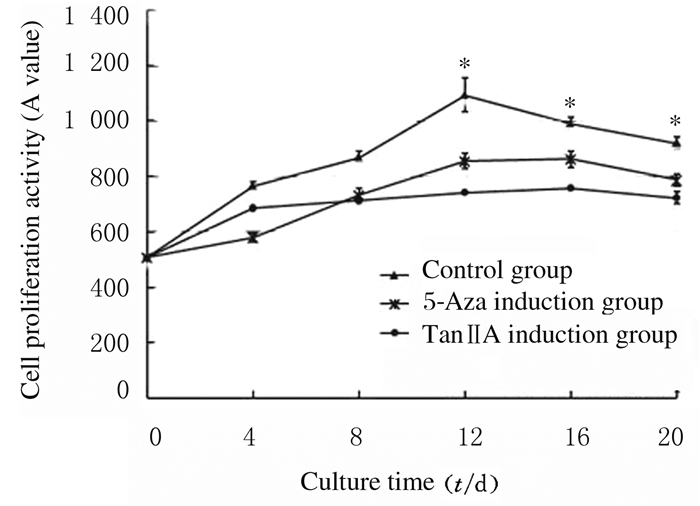
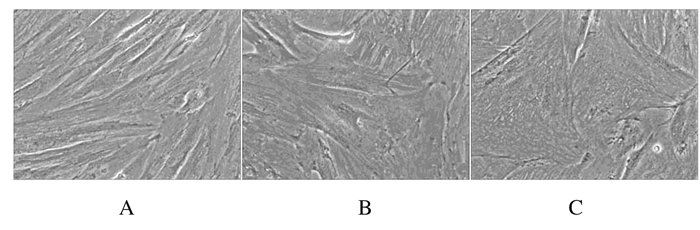
MTT结果显示:TanⅡA < 0.1 mg·L-1时对细胞的生长无明显影响(图 3)。为更好地评估TanⅡA对hPDMSCs分化的影响,选用0.1 mg·L-1的TanⅡA进行实验。对照组细胞在培养12d前保持较快的增长速度并保持成纤维细胞样形态,培养12d后由于细胞密度增大,细胞出现接触性抑制,细胞增殖活性降低。与对照组比较,5-aza诱导组和TanⅡA诱导组细胞增殖活性明显降低(P < 0.05)(图 4)。5-aza诱导组和TanⅡA诱导组细胞以较慢的速度生长,有些细胞形态开始出现变化,逐渐增大形成棒状外观,在培养20 d时,细胞间出现很多连接细胞的分支,以TanⅡA诱导组效果最明显(图 5)。
|
| 图 3 MTT法检测细胞存活率 Fig. 3 Survival rates of cells detected by MTT method |
|
|
|
| *P < 0.05 compared with control group. 图 4 各组细胞增殖活性 Fig. 4 Cell proliferation activities in various groups |
|
|
|
| A:Control group; B:5-Aza induction group; C:TanⅡA induction group. 图 5 各组hPDMSCs形态表现(×200) Fig. 5 Morphology of hPDMSCs in various groups(×200) |
|
|
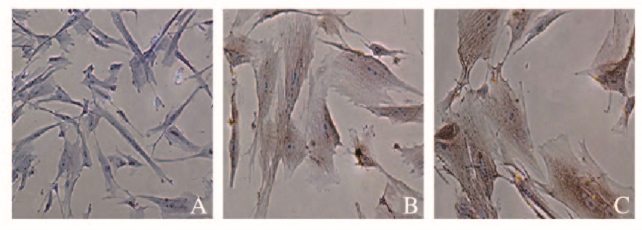
免疫组织化学结果显示:对照组细胞不表达α-SCA,5-aza诱导组和TanⅡA诱导组细胞均表达α-SCA,但以TanⅡA诱导组效果更明显(图 6,见插页二)。
|
| A:Control group; B:5-Aza induction group; C:Tan ⅡAinduction group. 图 6 免疫组织化学染色检测各组细胞中α-SCA的表达(×200) Fig. 6 Expression of α-SCAin cells in various groups detected by immunohistochemstry staining(×200) |
|
|
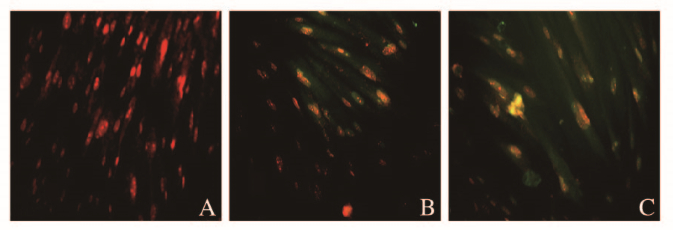
免疫荧光检测结果显示:对照组细胞不表达cTnI,5-aza诱导组和TanⅡA诱导组细胞cTnI表达阳性,但以TanⅡA诱导组效果更明显(图 7,见插页二)。各组心肌细胞分化率:对照组为0,5-aza诱导组为23%,TanⅡA诱导组为30%,TanⅡA诱导组心肌细胞分化率高于对照组和5-aza诱导组。
|
| A:Control group; B:5-Aza induction group; C:TanⅡA induction group. 图 7 免疫荧光染色检测各组细胞中cTnI的表达(×200) Fig. 7 Expressions of cTnI in cells in various groups detected by immunofluorescence staining(×200) |
|
|
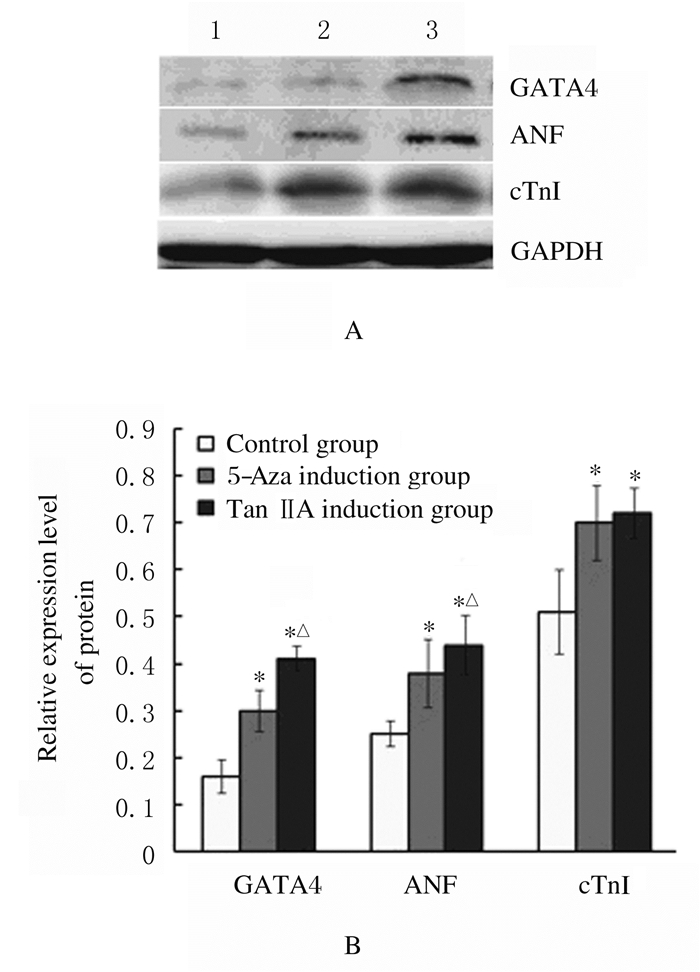
与对照组比较,5-aza诱导组和TanⅡA诱导组细胞中GATA4、ANF和cTnI蛋白表达水平均明显升高(P < 0.05);与5-aza诱导组比较,TanⅡA诱导组GATA4和ANF表达水平进一步升高(P < 0.05),cTnI蛋白表达水平差异无统计学意义(P > 0.05)。见图 8。
|
| Lane1:Control group; Lane2:5-Aza induction group; Lane3:TanⅡA induction group.*P < 0.05 compared with control group; △P < 0.05 compared with 5-aza induction group. 图 8 各组细胞中心肌特征性蛋白表达电泳图(A)和直条图(B) Fig. 8 Electrophoregram (A) and histogram(B) of expressions of myocardial characteristic proteins in cells in various groups |
|
|
与对照组比较,5-aza诱导组和TanⅡA诱导组GSK-3β蛋白表达水平均明显升高(P < 0.05),β-catenin蛋白表达水平明显降低(P < 0.05);与5-aza诱导组比较,TanⅡA诱导组GSK-3β蛋白表达水平进一步升高(P < 0.05),而β-catenin蛋白表达水平差异无统计学意义(P > 0.05)。见图 9。
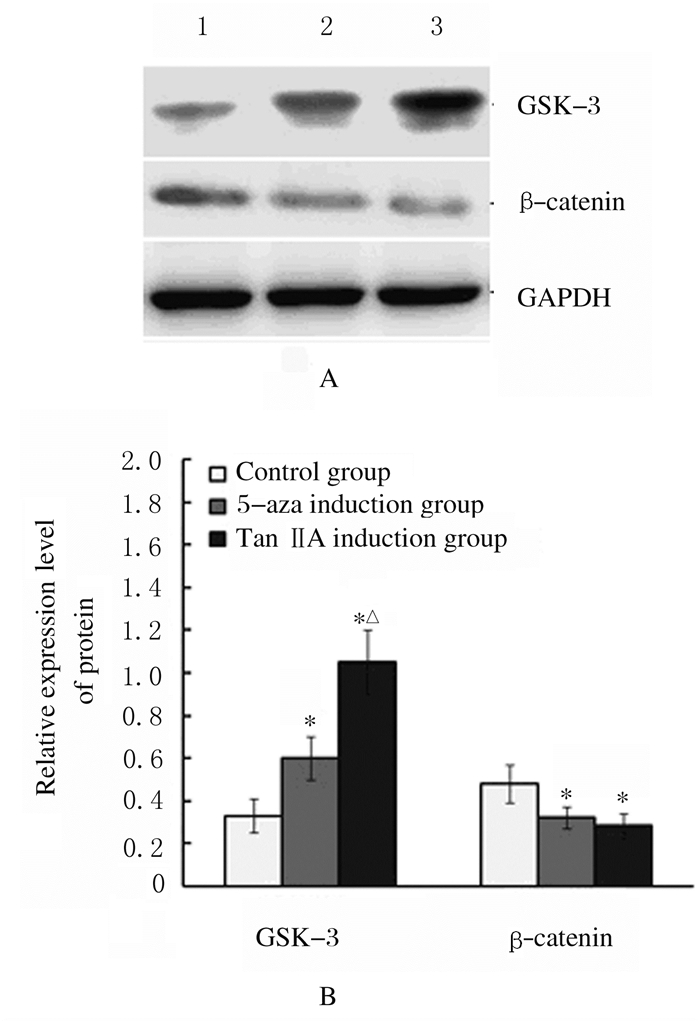
|
| Lane 1:Control group; Lane 2:5-Aza induction group; Lane 3:TanⅡA induction group.*P < 0.05 compared with control group; △P < 0.05 compared with 5-aza induction group. 图 9 各组细胞中GSK-3β和β-catenin蛋白表达电泳图(A)和直条图(B) Fig. 9 Electrophoregram(A) and histogram(B) of expressions GSK-3β and β-catenin proteins in cells in various groups |
|
|
干细胞分化为心肌细胞是一个复杂的过程,需要多种信号通路的调节[11]。cTnI是心室和心房细胞中典型的蛋白,在细胞分化早期表达水平低,细胞分化中晚期表达水平升高,是心肌细胞重要的特征性蛋白[12]。GATA4是心脏基因表达的重要转录调节因子,通过与其他转录调节因子相互作用,共同调控心脏正常发育、功能基因表达和心肌肥大的病理过程[13-14]。在心肌细胞分化早期,GATA4即有表达,并通过激活ANF等的表达,促进心肌细胞进一步分化和发育[12]。
5-aza是目前公认最常用也是最有效的心肌细胞分化诱导剂,但其细胞毒性作用使之不能广泛应用于临床。目前,一般认为10μmol·L-1、作用时间为24 h是5-aza的最佳诱导条件[15],但诱导效率低下。因此寻求一种更安全而有效的诱导剂成为该领域亟待解决的难题。
Tan ⅡA是我国传统中药丹参的有效活性成分。现代药理学研究[16-19]显示:Tan ⅡA能改善缺血区微循环,抑制血小板聚集和炎症反应,降低血脂,抑制动脉硬化的进展。本研究用Tan ⅡA干预hPDMSCs,观察其对hPDMSCs分化的影响,另设置不加药的阴性对照组和5-aza诱导(10μmol·L-1)的阳性对照组,结果显示:5-aza和Tan ⅡA均能使hPDMSCs增殖速率明显减慢,细胞形态也由成纤维细胞样形态变成短梭形样,心肌细胞特征性蛋白α-SCA、GATA4、ANF和cTnI表达水平均升高,提示5-aza和Tan ⅡA均能诱导hPDMSCs分化为心肌细胞,但以TanⅡA诱导组效果更明显。Wnt信号通路普遍存在于各种生物中,参与调控细胞增殖、分化和凋亡等多种生理病理过程。GSK-3β是Wnt/β-catenin通路的负向调节剂,与轴蛋白(Axin)和结肠腺瘤样息肉病(adenomatous polyposiscoli,APC)基因形成复合物,调节β-catenin的稳定性。当GSK-3β活化后,可以磷酸化APC和β-catenin,使β-catenin降解,促进中胚层分化形成心脏[20]。本研究结果显示:用5-aza和Tan ⅡA干预后细胞中GSK-3β表达水平均有不同程度升高,而β-catenin表达水平有不同程度降低,提示5-aza和Tan ⅡA均可抑制Wnt/β-catenin信号通路,但以TanⅡA诱导组效果更明显。
综上所述,TanⅡA能诱导hPDMSCs分化为心肌细胞,且效果优于5-aza,其机制可能与TanⅡA能抑制Wnt/β-catenin信号通路有关。
| [1] | MOZAFFARIAN D, BENJAMIN E J, GO A S, et al. Heart disease and stroke statistics-2015 update A report from the American Heart Association[J]. Circulation, 2015, 131(4): e29–322. |
| [2] | 黄晓巍, 徐岩, 韩冬, 等. 鹿茸多肽介导心肌干细胞分化对终末心肌分化基因ANP和MLC-2v表达的影响[J]. 吉林大学学报:医学版, 2018, 44(2): 249–253. |
| [3] | 刘城, 吴平生, 郭寿贵, 等. 腺病毒介导突变体HIF-1α基因对大鼠血管平滑肌细胞增殖的影响[J]. 广东医学, 2007, 28(6): 871–873. DOI:10.3969/j.issn.1001-9448.2007.06.008 |
| [4] | 郑景辉, 李勇华, 王丽萍, 等. 心血瘀阻证微环境对骨髓间充质干细胞向心肌样分化的影响[J]. 湖南中医药大学学报, 2010, 30(9): 38–42. |
| [5] | KLYUSHNENKOVA E, MOSCA J D, ZERNETKINA V, et al. T cell responses to allogeneic human mesenchymal stem cells:immunogenicity, tolerance, and suppression[J]. J Biomed Sci, 2005, 12(1): 47–57. DOI:10.1007/s11373-004-8183-7 |
| [6] | JANG Y K, JUNG D H, JUNG M H, et al. Mesenchymal stem cells feeder layer from human umbilical cord blood for ex vivo expanded growth and proliferation of hematopoietic progenitor cells[J]. Ann Hematol, 2006, 85(5): 343–344. DOI:10.1007/s00277-006-0088-2 |
| [7] | YU Y, LI K, BAO C, et al. Ex vitro expansion of human placenta-derived mesenchymal stem cells in stirred bioreactor[J]. Appl Biochem Biotechnol, 2009, 159(1): 110–118. DOI:10.1007/s12010-009-8556-5 |
| [8] | LI K, LI S Z, ZHANG Y L, et al. The effects of dan-shen root on cardiomyogenic differentiation of human placenta-derived mesenchymal stem cells[J]. Biochem Biophys Res Commun, 2011, 415(1): 147–151. DOI:10.1016/j.bbrc.2011.10.035 |
| [9] | LI K, SONG J, ZHAO Q, et al. Effective component of Salvia miltiorrhiza in promoting cardiomyogenic differentiation of human placentaderived mesenchymal stem cells[J]. Int J Mol Med, 2018, 41: 962–968. |
| [10] | DOMINICI M, BLANC K L, MUELLER I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006, 8(4): 315–317. DOI:10.1080/14653240600855905 |
| [11] | ZHAO X, HUANG L. Cardiac stem cells:A promising treatment option for heart failure[J]. Exp Ther Med, 2013, 5(2): 379–383. |
| [12] | 孙健, 白淑芝, 李爽, 等. CaSR在淫羊藿苷诱导的胚胎干细胞向心肌细胞分化中的作用[J]. 中国病理生理杂志, 2016, 32(2): 234–239. DOI:10.3969/j.issn.1000-4718.2016.02.007 |
| [13] | 贺继刚, 严丹, 王平, 等. GATA-4在心肌损伤修复中的作用机制研究进展[J]. 医学综述, 2015, 21(22): 4033–4036. DOI:10.3969/j.issn.1006-2084.2015.22.001 |
| [14] | 李涛. GATA-4在心肌基因表达调控中的作用及模式[J]. 临床与病理杂志, 2005, 25(3): 244–246. DOI:10.3969/j.issn.1673-2588.2005.03.018 |
| [15] | 贾秀丽, 李昌平. 5-氮胞苷诱导骨髓间充质干细胞向心肌细胞分化中的作用[J]. 中国组织工程研究, 2016, 20(50): 7469–7474. DOI:10.3969/j.issn.2095-4344.2016.50.003 |
| [16] | 宋明官, 吕洋, 王海萍, 等. 丹参酮ⅡA诱导骨髓间充质干细胞向心肌细胞分化的研究[J]. 中华老年心脑血管病杂志, 2015, 17(4): 412–415. DOI:10.3969/j.issn.1009-0126.2015.04.022 |
| [17] | FAN G W, GAO X M, WANG H, et al. The anti-inflammatory activities of tanshinone ⅡA, an active component of TCM, are mediated by estrogen receptor activation and inhibition of iNOS[J]. J Steroid Biochem, 2009, 113(3-5): 275–280. DOI:10.1016/j.jsbmb.2009.01.011 |
| [18] | KANG Y J, JIN U H, CHANG H W, et al. Inhibition of microsomal triglyceride transfer protein expression and atherogenic risk factor apolipoprotein B100 secretion by tanshinone ⅡA in HepG2 cells[J]. Phytother Res, 2008, 22(12): 1640–1645. DOI:10.1002/ptr.v22:12 |
| [19] | ADAMS J D, WANG R, YANG J, et al. Preclinical and clinical examinations of Salvia miltiorrhiza and its tanshinones in ischemic conditions[J]. Chin Med, 2006, 1(1): 1–15. |
| [20] | HARDT S E, SADOSHIMA J. Glycogen synthase kinase-3beta:a novel regulator of cardiac hypertrophy and development[J]. Circ Res, 2002, 90(10): 1055–1063. DOI:10.1161/01.RES.0000018952.70505.F1 |
 2019, Vol. 45
2019, Vol. 45


