扩展功能
文章信息
- 王爱馥, 张奇, 张道明, 修雨婷, 丁雅明, 刘林林
- WANG Aifu, ZHANG Qi, ZHANG Daoming, XIU Yuting, DING Yaming, LIU Linlin
- 沉默线粒体核糖体蛋白L35基因对人食管癌TE-1细胞生长的影响
- Effect of silencing mitochondrial ribosomal protein L35 gene on growth of human esophageal cancer TE-1 cells
- 吉林大学学报(医学版), 2019, 45(01): 28-32
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 28-32
- 10.13481/j.1671-587x.20190106
-
文章历史
- 收稿日期: 2018-07-03
中国食管癌发病率呈逐年上升趋势,居世界第1位。5年生存率仅为10%~20%。有临床证据[1-2]表明:如果初次诊断的食管癌临床分期较早,5年生存率可升至80%~90%,但由于食管癌早期临床表现缺乏特异性,患者首次就诊时通常处于中晚期。因此,探索食管癌的发病机制,建立早期诊断的指标和方法,对降低死亡率是非常必要的。哺乳动物线粒体核糖体蛋白(mitochondrial ribosomal protein,MRP)由一个大39s亚基和一个小28s亚基组成。MRPL35基因编码一个39s亚基的亚单位蛋白,序列分析[3-5]显示:MRPL35存在3种同源体,在染色体6p、10q和Xp上发现了对应此基因的假基因。KOC等[6]发现:MRPL35蛋白的序列与菠菜叶绿体L35(P23326)具有高度的同源性(27.3%)。MRPL35与大肠杆菌L35有26.6%的序列是相同的。BOX等[7]提出MRPL35参与协调蛋白质的合成和氧化磷酸化,从而调节线粒体的生物能量容量。MENEZES等[8]发现:MRPS7(参与编码线粒体核糖体蛋白小28s亚基)突变后,线粒体复合呼吸链(RC)功能障碍,引发先天性感音神经性耳聋和进行性肝肾功能衰竭。目前关于MRPL35的研究多局限于结构分析,尚未见其与肿瘤相关的功能研究。MRP家族可以通过影响线粒体RC来影响细胞功能,因此推测沉默MRPL35基因可影响食管癌细胞功能。本研究旨在探讨MRPL35对食管癌TE-1细胞增殖的作用,以期为食管癌的早期筛查及肿瘤新型靶向治疗提供依据。
1 材料与方法 1.1 细胞、主要试剂和仪器食管癌ECA109和KYSE150细胞株均储存于吉林大学第二医院中心实验室,食管癌TE-1细胞购于上海吉凯公司并经过STR认证。根据RNA干扰序列设计原则,以MRPL35基因为模板,设计多个19-21ntRNA干扰靶点序列。经设计软件评估测定后,选取GTCAAGAATGCCTCTCTTA序列作为干扰靶点,慢病毒载体购于上海吉凯公司。RPMI1640培养基、胎牛血清(FBS)和青-链霉素双抗购自美国Gibco公司,RNA提取试剂盒、M-MLV反转录试剂盒、qPCR试剂盒和总蛋白质提取试剂盒购自北京全式金公司,Western blotting抗体购自美国AFFINITY公司,细胞凋亡检测试剂盒Annexin V-PE/7AAD购自美国BD公司,CCK-8试剂盒购自日本同仁化学研究所。37℃恒温培养箱和酶标仪(美国Thermo公司),流式细胞仪(美国Beckman公司)。
1.2 RT-PCR法检测细胞中MRPL35 mRNA表达水平胰酶消化收集5×105 mL-1细胞,离心去上清液,将1mL Trizol加入到细胞沉淀中。依次加入氯仿-异丙醇-乙醇,离心、洗涤得到RNA沉淀,静止干燥至沉淀基本透明时,加入RNase-free水至完全溶解,Nanodrop 2000/2000C分光光度计分析确定提取RNA浓度和纯度。使用M-MLV逆转录试剂盒通过反转录提取cDNA。以GAPDH为内参照,设3个复孔,采用两步RT-PCR法检测细胞中MRPL35 mRNA表达水平,采用2-ΔΔCT法计算MRPL35 mRNA表达水平。
1.3 细胞分组和建立稳定沉默MRPL35基因的食管癌TE-1细胞系取对数生长期食管癌TE-1细胞,以每孔1×105个细胞接种于6孔板中, 分为shMRPL35组和shCtrl组,按实验设计向shMRPL35组加入沉默靶基因带有嘌呤霉素抗性的si-RNA慢病毒,向shCtrl组加入等量的带有嘌呤霉素抗性阴性对照si-RNA慢病毒,转染12h后换含10%胎牛血清、1%双抗的1640普通培养液,继续培养。72h后于荧光显微镜下观察细胞感染效率和细胞状态。提取RNA并以与上述相同的方式逆转录为cDNA。采用Western blotting法检测MRPL35蛋白表达水平[包括提取蛋白、蛋白浓度测定、SDS-PAGE凝胶配置、上样电泳、免疫印迹(湿转)、封闭、抗体孵育和X片显影等步骤]。利用Imagine J分析软件,以GAPDH内参蛋白条带灰度为1,目的条带灰度值越大,表示蛋白表达水平越高。观察细胞状态良好、si-RNA可有效敲减MRPL35即重复上述步骤,转染病毒,更换含10%胎牛血清和1%双抗的1640普通培养液培养24h后,加入由上述培养液配制的浓度为1.8 mg·L-1的嘌呤霉素溶液,连续培养7d,每天更换含1.8 mg·L-1嘌呤霉素的培养液,7d后荧光显微镜下通过病毒转染后的绿色荧光蛋白观察感染效率,细胞全部发出绿色荧光代表细胞全部转染慢病毒,即稳定系构建成功,继续培养待行后续实验。
1.4 CCK-8法检测各组细胞生长速度按以上实验分组,胰酶消化,将慢病毒感染后的细胞,以2×104 mL-1的细胞密度接种于96孔板, 每孔接种100μL细胞悬液,设3个复孔,共铺6张板, 孵箱培养,细胞贴壁当天开始检测,培养终止前2h换液加入10μL CCK-8溶液于孔中。2h后完全振荡器振荡2~5 min,连续6d采用酶标仪在450nm处检测吸光度(A)值,取各组平均值,表示各组细胞生长速度。
1.5 Annexin V-PE/7AAD法检测各组细胞凋亡率按以上实验分组,胰酶消化,将细胞悬浮于完全培养液中,以2×105 mL-1细胞密度收集在2mL离心管中,每管收集1mL细胞悬液,设3个复管。离心弃上清,加1×binding buffer 100μL重悬细胞沉淀,分别加入5μL PE Annexin Ⅴ和7-AAD染色,室温避光15 min。补加1×binding buffer 400μL,1h内上机检测。得到流式细胞术检测散点图,计算细胞凋亡率。
1.6 统计学分析采用SPSS20.0统计软件进行统计学分析。各组细胞中MRPL35 mRNA和蛋白表达水平、细胞生长速度及凋亡率以x±s表示,组间比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 3种食管癌细胞中MRPL35 mRNA的表达水平3种食管癌细胞均表达MRPL35基因,但3种细胞中MRPL35 mRNA表达水平比较差异无统计学意义(P > 0.05)。见图 1。通过病毒感染预试验,食管癌细胞TE-1细胞状态更加稳定,因而选择TE-1细胞进行下一步实验。
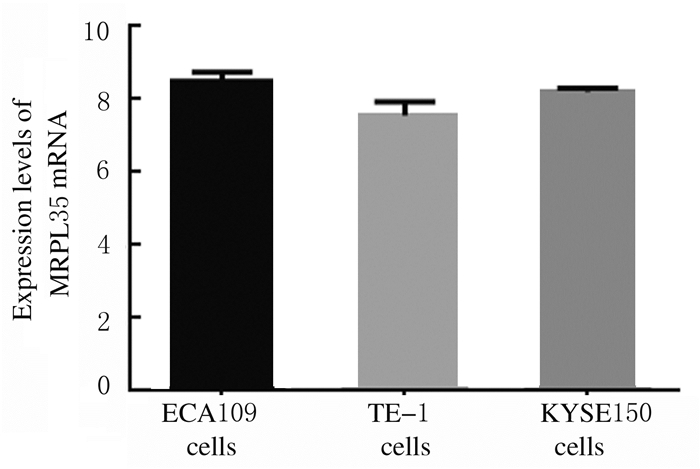
|
| 图 1 3种食管癌细胞中MRPL35 mRNA表达水平 Fig. 1 Expression levels of MRPL35 mRNA in three kinds of esophageal cancer cells |
|
|
TE-1细胞经慢病毒转染后,感染效率达到80%以上,细胞状态正常(图 2,见插页一)。定量PCR法检验结果显示:经shRNA慢病毒感染后,与shCtrl组比较,shMRPL35组TE-1细胞中MRPL35 mRNA表达水平明显降低(P < 0.05),敲减效率达到85.6%。Western blotting法检测结果显示:shMRPL35组TE-1细胞MRPL35蛋白表达水平较shCtrl组明显降低(P < 0.05)。见图 3和表 1。经检验沉默MRPL35靶点有效,加嘌呤霉素浓度为1.8 mg·L-1培养液连续7d筛选稳定系,慢病毒几乎转染全部细胞。
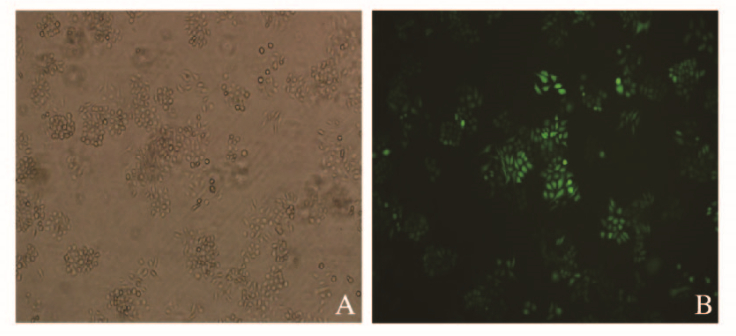
|
| A: Cells transfected by virus; B: Cells expressing green fluorescent protein. 图 2 病毒转染后的转染效率和细胞状态(×20) Fig. 2 Transfection efficiency and cell status after virus transfection(×20) |
|
|

|
| Lane 1:ShCtrl group; Lane 2:ShMRPL35 group. 图 3 2组TE-1细胞中MRPL35蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of MRPL35 protein in TE-1 cells in two groups |
|
|
| (n=3, x±s) | ||
| Group | MRPL35 mRNA | MRPL35 protein |
| ShCtrl | 1.00±0.05 | 0.91±0.85 |
| ShMRPL | 0.14±0.04* | 0.29±0.12* |
| *P < 0.05 compared with shCtrl group. | ||
细胞贴壁后生长2 h~1 d,2组细胞生长速度比较差异无统计学意义(P > 0.05);细胞贴壁生长2d,shMRPL35组细胞生长速度(0.172±0.005)明显低于shCtrl组(0.198±0.007),差异有统计学意义(P < 0.05)。随着时间的增加, 与shCtrl组比较,shMRPL35组细胞生长速度明显减缓(P < 0.05)。见图 4。
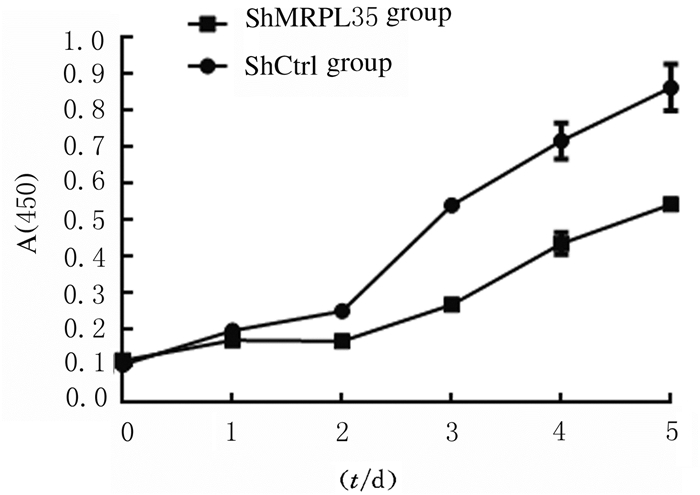
|
| 图 4 2组TE-1细胞的生长速度 Fig. 4 Growth speeds of TE-1 cells in two groups |
|
|
Annexin Ⅴ-PE/7AAD双染流式细胞术检测散点图可见:细胞分布于左上(UL)、左下(LL)、右上(UR)和右下(LR)4个象限,其中PE阳性(UR和LR)为凋亡细胞,7AAD单阳性细胞(UL)为坏死细胞。与shCtrl组细胞凋亡率(4.17%±0.25%)比较,shMRPL35组细胞凋亡率(13.72%±0.67%)明显升高(P < 0.01)。见图 5。

|
| A:ShCtrl group; B:ShMRPL35 group. 图 5 流式细胞术检测2组TE-1细胞凋亡率 Fig. 5 Apoptotic rates of TE-1 cells in two groups detected by flow cytometry |
|
|
目前,每年有近400000例食管癌患者死亡,尽管采用现代外科技术结合放疗和化疗等食管癌治疗方法,患者预后仍然较差[9-10]。计算机断层扫描(CT)不能准确地识别局灶性食管癌,钡餐造影可鉴别不规则狭窄或肿块,上消化道内镜活检和组织学检查是食管癌诊断的金标准[11]。食管癌目前并没有特异性好的血清学标志物,临床常联合影像学和鳞癌、腺癌相关血清学标志物来进行辅助诊断, 其中具有代表性的血清学标志物为C反应蛋白(C-reactive protein,CRP),其高表达CRP的食管癌患者生存期较短。NAKATSU等[12]对肿瘤组织免疫组织化学分析结果表明:59%的食管癌组织可检出CRP阳性表达。因此探索食管癌相关生物标记物进行流行病学的早期筛查,对提高我国食管癌患者的存活率,降低死亡率尤为重要。
MRP家族中研究较多的为MRPL12,有研究[13]表明:HeLa细胞中过表达的MRPL12参与活化核糖体的转录和翻译。NOUWS等[14]发现:MRPL12可与MRPL10相互作用调节细胞周期和增殖。另一项关于人皮肤成纤维细胞的研究[15]显示:MRPL12的突变会导致细胞的增殖阻滞。以上研究均表明:MRPL12与细胞的增殖和凋亡有关,MRP家族可能通过参与核糖体的蛋白转录翻译功能,调控细胞增殖,但其机制尚不清楚。细胞的生理学可以看作是蛋白质共同作用形成的产物,通过蛋白质-蛋白质相互作用网络组装成复合物、细胞器和信号转导途径[16]。MRPL35作为MRP大39s亚基编码基因可能通过以上生理活动参与调控肿瘤细胞的增殖。本研究采用慢病毒为载体的RNA干扰(RNAi)技术,病毒基因组整合于宿主基因组, 长时间、稳定沉默目的基因[17],且转染后细胞状态未见明显异常。本研究结果显示:shMRPL35组TE-1细胞中MRPL35 mRNA和蛋白表达水平较shCtrl组明显下调(P < 0.05),说明载体沉默基因靶点无误且高效抑制基因表达;与shCtrl组比较,shMRPL35组MRPL35基因沉默后食管癌细胞TE-1增殖能力明显受到抑制;利用Annexin Ⅴ-PE/7ADD双染流式细胞术检测,shMRPL35组细胞凋亡率较shCtrl组明显升高(P < 0.01)。本研究结果表明:MRPL35基因在食管癌TE-1细胞的增殖和凋亡中起着关键作用。MRPL35表达下调后,食管癌细胞TE-1增殖能力受到了抑制,且与凋亡有关。细胞凋亡途径主要有细胞膜途径、线粒体途径和内质网途径3种。基因沉默后,经过某一种途径使得凋亡调控分子进行相互作用,则可选取经典的细胞增殖和凋亡通路,验证MRPL35与下游调控通路的关键基因蛋白的相互作用,进一步探究MRPL35的调控机制。有研究[18-21]报道:线粒体核糖体蛋白MRPS18-2(S18-2,NP014765)与视网膜母细胞瘤蛋白(RB,NPY000 0312)结合,并阻止转录因子E2F1(NPY05216) -RB复合物的形成,导致细胞核中游离E2F1蛋白水平升高,随后促进进入S期,MRPS18-2的过度表达导致原代大鼠胚胎成纤维细胞永生化,推测MRPS18-2是一种新发现的癌基因,可能参与癌变过程。MRPL35基因与MRPS18-2基因同样编码线粒体核糖体蛋白大小亚基,MRPL35基因是否也同为癌基因,其与食管癌发生的关系,以及在细胞增殖、氧化磷酸化、细胞呼吸和其他氧化还原反应中涉及的基因是否存在上调,其代谢是否更加活跃,有待于进一步研究。
本研究结果表明:MRPL35基因与食管癌TE-1细胞增殖有关联。通过慢病毒介导的RNAi技术沉默MRPL35基因,能够抑制食管癌TE-1细胞的增殖能力。本研究结果可为食管癌的发生发展机制的研究提供理论基础,并可能为食管癌的早期诊断提供确切的依据。
| [1] | WU N, ZHE Y, KADEL D, et al. The prognostic influence of body mass index, resting energy expenditure and fasting blood glucose on postoperative patients with esophageal cancer[J]. BMC Gastroenterol, 2016, 16(1): 142. DOI:10.1186/s12876-016-0549-6 |
| [2] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [3] | O'BRIEN T W. The general occurrence of 55S ribosomes in mammalian liver mitochondria[J]. J Biol Chem, 1971, 246(10): 3409–3417. |
| [4] | AMUNTS A, BROWN A, TOOTS J, et al. Ribosome. The structure of the human mitochondrial ribosome[J]. Science, 2015, 348(6230): 95–98. DOI:10.1126/science.aaa1193 |
| [5] | ZHANG Z, GERSTEIN M. Identification and characterization of over 100 mitochondrial ribosomal protein pseudogenes in the human genome[J]. Genomics, 2003, 81(5): 468–480. DOI:10.1016/S0888-7543(03)00004-1 |
| [6] | KOC EC, BURKHART W, BLACKBURN K, et al. The large subunit of the mammalian mitochondrial ribosome. Analysis of the complement of ribosomal proteins present[J]. J Biol Chem, 2001, 276(47): 43958–43969. DOI:10.1074/jbc.M106510200 |
| [7] | BOX J M, KAUR J, STUART R A. MrpL35, a mitospecific component of mitoribosomes, plays a key role in cytochrome c oxidase assembly[J]. Mol Biol Cell, 2017, 28(24): 3489–3499. DOI:10.1091/mbc.e17-04-0239 |
| [8] | MENEZES M J, GUO Y, ZHANG J, et al. Mutation in mitochondrial ribosomal protein S7(MRPS7) causes congenital sensorineural deafness, progressive hepatic and renal failure and lactic acidemia[J]. Hum Mol Genet, 2015, 24(8): 2297–2307. DOI:10.1093/hmg/ddu747 |
| [9] | ARNOLD M, SOERJOMATARAM I, FERLAY J, et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut, 2015, 64(3): 381–387. DOI:10.1136/gutjnl-2014-308124 |
| [10] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [11] | SDRALIS E I K, PETOUSIS S, RASHID F, et al. Epidemiology, diagnosis, and management of esophageal perforations:systematic review[J]. Dis Esophagus, 2017, 30(8): 1–6. |
| [12] | NAKATSU T, MOTOYAMA S, MARUYAMA K, et al. Tumoral CRP expression in thoracic esophageal squamous cell cancers is associated with poor outcomes[J]. Surg Today, 2012, 42(7): 652–658. DOI:10.1007/s00595-012-0147-3 |
| [13] | SUROVTSEVA Y V, SHUTT T E, COTNEY J, et al. Mitochondrial ribosomal protein L12 selectively associates with human mitochondrial RNA polymerase to activate transcription[J]. Proc Natl Acad Sci U S A, 2011, 108(44): 17921–17926. DOI:10.1073/pnas.1108852108 |
| [14] | NOUWS J, GOSWAMI A V, BESTWICK M, et al. Mitochondrial ribosomal protein L12 is required for POLRMT stability and exists as two forms generated by alternative proteolysis during import[J]. J Biol Chem, 2016, 291(2): 989–997. DOI:10.1074/jbc.M115.689299 |
| [15] | SERRE V, ROZANSKA A, BEINAT M, et al. Mutations in mitochondrial ribosomal protein MRPL12 leads to growth retardation, neurological deterioration and mitochondrial translation deficiency[J]. Biochim Biophys Acta, 2013, 1832(8): 1304–1312. DOI:10.1016/j.bbadis.2013.04.014 |
| [16] | HUTTLIN E L, BRUCKNER R J, PAULO J A, et al. Architecture of the human interactome defines protein communities and disease networks[J]. Nature, 2017, 545(7655): 505–509. DOI:10.1038/nature22366 |
| [17] | SEGURA M M, MANGION M, GAILLET B, et al. New developments in lentiviral vector design, production and purification[J]. Expert Opin Biol Ther, 2013, 13(7): 987–1011. DOI:10.1517/14712598.2013.779249 |
| [18] | DAREKAR S D, MUHAMMAD M, GURRAPU S, et al. Mitochondrial ribosomal protein S18-2 evokes chromosomal instability and transforms primary rat skin fibroblasts[J]. Oncotarget, 2015, 6(25): 21016–21018. |
| [19] | SNOPOK B, YURCHENKO M, SZEKELY L, et al. SPR-based immunocapture approach to creating an interfacial sensing architecture:Mapping of the MRS18-2 binding site on retinoblastoma protein[J]. Anal Bioanal Chem, 2006, 386(7/8): 2063–2073. |
| [20] | KASHUBA E, YURCHENKO M, YENAMANDRA S P, et al. EBV-encoded EBNA-6 binds and targets MRS18-2 to the nucleus, resulting in the disruption of pRb-E2F1 complexes[J]. Proc Natl Acad Sci U S A, 2008, 105(14): 5489–5494. DOI:10.1073/pnas.0801053105 |
| [21] | KASHUBA E, YENAMANDRA S P, DAREKAR S D, et al. MRPS18-2 protein immortalizes primary rat embryonic fibroblasts and endows them with stem cell-like properties[J]. Proc Natl Acad Sci U S A, 2009, 106(47): 19866–19871. DOI:10.1073/pnas.0911545106 |
 2019, Vol. 45
2019, Vol. 45


