扩展功能
文章信息
- 孙红, 闫志文, 李硕峰, 熊艳杰, 梁凡, 李傲, 姚芳莲, 车鹏程
- SUN Hong, YAN Zhiwen, LI Shuofeng, XIONG Yanjie, LIANG Fan, LI Ao, YAO Fanglian, CHE Pengcheng
- 壳聚糖-明胶-果胶仿生网络膜对间充质干细胞增殖和矿化的影响
- Effects of biomimetic network membrane prepared by chitosan/gelatin/pectin on proliferation and mineralization of mesenehymal stem cells
- 吉林大学学报(医学版), 2019, 45(01): 17-22
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 17-22
- 10.13481/j.1671-587x.20190104
-
文章历史
- 收稿日期: 2018-04-25
2. 华北理工大学附属医院病理科, 河北 唐山 063000;
3. 天津大学化工学院高分子科学与工程系, 天津 300072
2. Department of Pathology, Affiliated Hospital, North China University of Science and Technology, Tangshan 063000, China;
3. Department of Polymer Science and Engineering, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
一个世纪以来,骨缺损的修复一直是人们深入研究的重要课题,也是热门课题之一,然而,迄今为止临床上对创伤、感染和肿瘤切除后所造成的大范围骨缺损的修复仍未得到有效的解决。目前,如何促进骨损伤修复与再生是生物学家及生物工程师面临的严峻挑战。近十几年来随着组织工程学的兴起,科学家们开始用组织工程学原理和技术,将具有成骨潜能的细胞诱导分化、增殖并种植到生物降解的支架材料上,形成组织工程化人工骨,这将有助于促进大范围骨缺损的修复。间充质干细胞(mesenchymal stem cells,MSCs)由于其强大的增殖能力和多向分化潜能成为骨组织工程的种子细胞之一[1-2]。研究[3]表明:MSCs可向成骨细胞和软骨细胞等多种终末分化细胞分化。MSCs的成骨分化潜能是骨再生医学的主要优势之一,但目前MSCs的定向成骨分化方法主要是应用诱导剂及生长因子,效果不甚理想。有国外研究[4]显示:MSCs的分化具有位点特异性,用模拟的成骨微环境来诱导MSCs定向成骨分化具有可行性。本研究将壳聚糖、明胶和果胶按照一定的比例制作成新型仿生网络膜,用于模拟骨细胞外微环境,探讨该网络膜材料对MSCs增殖和矿化作用的影响,为软骨组织工程材料的设计提供新思路。
1 材料与方法 1.1 实验动物、主要试剂和仪器4周龄清洁级SD大鼠,体质量100~110g,雌雄不限,由华北理工大学实验动物中心提供,动物许可证号:SYXK(冀)2010-0038。DMEM/F12培养基和胰蛋白酶(MTT,美国Gibco公司),胎牛血清(天津血液研究所),四甲基偶氮唑盐(美国Amresco公司),地塞米松、β-甘油磷酸钠和维生素C(美国Sigma公司),骨钙素(osteocalcin,OC)和骨桥蛋白(osteopontin,OPN)引物(北京三博远志生物工程技术服务公司)。扫描电子显微镜(SEM,日本日立公司),光学显微镜(日本奥林巴斯公司)。常规培养基组成:DMEM/F12培养基+10%胎牛血清;成骨诱导(osteogenic,OS)培养基组成:常规培养基+地塞米松(1×10-8 mmol·L-1) +β-甘油磷酸钠(10 mmol·L-1) +维生素C(50μmol·L-1)。
1.2 壳聚糖-明胶-果胶网络膜材料的制备壳聚糖-明胶-果胶网络膜由天津大学制备,采用仿生学方法,将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)和2-吗啉乙磺酸(MES)加入2%果胶水溶液中,25℃搅拌4 h,将其分散到4%明胶水溶液和2%壳聚糖醋酸酯溶液中,搅拌均匀,在培养皿室温干燥成膜,PBS清洗、干燥,材料按实验要求制备成合适的大小,60Co照射消毒备用。
1.3 MSCs的原代获取及传代培养4周龄SD大鼠脱颈致死,75%乙醇浸泡5 min,取其双侧后腿股骨和胫骨,彻底清除附着的肌肉组织和结缔组织,PBS清洗后,剪掉两端的软骨组织,用带5号针头注射器吸取DMEM/F12培养基冲洗骨髓腔,收集并离心后弃去上清,用含10%胎牛血清的DMEM/F12培养基吹打均匀后接种于25cm2的培养瓶中,37℃、5%CO2培养箱静置培养。
1.4 MSCs与网络膜材料共培养将培养至第3代的MSCs用于实验,用0.25%胰酶消化制成2.0×105 L-1细胞悬液,接种到新型网络膜材料上。分为对照组(MSCs +常规培养基)、材料组(MSCs+网络膜+常规培养基)和材料+OS组(MSCs+网络膜+OS培养基)。将细胞置于37℃、5%CO2培养箱,每天倒置相差显微镜观察细胞的生长情况。于接种后第7、14和21天取材,2.5%戊二醛固定,梯度乙醇脱水,临界点干燥,表面喷金,SEM下观察网络膜上细胞的形态特征和细胞外基质分泌情况。
将MSCs分为阴性对照组(空白培养液)和材料组(含材料的培养液),在接种后第3、7和10天吸出培养基,加入MTT溶液,将细胞培养板放置培养箱中孵育4 h。吸去培养基,用PBS冲洗1次,每孔加入50μL二甲基亚砜(DMSO)。每孔取出100μL溶液转移至96孔酶标板,采用酶标仪测定595 nm处溶液的吸光度(A)值,以A值代表MSCs增殖水平。
1.5 茜素红染色观察网络膜上MSCs的矿化作用细胞与网络膜材料复合培养后第7、14和21天分别取材。75%乙醇固定30 min,蒸馏水冲洗3次,加入0.1%茜素红-Tris-HCl(pH8.3)染液,作用30 min。蒸馏水冲洗,干燥后封片,显微镜下观察。利用茜素红染色,若细胞中开始分泌钙盐,则染色的细胞出现橘红色,且分泌的钙盐越多染色越深。
1.6 实时聚合酶链反应(Real time-PCR)检测MSCs中OC和OPN mRNA表达水平于复合培养后第7、14和21天提取各组标本,PBS清洗2次,使用Trizol Reagent提取细胞总RNA,并按照ReverTra Ace-a-TM逆转录酶试剂盒说明书操作得到模板cDNA。OC和OPN引物序列见表 1。以所得的cDNA为模板进行PCR反应,PCR通过连续监测荧光信号强弱的变化即时测定特异性产物的量,应用定量PCR仪自带数据分析软件进行分析,实时定量测定OC和OPNmRNA表达水平计算公式:ΔCt=Ct目的基因-Ct管家基因;ΔΔCt=材料组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因)。ΔCt数值越大,OC mRNA和OPN mRNA表达水平越高。
| Gene | Primer sequence | Annealing temperature(θ/℃) | Product size(bp) |
| OC | 5′-GCATCTATGGCACCACCGTTTA-3′ 5′-GCTGTGCCGTCCATACTTTCG-3′ |
62.5 63.0 |
129 |
| OPN | 5′-TCCTGTCTCCCGGTGAAAGTG-3′ 5′-ATGGTCTCCGTCGTCATCGTC-3′ |
62.1 61.9 |
249 |
采用SPSS 16.0统计软件进行统计学分析。各组MSCs增殖水平、OC和OPN mRNA表达水平均以x±s表示。两组间样本均数比较采用t检验,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 壳聚糖-明胶-果胶网络膜大体表现新型仿生壳聚糖-明胶-果胶网络膜材料呈半透明薄膜状,有利于观察在其上生长的细胞形态。见图 1。

|
| 图 1 壳聚糖-明胶-果胶网络膜大体表现 Fig. 1 General appearance of chitosan-gelatin-pectin network membrane material |
|
|
刚接种的细胞呈球形漂浮于培养液中,2~3h在复合膜的表面贴附;6~7h细胞开始伸出伪足;24h后复合膜表面贴附生长的细胞增多;培养第3天细胞形态逐渐变为短梭形、多角形,体积较大,核居中,细胞成簇状聚集生长;培养第10天部分重叠生长的细胞逐渐融合;培养第14~21天,细胞密度明显增加,部分区域融合成结节。见图 2(插页一)。

|
| A:3d; B:10d. 图 2 倒置相差显微镜下MSCs的形态表现(×100) Fig. 2 Morphology of MSCs under inverted phase contrast microscope(×100) |
|
|
复合培养第7天,可见细胞呈星形或梭形;培养第14天,细胞增多,增殖旺盛,以伪足状的突起锚定于材料表面;培养第21天,细胞聚集生长,细胞间以突起相互连接,呈结节状,分泌大量细胞外基质。见图 3。

|
| A:7d(×1000);B:14d(×1000);C:21d(×400). 图 3 SEM下观察网络膜材料上MSCs的超微结构 Fig. 3 Ultrastructures of MSCs on network membrane material observed under SEM |
|
|
与阴性对照组比较,培养第3、7和10天材料组细胞的增殖水平差异无统计学意义(P > 0.05),表明网络膜材料有良好的生物相容性。见表 2。
| (n=3, x±s) | |||
| Group | Proliferation level of MSCs | ||
| (t/d)3 | 7 | 10 | |
| Negative control | 0.040 6±0.002 1 | 0.082 8±0.001 9 | 0.102 2±0.001 9 |
| Material | 0.035 2±0.004 3 | 0.078 0±0.003 1 | 0.098 4±0.002 3 |
培养第7天可见网络膜材料上的细胞被茜素红染成橘红色,表明细胞中已经开始分泌钙盐,细胞间重叠生长,具有形成结节的趋势;第14天时重叠生长的细胞已形成大小不一的结节,结节部位染色较深;第21天时可见多个结节,并形成颜色更深的橘红色大结节。见图 4(插页一)。
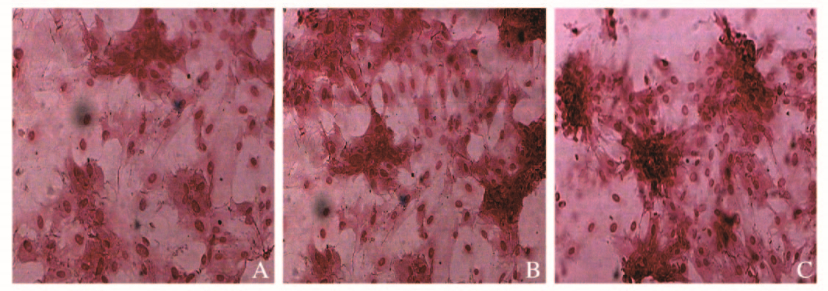
|
| A:7d;B:14d;C:21d. 图 4 网络膜材料上MSCs的矿化(茜素红染色, ×100) Fig. 4 Mineralization of MSCs on network membrane material (Alizarin redstaining, ×100) |
|
|
OC mRNA和OPN mRNA的出现表明细胞中出现了成骨的变化。在培养第7和14天时OC mRNA表达水平较低,第21天时其表达水平明显增高,达到峰值;在第7天时OPN mRNA明显表达,第14天时其表达水平达峰值,第21天时略有下降。与对照组比较,不同时间点材料组和材料+OS组细胞中OC mRNA和OPN mRNA表达水平明显升高(P < 0.01),而材料组与材料+OS组比较差异无统计学意义(P > 0.05)。见表 3。
| (n=3, x±s) | |||||||
| Group | Expression level of OC mRNA | Expression level of OPN mRNA | |||||
| (t/d) 7 | 14 | 21 | 7 | 14 | 21 | ||
| Control | 1 | 1 | 1 | 1 | 1 | 1 | |
| Material | 2.727±0.252* | 3.840±0.114* | 70.800±4.970* | 9.803±1.151* | 25.813±0.535* | 19.370±1.419* | |
| Meterial+OS | 2.663±0.651* | 3.780±0.050* | 66.343±4.066* | 9.180±1.191* | 25.377±1.863* | 18.057±0.753* | |
| *P < 0.01 compared with control group. | |||||||
骨组织工程是利用材料工程和生命科学的原理和方法再生新的骨组织,以修复和替代病变或缺损的骨组织,或者增进其功能的技术[5]。骨组织工程仿生材料是目前研究的热点和难点,旨在模拟细胞外基质(extracellular matrix,ECM),并使其智能化。有研究[6-8]显示:在天然骨的ECM中存在多糖分子是成骨分化的必要条件。事实上,ECM提供了结构和功能蛋白,调节细胞行为和谱系特异性分化,以促进成骨[9-11]。
壳聚糖是一种带有正电荷的碱性天然多糖,在自然界中作为几种活生物体的必需支持结构,能与成骨细胞膜负电成分呈现非特异相互作用,并可调控生物活性分子释放,促进骨形成,并且在体内可被降解为氨基葡萄糖,具有优良的生物相容性和生物可降解性,是理想的ECM材料[12-14]。壳聚糖本身独特的大分子结构还具有生物功能性的亲水表面,能促进成骨细胞的增生和血管内皮细胞的生长,还具有抗肿瘤活性以及消炎、镇痛和杀菌等特性,且能诱导损伤机体产生特殊细胞,促进缺损部分愈合。
胶原是ECM的主要结构蛋白,明胶是其部分变性衍生物,作为胶原的水解产物,具有无毒性、生物相容性良好、降解速度快、亲水性极强、无免疫原性且在体内可被完全分解吸收等特点。明胶具有细胞膜整合素结合区,可促进细胞的黏附、增殖、分化及迁移。在骨组织工程研究中,明胶能够促进骨细胞在材料上黏附、增殖、分化和分泌ECM。另外,明胶还可溶于热水,形成热可逆性凝胶,且具有可高度分散性和分散稳定性,因此可作为组织工程材料的原材料。
果胶是一种来源于植物的富含葡糖酸和葡糖酸甲酯的多糖,由长的连续且平滑的高聚半乳糖醛区域和短的、毛发状的鼠李半乳糖醛酸糖区域两部分组成,其结构和哺乳动物ECM中的多糖结构非常类似,能够模拟ECM的蛋白质成分。果胶与蛋白质或其他多糖复合,形成植物的框架组织,具有刚性和化学稳定性。在复合物中引入果胶可以调整其溶胀性能和力学强度。果胶是高分子物质,具有聚阴离子特性,通过物理性质与周围环境发生反应,使得稠厚的胶原成为稀释的溶液。上述性质使得果胶成为承载信号和支持不同生物活性物质的分子物质,且果胶能够与壳聚糖形成网状结构。目前,果胶在药物释放领域已经得以规范应用。由于其良好的生物相容性,已经逐渐被应用于组织基质的重建[15-16]。
本研究采用仿生学方法,在合成壳聚糖/明胶的基础上,将果胶分散到壳聚糖/明胶溶液中制成壳聚糖-明胶-果胶仿生网络膜,将该仿生网络膜作为模拟的骨细胞外微环境,在体外诱导MSCs分化为成骨细胞。
骨的生成是由成骨细胞向周围分泌基质和纤维, 将其包埋于其中, 形成类骨质, 由钙盐沉积后形成骨组织而完成的。Ca及P等无机物和OC及OPN等有机物是成骨细胞的标志性成分。茜素红染色是用于测定细胞基质中钙盐较常用的特异方法。茜素红染色阳性表达是MSCs向成骨细胞分化的重要标志[17]。OC在骨细胞分化的终末阶段出现,是成骨细胞分化成熟的重要指标之一[18]。OPN是一种磷蛋白,含有与ECM矿物质表面相互作用的酸性结构域,通过激活细胞内特异性信号传导系统而介导细胞黏附、迁移和增殖[19]。OC和OPN蛋白被认为是成骨分化体系的具体标志[20]。
本研究将MSCs与新型仿生网络膜复合培养,MTT法检测表明网络膜材料生物相容性良好,组织学方法检测表明网络膜上细胞的黏附、生长和增殖情况良好,通过特殊染色和Real time-PCR法在网络膜上可以检测到成骨细胞的标志性无机物和有机物成分。本研究结果显示:网络膜上的细胞可以形成大量的钙化结节,且OC mRNA和OPN mRNA均有表达,表明壳聚糖-明胶-果胶网络膜具有良好的生物相容性,蕴含丰富的生物学信息,可以诱导MSCs分化为成骨细胞并表达矿化相关的基因和蛋白。本研究结果为下一步在网络膜基础上构建三维结构仿生支架材料,从体内和体外研究其骨结合的生物学效应奠定了理论基础。
| [1] | DENG M, MEI T, HOU T, et al. TGFβ3 recruits endogenous mesenchymal stem cells to initiate bone regeneration[J]. Stem Cell Res Ther, 2017, 8(1). DOI:10.1186/S13287-017-0693-0 |
| [2] | LI S, CHOW T, CHU J. Engineering microdent structures of bone implant surfaces to enhance osteogenic activity in MSCs[J]. Biochem Biophys Rep, 2016, 10(9): 100–105. |
| [3] | CHEN G, KAWAZOE N. Porous scaffolds for regeneration of cartilage, bone and osteochondral tissue[J]. Adv Exp Med Biol, 2018, 1058: 171–191. DOI:10.1007/978-3-319-76711-6 |
| [4] | CAPLAN AI. MSCs:The sentinel and safe-guards of injury[J]. J Cell Physiol, 2016, 231(7): 1413–1416. DOI:10.1002/jcp.25255 |
| [5] | 于祥茹, 韩晓谦, 袁浩天, 等. PLGA/CPC支架材料复合骨髓基质干细胞构建组织工程骨的体外效果评价[J]. 吉林大学学报:医学版, 2014, 40(2): 294–299. |
| [6] | KUMAR S, STOKES LⅡ J A, DEAN D, et al. Biphasic organo-bioceramic fibrous composite as a biomimetic extracellular matrix for bone tissue regeneration[J]. Front Biosci (Elite Ed), 2017, 9: 192–203. |
| [7] | HU Y, CHEN J, FAN T, et al. Biomimetic mineralized hierarchical hybrid scaffolds based on in situ synthesis of nano-hydroxyapatite/chitosan/chondroitin sulfate/hyaluronic acid for bone tissue engineering[J]. Colloids Surf B Biointerfaces, 2017, 157: 93–100. DOI:10.1016/j.colsurfb.2017.05.059 |
| [8] | AZEVEDO H S, PASHKULEVA I. Biomimetic supramolecular designs for the controlled release of growth factors in bone regeneration[J]. Adv Drug Deliv Rev, 2015, 94: 63–76. DOI:10.1016/j.addr.2015.08.003 |
| [9] | TOPOLUK N, HAWKINS R, TOKISH J, et al. Amniotic Mesenchymal Stromal Cells Exhibit Preferential Osteogenic and Chondrogenic Differentiation and Enhanced Matrix Production Compared With Adipose Mesenchymal Stromal Cells[J]. Am J Sports Med, 2017, 45(11): 2637–2646. DOI:10.1177/0363546517706138 |
| [10] | 李硕峰, 崔菁, 刘国良, 等. ECM-多糖/蛋白质多孔复合材料对BMSCs定向软骨分化的影响[J]. 广东医学, 2018, 39(8): 1137–1141. DOI:10.3969/j.issn.1001-9448.2018.08.006 |
| [11] | ALEXANDRE N, RIBEIRO J, GÄRTNER A, et al. Biocompatibility and hemocompatibility of polyvinyl alcohol hydrogel used for vascular grafting-In vitro and in vivo studies[J]. J Biomed Mater Res A, 2014, 102(12): 4262–4275. |
| [12] | CHEN X N, GU Y X, LEE J H, et al. Multifunctional surfaces with biomimetic nanofibres and drug-eluting micro-patterns for infection control and bone tissue formation[J]. Eur Cell Mater, 2012, 24: 237–248. DOI:10.22203/eCM |
| [13] | ZHANG S, PRABHAKARAN M P, QIN X, et al. Biocomposite scaffolds for bone regeneration:Role of chitosan and hydroxyapatite within poly-3-hydroxybutyrate-co-3-hydroxyvalerate on mechanical properties and in vitro evaluation[J]. J Mech Behav Biomed Mater, 2015, 51(1): 88–98. |
| [14] | MVLLER W E, NEUFURTH M, WANG S, et al. Morphogenetically active scaffold for osteochondral repair(polyphosphate/alginate/N, O-carboxymethyl chitosan)[J]. Eur Cell Mater, 2016, 31: 174–190. DOI:10.22203/eCM |
| [15] | PANSERI S, RUSSO A, CUNHA C, et al. Osteochondral tissue engineering approaches for articular cartilage and subchondral bone regeneration[J]. Knee Surg Sports Traumatol Arthrosc, 2012, 20(6): 1182–1191. DOI:10.1007/s00167-011-1655-1 |
| [16] | QI Y, DU Y, LI W, et al. Cartilage repair using mesenchymal stem cell (MSC) sheet and MSCs-loaded bilayer PLGA scaffold in a rabbit model[J]. Knee Surg Sports Traumatol Arthrosc, 2014, 22(6): 1424–1433. DOI:10.1007/s00167-012-2256-3 |
| [17] | TAGHIYAR L, HOSSEINI S, HESARAKI M, et al. Isolation, characterization and osteogenic potential of mouse digit tip blastema cells in comparison with bone marrow-derived mesenchymal stem cells In vitro[J]. Cell J, 2018, 19(4): 585–598. |
| [18] | SON H E, KIM E J, JANG W G. Curcumin induces osteoblast differentiation through mild-endoplasmic reticulum stress-mediated such as BMP2 on osteoblast cells[J]. Life Sci, 2018, 15(193): 34–39. |
| [19] | WU G, FENG C, QUAN J, et al. In situ controlled release of stromal cell-derived factor-1α and antimiR-138 for on-demand cranial bone regeneration[J]. Carbohydr Polym, 2018, 15(182): 215–224. |
| [20] | ZHANG Y D, ZHAO S C, ZHU Z S, et al. Cx43-and Smad-mediated TGF-β/BMP signaling pathway promotes cartilage differentiation of bone marrow mesenchymal stem cells and inhibits osteoblast differentiation[J]. Cell Physiol Biochem, 2017, 42(4): 1277–1293. DOI:10.1159/000478957 |
 2019, Vol. 45
2019, Vol. 45


