扩展功能
文章信息
- 刘丹, 杨晓波, 王颖, 于丽红, 石焱, 张英杰, 康万军
- LIU Dan, YANG Xiaobo, WANG Ying, YU Lihong, SHI Yan, ZHANG Yingjie, KANG Wanjun
- 蚓激酶对胃癌SGC7901细胞增殖抑制和凋亡诱导作用
- Inhibitory effect of lumbrokinase on proliferation and induction on apoptosis of gastric cancer SGC7901 cells
- 吉林大学学报(医学版), 2019, 45(01): 7-11
- Journal of Jilin University (Medicine Edition), 2019, 45(01): 7-11
- 10.13481/j.1671-587x.20190102
-
文章历史
- 收稿日期: 2018-03-19
2. 大连医科大学药理学教研室, 辽宁 大连 116021
2. Department of Pharmacology, Dalian Medical University, Dalian 116021, China
蚓激酶(lumbrokinase, LBK)[1-3]在临床上用于预防和治疗血栓性疾病[4-6]。近年来关于LBK抗肿瘤的研究较多,研究[7-8]结果显示:LBK对多种肿瘤均有一定的治疗作用。余玲俐等[9]和WAGNER[10]研究发现:LBK对肺癌细胞A549有抑制增殖和促凋亡作用。余艳秋等[11]研究发现:蚯蚓纤溶酶对胃癌细胞株MGC803有抑制增殖和诱导凋亡作用;研究[12-15]表明:蚯蚓纤溶酶对人肝癌细胞(SMMC-7721)有抑制侵袭和转移作用,同时蚯蚓纤溶酶有抑制胃癌细胞增殖的作用,并可降低胃癌细胞和血管内皮细胞的黏附性,降低胃癌细胞黏附分子CD44v6的表达。目前LBK对胃癌细胞株SGC7901的作用尚未见报道。本研究采用LBK作用于体外培养的胃癌细胞株SGC7901,探讨其对SGC7901细胞增殖、相关凋亡蛋白表达和细胞周期等的影响,为LBK在抗胃癌方面的作用及机制提供实验依据。
1 材料与方法 1.1 细胞、主要试剂和仪器LBK购于陕西百威生物科技有限公司。RPMI1640培养基、EDTA、MTT、胎牛血清、胰蛋白酶、青霉素和链霉素(美国Gibco公司),PVDF膜(美国Millipore公司),全蛋白提取试剂盒和RIPA裂解液(上海碧云天生物技术有限公司),SDS-PAGE凝胶配制试剂盒(美国Sigma公司),β-actin、小鼠抗人Bcl-2抗体、小鼠抗人Bax抗体和小鼠抗人caspase-3抗体(美国BD公司),AnnexinⅤ-FITC/PI凋亡检测试剂盒(上海贝博生物试剂公司)。倒置显微镜(日本奥林巴斯公司),FACS Calibur型流式细胞仪(美国BD公司)。
1.2 细胞株培养于液氮中取出冻存的胃癌细胞株SGC7901,迅速置于37℃水浴中解冻,置于无菌15 mL离心管中,补加10 mL DMEM培养基后1 000 r·min-1离心5 min。弃上清后补加含有10%胎牛血清和100 U·mL-1青霉素、链霉素的DMEM培养基8 mL,轻轻吹打重悬细胞后转移至25 mL细胞培养瓶中,于37℃、5% CO2细胞培养箱中培养,每2~3d传代1次,传代至第3代用于实验。
1.3 药物分组经预实验,初步确定LBK有效剂量为4 U·mL-1,故本研究选用的蚓激酶低、中和高剂量分别为2、4和8 U·mL-1。
1.4 MTT法检测细胞增殖抑制率取96孔板,将细胞密度稀释至1×105 mL-1,每孔加入200μL,培养24h后,弃去上清。对照组加入培养基,LBK药物组分别加入2、4和8 U·mL-1各200μL,设3个复孔。培养至24、48和72h时,弃去上清,加入MTT(5 g·L-1)20μL,继续培养4h,弃去上清,加入DMSO 150μL,轻轻震荡10 min,待颗粒完全溶解,用酶标仪测定490nm处吸光度[A(490)]值,计算细胞增殖抑制率。细胞增殖抑制率=[1-实验组A(490)值/对照组A(490)值] ×100%。
1.5 细胞划痕实验检测SGC7901细胞迁移距离取对数生长期SGC7901细胞,用不含血清的培养基混悬细胞,将细胞密度稀释至5 ×105 mL-1,接种于6孔细胞培养板,每孔2.0mL。用Marker笔沿着6孔板直径平行等距划线,用于定位,置于37℃、5%CO2培养箱中培养24h,观察细胞融合状态。用200μL微量移液器的吸管垂直于定位横线垂直方向均匀划线,划痕完毕后,用移液器缓慢吸出培养液,用不含血清的培养基洗涤细胞2次,除去细胞碎片。将细胞分为对照组、4 U·mL-1 LBK组和8 U·mL-1 LBK组,每组分别加入培养基、4 U·mL-1 LBK和8 U·mL-1 LBK各2.0mL,培养24和48h,将6孔板置于倒置显微镜下观察结果并拍照,使用Image J软件打开图片后,随机划取6条水平线,测量划痕宽度,取平均值。
1.6 AnnexinⅤ-FITC/PI双染流式细胞术检测细胞凋亡率和细胞周期百分率取细胞悬浮液,加入6孔细胞培养板,培养24h。弃去上清,分为对照组、4 U·mL-1LBK组和8 U·mL-1LBK组,分别加培养基、4U·mL-1LBK和8 U·mL-1LBK各2.0 mL,培养24h后,弃去上清。用冷的PBS洗涤细胞2次,收集细胞,用1×Annexin Ⅴ400μL结合液悬浮细胞,加入Annexin Ⅴ-FITC染色液5μL,轻轻混匀,于2℃~8℃避光条件下孵育15 min。加入10 μL PI染色液后轻轻混匀,2℃~8℃避光条件下孵育5 min,使用流式细胞仪检测细胞凋亡率。细胞凋亡率=早期细胞凋亡率+晚期细胞凋亡率。
取对数生长期的SGC7901,稀释为5×105 mL-1的单细胞悬液,以每孔2mL接种于6孔细胞培养板后,置于37℃、5%CO2培养箱中培养24h。弃掉原孔内培养液,每孔加入1.0mL不同浓度的药物溶液(4和8 U·mL-1LBK),同时设对照组(加培养基),含药培养24h,将细胞置37℃、5%CO2培养箱中孵育。用不含EDTA的胰酶消化细胞,1500 r·min-1离心5 min,离心温度控制在2℃~8℃。用冷的PBS洗涤细胞2次(2℃~8℃,1500 r·min-1离心5 min),收集细胞。加入10μL PI染色液后轻轻混匀,于2℃~8℃避光条件下孵育5 min后使用流式细胞仪检测。计算G1期、S期和G2期细胞百分率。
1.7 Western blotting法检测SGC7901细胞中Bcl-2、Bax和caspase-3蛋白表达水平细胞分组同上,作用48h后,收集细胞,裂解,按照全蛋白提取试剂盒说明书提取蛋白,SDS-PAGE聚丙烯酰胺凝胶电泳(10%分离胶,4%浓缩胶),转膜,室温下5%BSA封闭,加入一抗,4℃孵育过夜。加入辣根过氧化物酶标记的二抗孵育。用Quanlity One分析软件分析目的条带的相对灰度值(以β-actin为内参),以Bax/β-actin表示Bax蛋白表达水平,以Bcl-2/β-actin表示Bcl-蛋白表达水平,以caspase-3/β-actin表示caspase-3蛋白表达水平。
1.8 统计学分析采用Graphpad Prism 5.0软件进行统计学分析。各组细胞增殖抑制率、细胞划痕宽度、细胞凋亡率、不同细胞周期细胞百分率及Bcl-2、Bax和caspase-3蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组SGC7901细胞增殖抑制率药物处理细胞24、48h和72 h后,LBK对细胞增殖均有抑制作用,且呈浓度-时间依赖性。与对照组比较,各剂量LBK组细胞增殖抑制率明显升高(P < 0.01)。见表 1。
| (n=4, x±s, η/%) | |||
| Group | Inhibitory rate of proliferation | ||
| (t/h) 24 | 48 | 72 | |
| Control | 4.26±1.80 | 4.89±1.53 | 5.69±1.78 |
| LBK(U·mL-1) | |||
| 2 | 14.25±2.61* | 21.63±2.65* | 28.49±2.16* |
| 4 | 26.32±3.01* | 35.75±2.96* | 41.26±2.85* |
| 8 | 37.52±2.15* | 51.48±1.95* | 62.59±1.98* |
| *P < 0.01 compared with control group. | |||
细胞培养至48 h,与对照组[(480.0±2.4) μm]比较,4和8 U·mL-1LBK组SGC7901细胞划痕距离[(570.0±3.3)μm和(650.0±5.4)μm]明显增加(P < 0.01)。见图 1。

|
| A:Control group B:4 U·mL-1LBK group; C:8 U·mL-1LBK group. 图 1 各组SGC7901细胞划痕距离(Bar=100 μm) Fig. 1 Migration distances of SGC7901 cells in various groups (Bar=100 μm) |
|
|
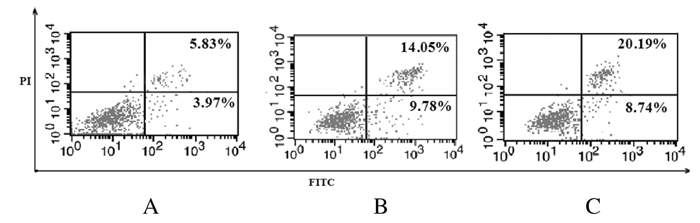
与对照组(9.85%±1.02%)比较,4和8 U·mL-1LBK组细胞凋亡率(23.83%±1.12%和28.93%±1.43%)均明显升高(P < 0.01)。见图 2。
|
| A: Control group; B:4 U·mL-1 LBK group; C: 8 U·mL-1LBK group. 图 2 流式细胞术检测各组SGC7901细胞凋亡率 Fig. 2 Apoptotic rates of SGC7901 cells in various groups detected by flow cytometry |
|
|
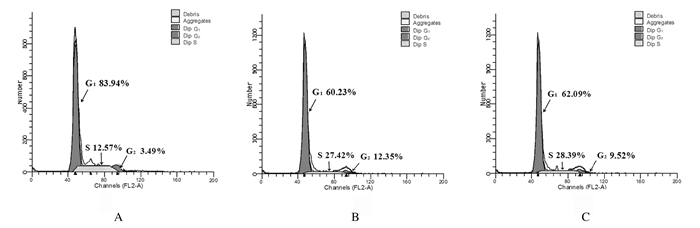
与对照组比较,4和8U·mL-1LBK组SGC7901细胞中G1期细胞百分率明显降低(P < 0.01),S期和G2期细胞百分率明显升高(P < 0.01)。见表 2和图 3。
| (n=4, x±s, η/%) | |||
| Group | Percentage of cells | ||
| G1 | S | G2 | |
| Control | 83.94±2.34 | 12.57±1.09 | 3.49±0.27 |
| LBK(U·mL-1) | |||
| 4 | 60.23±2.10* | 27.42±1.24* | 12.35±1.02* |
| 8 | 62.09±1.78* | 28.39±1.56* | 9.52±1.09* |
| *P < 0.01 compared with control group. | |||
|
| A: Control group; B:4 U·mL-1 LBK group; C: 8 U·mL-1LBK group. 图 3 流式细胞术检测各组SGC7901细胞的细胞周期 Fig. 3 Cell cycle of SGC7901 cells in various groups detected by flow cytometry |
|
|
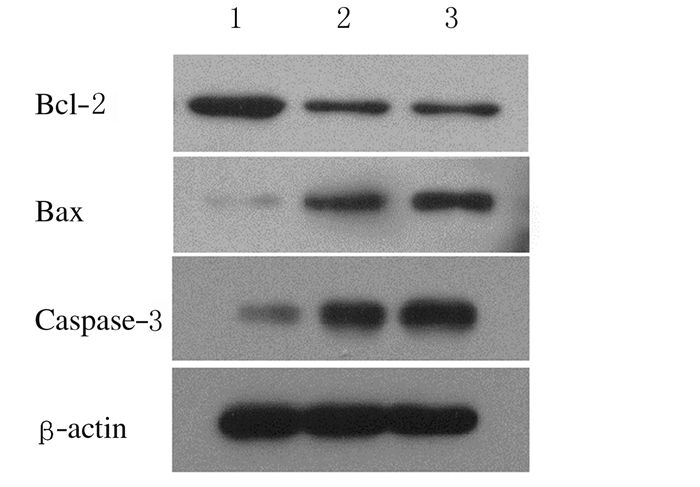
作用48 h后,与对照组比较,4和8 U·mL-1LBK组细胞中Bcl-2表达水平明显降低(P < 0.05),Bax和caspase-3蛋白表达水平明显升高(P < 0.05)。见图 4和表 3。
|
| Lane 1:Control group; Lane 2:4 U·mL-1 LBK group; Lane 3: 8 U·mL-1 LBK group. 图 4 各组SGC7901细胞中Bcl-2、Bax和caspase-3蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of Bcl-2, Bax, and caspase-3 proteins in SGC7901 cells in various groups |
|
|
| (n=4, x±s) | |||
| Group | Protein expression level | ||
| Bcl-2 | Bax | Caspase-3 | |
| Control | 0.95±0.15 | 0.11±0.15 | 0.18±0.15 |
| LBK(U·mL-1) | |||
| 4 | 0.20±0.06* | 0.98±0.53* | 0.65±0.35* |
| 8 | 0.12±0.11* | 0.87±0.15* | 0.98±0.12* |
| *P < 0.01 compared with control group. | |||
蚯蚓提取物具有多种生物学活性。LBK是从鲜蚯蚓体内提取的活性成分,鲜蚯蚓经过炮制后成为中药材地龙。中药的抗肿瘤活性已有报道,中医理论认为LBK主要具有清热解毒、活血化瘀及扶正固本等作用,目前在临床上作为溶栓药物具有良好的活血化瘀功效。本研究旨在揭示LBK对胃癌细胞的增殖抑制作用。JIANG等[16]研究了LBK对急性中危肺血栓栓塞的治疗效果和安全性;LBK结合低分子肝素是治疗急性和中度风险肺血栓栓塞的安全有效的策略[17]。研究[18-19]结果表明:在大鼠颈动脉血栓形成模型中,经腰椎部位给予LBK治疗可改善药代动力学特征,提高抗血栓作用。李洪燕等[20]以人胃腺癌细胞BGC823、乳腺癌细胞MCF7、结肠癌细胞HCT-8、肝癌细胞Bel7402和肺腺癌细胞A549为模型,进行了蚯蚓纤溶酶的抗肿瘤活性研究。
本研究采用MTT法检测LBK对胃癌细胞株SGC7901的增殖抑制作用,结果表明:培养至24h,LBK剂量为2U·mL-1时,对细胞增殖抑制率为14.25%,随着给药剂量增加及培养时间延长,LBK对胃癌细胞株SGC7901增殖抑制作用逐渐增强,培养至72h,当浓度为8U·mL-1时,对细胞增殖抑制率高达62.59%。细胞划痕实验是一种操作简单、经济实惠的研究细胞侵袭的体外试验方法,本研究结果表明:与对照组比较,培养至48h时,剂量为8U·mL-1的LBK能够明显抑制SGC7901细胞的迁移,说明LBK对SGC7901细胞有较强的抑制作用;免疫印迹实验结果显示LBK能明显下调细胞中Bcl-2蛋白表达,上调Bax和caspase-3蛋白表达;流式细胞术观察到LBK作用于SGC7901细胞后,细胞早晚期凋亡率均升高,且呈剂量依赖性,与MTT结果一致;细胞周期检测结果表明:LBK作用于SGC7901细胞24h后,能抑制细胞进入G1期,延长G2期,阻止细胞增殖。
综上所述,LBK对胃癌细胞株SGC7901具有明显的增殖抑制作用,能够诱导细胞凋亡。本研究结果为LBK用于胃癌的治疗研究提供了初步的实验依据,为下一步体内动物实验以及更深入的机制研究奠定了基础。
| [1] | 王雪英, 伍晓斌, 徐凤彩. 蚯蚓纤溶酶的分离纯化及其部分酶学性质的研究[J]. 药物生物技术, 2003, 10(2): 88–91. DOI:10.3969/j.issn.1005-8915.2003.02.006 |
| [2] | 李菁华, 赵伟. 蚯蚓纤溶酶的分离纯化研究[J]. 中国生化药物杂志, 2005, 26(5): 288–291. DOI:10.3969/j.issn.1005-1678.2005.05.011 |
| [3] | 赵晓瑜, 静天玉. 蚯蚓纤溶酶组分的分离纯化和分析[J]. 生物化学与生物物理进展, 2001, 28(2): 218–221. DOI:10.3321/j.issn:1000-3282.2001.02.021 |
| [4] | 李锐, 廖鹏运, 韩燃, 等. 蚯蚓纤溶酶的分离纯化及临床作用研究进展[J]. 经济动物学报, 2012, 16(1): 38–42. DOI:10.3969/j.issn.1007-7448.2012.01.011 |
| [5] | FU T, YANG F, ZHU H, et al. Rapid extraction and purification of lumbrokinase from Lumbricus rubellus using a hollow fiber membrane and size exclusion chromatography[J]. Biotechnol Lett, 2016, 38(2): 251–258. |
| [6] | LAI CH, HAN CK, SHIBU MA, et al. Lumbrokinase from earthworm extract ameliorates second-hand smoke-induced cardiac fibrosis[J]. Environ Toxicol, 2015, 30(10): 1216–1225. DOI:10.1002/tox.v30.10 |
| [7] | HONG C, TAKAHASHI S, IMAMURA M, et al. Earthworm fibrinolytic enzyme:anti-tumor activity on human hepatoma cells in vitro and vivo[J]. Chin Med J, 2007, 120(10): 898–904. DOI:10.1097/00029330-200705020-00009 |
| [8] | 何道伟, 陈洪, 叶银英. 蚯蚓提取物体内和体外抗肿瘤作用的研究[J]. 中国生化药物杂志, 2005, 26(6): 353–355. DOI:10.3969/j.issn.1005-1678.2005.06.011 |
| [9] | 余玲俐, 刘顺会, 徐晓鹏. 蚓激酶抗肺癌细胞A549增殖作用及其机制[J]. 广东药学院学报, 2013, 29(1): 79–82. DOI:10.3969/j.issn.1006-8783.2013.01.019 |
| [10] | WANGER H. Postoperative radiation therapy for patients who have resected non-small cell lung cancer[J]. Hematol Oncol Clin North Am, 2005, 19(2): 283–302. DOI:10.1016/j.hoc.2005.02.006 |
| [11] | 余艳秋, 陈洪, 黄锦, 等. 蚯蚓纤溶酶抑制胃癌细胞株MGC803增殖及诱导凋亡的作用[J]. 东南大学学报:医学版, 2007, 26(1): 10–13. |
| [12] | 陈洪, 沈珊珊, 张治国, 等. 蚯蚓纤溶酶对人肝癌细胞侵袭转移潜能的影响[J]. 江苏医药, 2008, 34(4): 383–385. DOI:10.3969/j.issn.0253-3685.2008.04.021 |
| [13] | ENGELMANN P, KISS J, CSÖNGEI V, et al. Earthworm leukocytes kill HeLa, HEp-2, PC-12 and PA317 cells in vitro[J]. J Biochem Biophys Methods, 2004, 61(1): 215–227. |
| [14] | 陈洪, 余艳秋, 黄锦, 等. 蚯蚓纤溶酶降低胃癌细胞与血管内皮细胞粘附性及CD44v6表达[J]. 中华消化杂志, 2007, 27(10): 682–684. DOI:10.3760/j.issn:0254-1432.2007.10.009 |
| [15] | YASUI W, OUC N, AUNG PP, et al. Molecular-pathological prognostic factors of gastric cancer:a review[J]. Castric Cancer, 2005, 8: 86–94. DOI:10.1007/s10120-005-0320-0 |
| [16] | JIANG G, ZHANG W, PENG M, et al. Effect of lumbrokinase on patients with acute and moderate risk pulmonary thromboembolism[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2017, 42(10): 1156–1162. |
| [17] | AKAZAWA S I, TOKUYAMA H, SATO S, et al. High-pressure tolerance of earthworm fibrinolytic and digestive enzymes[J]. J Biosci Bioeng, 2018, 125(2): 155–159. DOI:10.1016/j.jbiosc.2017.08.011 |
| [18] | JIN M, JIN G, HUANG W, et al. PEGylation of Lumbrokinase improves pharmacokinetics profile and enhances anti-thrombotic effect in a rat carotid artery thrombosis model[J]. Mol Med Rep, 2017, 16(4): 4909–4914. DOI:10.3892/mmr.2017.7171 |
| [19] | WANG Y H, CHEN K M, CHIU P S, et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting TLR4 signaling[J]. J Mol Cell Cardiol, 2016, 99: 113–122. DOI:10.1016/j.yjmcc.2016.08.004 |
| [20] | 李洪燕, 刘悦, 张福荣, 等. 蚯蚓纤溶酶的抗肿瘤作用[J]. 中国药理学通报, 2004, 20(8): 908–910. DOI:10.3321/j.issn:1001-1978.2004.08.019 |
 2019, Vol. 45
2019, Vol. 45


