扩展功能
文章信息
- 章娉, 周佳, 唐焱, 刘红雨
- ZHANG Ping, ZHOU Jia, TANG Yan, LIU Hongyu
- 孕激素受体靶向聚乳酸-羟基乙酸-超顺磁性氧化铁分子探针的制备及其性能
- Preparation of PR-SPIO-PLGA molecular probe and its property
- 吉林大学学报(医学版), 2018, 44(06): 1307-1311
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1307-1311
- 10.13481/j.1671-587x.20180634
-
文章历史
- 收稿日期: 2018-03-28
近年来,随着影像技术的高速发展,单一的影像技术已经不能满足临床需要,多种影像技术结合可以提供更加完整而准确的信息[1]。多功能显像集合了超声、磁共振(magnetic resonance imaging, MRI)和光学等2种或多种成像技术优势,能在解剖、功能及分子水平对病变细胞发生发展与凋亡进行多种模式显示,为临床提供更加完整而准确的生物学信息。有学者[2]制备了一种集多种显像(光学/MRI/ X-ray)与治疗(药物载体)于一体的多功能分子探针,在体外实现了对HeLa细胞的光学、MRI及X-ray多模态成像,但国内关于多功能显像剂的研究[3]尚处于起步阶段。孕酮受体在乳腺癌中的过度表达有利于针对这些受体进行靶向成像。基于孕酮结构的放射性探针可以用来靶向孕激素受体(progesterone receptor,PR)进行乳腺癌成像。目前,将乳腺癌孕激素靶向受体与超声、MRI及光学3种功能纳米探针相结合的研究鲜见报道。本课题组制备了一种PR靶向的包含超顺磁性氧化铁纳米颗粒(super-paramagnetic iron oxide nanoparticles,SPION)及具备液气相转变功能的液态全氟己烷(perfluorohexane, PFP)包裹在高分子材料聚乳酸/羟基乙酸[poly(laetide-co-glycolide acid),PLGA]中,形成了具有超声、MRI及光声3种功能的聚乳酸-超顺磁性氧化铁及PFP(s-PFP/PLGA)纳米颗粒,观察其体外成像效果,为提高肿瘤早期诊断的灵敏度和准确度提供依据。
1 材料与方法 1.1 细胞、主要试剂和仪器T-47d细胞株购自美国Scien Cell公司,L929细胞为本实验室保存。三氯甲烷和甲苯(北京科玺有机溶剂有限公司),MTT试剂盒(武汉博士德公司),PLGA(深圳市博立生物材料有限公司),油酸修饰超顺磁性氧化铁纳米颗粒(北京安唯安实验设备有限公司),PFP(美国Alfa公司),聚乙烯醇(PVA,美国Sigma公司), DiI细胞膜红色荧光探针(上海碧云天生物有限公司)。CO2培养箱和离心机(沈阳精工华之翼机械有限公司),倒置显微镜和透射显微镜(美国Beckman公司),扫描电镜(上海蔡康光学仪器厂),流式细胞仪(德国Partec公司),3.0 TMR仪(美国GE公司),Malvern激光测径仪和DCZ型超声辐照微泡(微球)肿瘤治疗系统(日本Olympus公司),XL2020声振仪、高速分散均质机和液相闪烁计数仪(美国GE公司),机械振荡仪(重庆海扶医疗科技股份有限公司)。
1.2 s-PFP/PLGA纳米颗粒的构建将PLGA-COOH和SPIO按比例溶于三氯甲烷,加入少量PFP,冰浴条件下振荡,加入适量5% PVA液,混匀,加入2%异丙醇,冰浴条件下旋转蒸发1~2 h;双蒸水洗涤、离心、收集,即得到多功能显像剂(s-PFP/PLGA组)。同法制备不含SPIO微球的PFP/PLGA作为对照。PBS设定为空白对照。
1.3 s-PFP/PLGA纳米颗粒的一般特征检测采用光学和透射电镜检测s-PFP/PLGA纳米颗粒形态表现,Malvern激光测径仪测定s-PFP/PLGA纳米颗粒的直径和平均电位。
1.4 细胞毒性实验将s-PFP/PLGA配制为如下浓度:400.0、200.0、100.0、50.0、25.0、12.5、6.3、3.2和1.6 mg·L-1,随后加入至L-929细胞培养液中培养48 h后,加入MTT混合4 h,加入DMSO,采用酶联免疫检测仪测定吸光度(A)值。阴性对照组单纯加入培养液,阳性对照组加入s-PFP/PLGA。计算细胞相对增殖率(RGR),RGR=实验组A值/阴性对照组A值×100%。毒性分为6级:RGR=100%为0级、75%≤RGR<100%为1级、50%≤RGR<75%为2级、25%≤RGR<50%为3级、1%≤RGR<25%为4级、0%≤RGR<1%为5级。
1.5 s-PFP/PLGA纳米颗粒多模态显像 1.5.1 s-PFP/PLGA纳米颗粒的体外MRI将s-PFP/PLGA纳米颗粒与凝胶按1:5比例稀释,振荡摇匀。采用MRI扫描仪扫描,记录样品的T2*W1值。
1.5.2 s-PFP/PLGA纳米颗粒的体外光声成像将s-PFP/PLGA纳米颗粒以PBS液稀释滴于盖玻片上,置于光声成像仪中。以380 nm波长的激光激发,记录光声信号,采集光声成像图,与不含光吸收子的普通高分子显像剂的PBS液作为对照。激光发射过程中,不断提高激发激光能量,直至温敏材料PFP发生液-气相转变,观察该过程中显像剂光声信号、光声成像及超声成像的变化。
1.5.3 s-PFP/PLGA纳米颗粒的体外超声成像分别将浓度为3.125、6.250、12.500、15.000和25.000 g·L-1 s-PFP/PLGA纳米颗粒置入用凝胶(1%)制成的孔洞模型中,以PBS液作为对照。以380 nm波长的激光辐照稀释液,采用高强度聚焦超声(HIFU)对各孔进行扫描,记录图像及回声强度值。
1.6 DiI标记的携PR的多功能分子探针的制备采用碳二亚胺法制备DiI标记的携带PR的多功能分子探针。将s-PFP/PLGA纳米颗粒溶于10 mL 2-(N-吗啉代)乙磺酸(MES)缓冲液中,加入90 mL 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS),4℃下混合2 h,洗涤离心,将颗粒溶于10 mL MES溶液中,随后加入一定量DiI荧光标记的PR,4℃下混合1 h后,洗涤离心即为PR-s-PFP/PLGA。
1.7 细胞寻靶实验观察试剂与细胞的结合情况将DiO绿色荧光标记的T-47d分为靶向显像剂组、非靶向组和空白对照组。37℃条件下反应2 h,洗涤3次,激光共聚焦显微镜观察试剂与细胞的结合情况。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。s-PFP/PLGA纳米颗粒的粒径、平均电位和细胞RGR以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 s-PFP/PLGA纳米颗粒的制备及其物理性质成功制备s-PFP/PLGA纳米颗粒,其内同时包裹Fe3O4和液态PFP。扫描电镜观察可见颗粒形态规则呈球形,大小均匀一致,粒径约为(738.5± 181.2)nm,平均电位为(-15.8±5.7)mV,分散度好,球面欠光滑。原子吸收光谱法测得微球中铁浓度为42.41 mg·L-1。透射电镜下可见颗粒呈球形,外壳中Fe3O4颗粒分布于其中。见图 1。
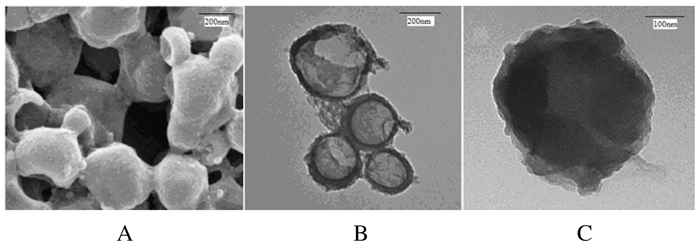
|
| A:Scanning electron microscope; B:Transmission electron microscope; C:Transmission electron microscope of single microsphere. 图 1 扫描电镜和透射电镜下s-PFP/PLGA纳米颗粒的形态表现 Figure 1 Morphology of s-PFP/PLGA nanoparticles under scanning electron microscope and transmission electron microscope |
|
|
不同浓度(400.0、200.0、100.0、50.0、25.0、12.5、6.3、3.2和1.6 mg·L-1)纳米颗粒与乳腺癌细胞作用后,RGR分别为(99.82±12.13)%、(99.49±11.24)%、(99.30±14.07)%、(95.88±12.31)%、(95.59±13.06)%、(92.59±16.12)%、(90.10±13.56)%和(90.09±13.23)%,提示纳米颗粒对乳腺癌细胞毒性小。
2.3 不同浓度s-PFP/PLGA纳米颗粒的体外MRI随着s-PFP/PLGA纳米颗粒中铁浓度的增加,T1加权图像上的信号得到增强,成像图像变得更为亮白,说明样品具有很好的MRI造影增强的效果。见图 2。
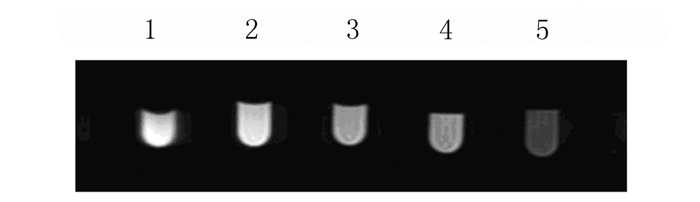
|
| Lane 1:1.00 g·L-1 s-PFP/PLGA; Lane 2:0.50 g·L-1 s-PFP/PLGA; Lane 3:0.10 g·L-1 s-PFP/PLGA; Lane 4:0.05 g·L-1 s-PFP/PLGA; Lane 5:0.01 g·L-1 s-PFP/PLGA. 图 2 不同浓度s-PFP/PLGA纳米颗粒的体外MRI Figure 2 MRI in vitro of s-PFP/PLGA nanoparticles with different concentrations |
|
|
随着s-PFP/PLGA纳米颗粒浓度的增加,其回声强度逐渐升高,造影效果逐渐增强。见图 3(插页六)和图 4。
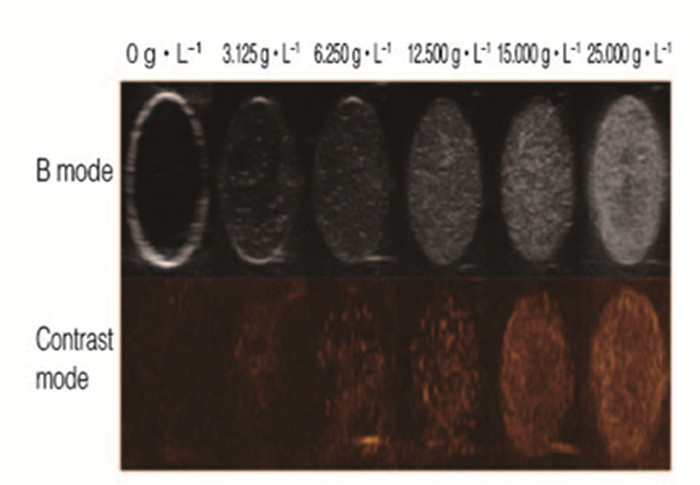
|
| 图 3 不同浓度s-PFP/PLGA纳米颗粒的体外MRI Figure 3 MRI in vitro of s-PFP/ PLGA nanoparticles with different concentrations |
|
|
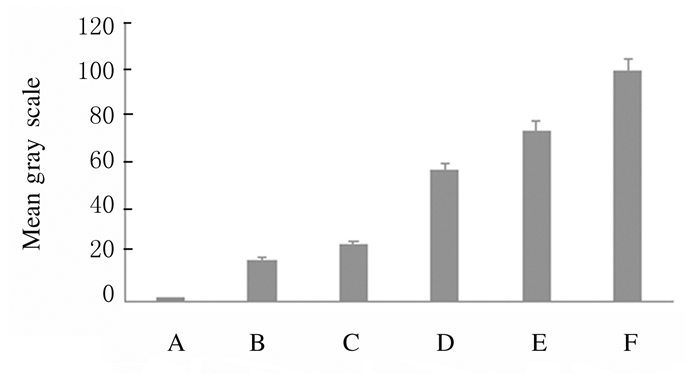
|
| A:0 g·L-1s-PFP/PLGA; B:3.125 g·L-1s-PFP/PLGA; C:6.250 g·L-1s-PFP/PLGA; D:12.500 g·L-1s-PFP/PLGA; E:15.000 g·L-1s-PFP/PLGA; F:25.000 g·L-1s-PFP/PLGA. 图 4 不同浓度s-PFP/PLGA纳米颗粒的回声强度 Figure 4 Echo intensities of s-PFP/PLGA nanoparticles with different concentrations |
|
|
含s-PFP/PLGA颗粒的PBS液检测到明显的光声信号,但不含光吸收子的普通高分子显像剂和PBS液未检测到光声信号。见图 5(插页六)。

|
| A: s-PFP/PLGA nanoparlicles; B: Ordinary polymer imaging agenls; C: PBS. 图 5 s-PFP/PLGA纳米颗粒、普通高分子显像剂和PBS的体外光声成像 Figure 5 Photoacoustic imaging in vitro of s-PFP/PLGA nanoparticles, ordinary polymer imaging agents and PBS |
|
|
空白对照组细胞膜基本无红色荧光,非靶向组可见少量红色荧光,而靶向显像剂组可见大量红色荧光,说明多功能分子探针可以结合PR受体阳性的乳腺癌。见图 6(插页六)。

|
| A-C: DiO staining; D-F: DiL staining; G-I: Merged; A, D, G: Control group; B, E, H: Non-targeted group; C, F, I: Targeted imaging agent group. 图 6 细胞寻粗实验检测各组试剂与细胞的结合情况 Figure 6 Binding of reagents to cells in various groups detected by cell targeting test |
|
|
乳腺癌是女性最常见的恶性肿瘤之一,给妇女的身心造成严重的伤害。研究[4-5]显示:部分乳腺癌患者低表达PR,该类肿瘤高度恶性,发展迅速,复发率高,较早转移,预后不良。
随着生物工程的发展,纳米技术靶向药物技术逐渐成熟[6]。Xu等[7]将纳米颗粒与PFOB融合,从而使超声和CT成像增强,并对裸鼠移植瘤具有光热治疗作用。但如何制备一种多功能显像剂材料使之具备多种临床功能,并将之与靶向治疗的功能相结合是尚需要攻克的科研难点。
s-PFP/PLGA纳米颗粒是一种新型材料,直径小、可修饰性强,超顺磁性强、灵敏度高、靶向性好,毒性低、半衰期较长[9-10]。PLGA是一种可降解的高分子物质,几乎无毒,生物相容性好、成囊和成膜性能强大,并且可以溶解于多种有机溶剂,已经用于造影剂的制备,造影剂的外壳抗压性较强[11-12]。另一种核心材料PFP表面张力低、绝缘性好、各项性质比较安全、无毒性,在各种刺激下可发生液气相转变[13]。
PFP与水不相容,两者声阻抗不匹配,因此在常温下可以检测到s-PFP/PLGA纳米颗粒强回声,具有增强超声造影的作用[14-15]。本研究制备的s-PFP/PLGA纳米颗粒在HIFU辐照后显影增强,这可能是因为PFP介质受热局部温度升高,当温度达到液态氟碳相变阈值时发生液-气相转变,微粒变为微泡,增强散射信号而增强超声显影[16]。SPIO在外加磁场作用下能明显缩短横向驰豫时间(T2),是一种较理想的MRI阴性对比剂。本研究结果表明:随着s-PFP/PLGA纳米颗粒中铁浓度的增加,T1加权图像上的信号得到增强,成像图像变得更为亮白,这与其他研究者[17]的研究结果基本一致,与其他材料比较,本实验采用PLGA作为壳膜材料使制备的造影剂更为稳定。
SPIO是一种特殊材料,可以吸附激光,SPIO微粒在激光的照射下导致微粒温度升高,微粒随之膨胀,引起光声信号,信号辐射后经一系列处理,可用于光声学成像[18]。本研究结果表明:s-PFP/PLGA纳米颗粒在激光照射后可产生光声信号。目前对于乳腺癌的无创治疗成为研究的热点。结合了多功能颗粒和PR靶向的探针,集超声-核磁-光热治疗于一体,在消灭癌细胞的同时还可以动态地监测患者的临床疗效[19]。多功能探针与乳腺癌细胞的靶向结合体外试验表明制备的探针具有靶向能力,这与其他研究[20]的结果一致。但本研究结论尚需体内实验进一步确认。
综上所述,本研究制备的集超声-核磁-光热治疗于一体的PR靶向探针生物性能良好,靶向性强。
| [1] | Muthiah M, Park IK, Cho CS. Surface modification of iron oxide nanoparticles by biocompatiblepolymers for tissue imaging and targeting[J]. Biotechnol Adv, 2013, 31(8): 1224–1236. DOI:10.1016/j.biotechadv.2013.03.005 |
| [2] | 章娉, 唐焱, 周佳. 荧光原磁共振双功能纳米探针标记乳腺癌细胞[J]. 河南外科学杂志, 2017, 23(3): 5–8. |
| [3] | Luo B, Zhang H, Liu X, et al. Novel DiR and SPIO nanoparticles embedded PEG-PLGA nanobubbles as a multimodalimaging contrast agent[J]. Biomed Mater Eng, 2015, 26(Suppl1): S911–916. |
| [4] | 刘英, 毛艳, 曹伟红, 等. PR在Luminal B HER2(-)腋窝淋巴结阴性乳腺癌中的预后价值[J]. 中华内分泌外科杂志, 2017, 11(2): 101–105. |
| [5] | 楼立新, 王荣飞, 林恒军, 等. 46例乳腺癌组织Ki-67表达与ER、PR、CerbB-2表达水平、临床病理特征及5年生存率关系的回顾性分析[J]. 中国医刊, 2017, 52(4): 40–43. DOI:10.3969/j.issn.1008-1070.2017.04.014 |
| [6] | 杨蕊梦, 唐文洁, 韦敏燕, 等. 双靶点磁性、荧光双模态分子探针的制备及对乳腺癌体外靶向结合的可行性[J]. 中华放射学杂志, 2016, 50(1): 41–46. |
| [7] | Xu H, Aguilar ZP, Yang L, et al. Antibody conjugated magnetic iron oxide nanoparticles for cancer cell separation in fresh whole blood[J]. Biomaterials, 2011, 32(36): 9758–9765. DOI:10.1016/j.biomaterials.2011.08.076 |
| [8] | 杨蕊梦, 李楠楠, 张黎明, 等. 肿瘤CD44受体靶向性超顺磁性氧化铁-透明质酸分子探针的构建及体外靶向作用[J]. 中华放射学杂志, 2014, 6(5): 363–368. DOI:10.3760/cma.j.issn.1005-1201.2014.05.003 |
| [9] | Gun S, Edirisinghe M, Stride E. Encapsulation of superparamagnetic iron oxide nanoparticles inpoly-(lactide-co-glycolic acid) microspheres for biomedical applications[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(6): 3129–3137. DOI:10.1016/j.msec.2013.03.001 |
| [10] | 冯凌云, 张宝林, 赵方圆. 超顺磁性纳米Fe3O4的热分解法制备及表征[J]. 高分子材料科学与工程, 2012, 28(8): 144–147. |
| [11] | 王军, 张宝林, 赵方圆, 等. 聚乙二醇/聚乙烯亚胺修饰的超顺磁性氧化铁磁共振造影剂的性能[J]. 材料研究学报, 2013, 27(5): 508–514. |
| [12] | Li N, Huang GW, Shen XJ, et al. Controllable fabrication and magnetic-field assisted alignment of Fe3O4-coated Ag nanowires via a facile co-precipitation method[J]. J Mater Chem C Mater, 2013, 1(32): 4879–4884. DOI:10.1039/c3tc30270a |
| [13] | 涂志江, 张宝林, 冯凌云, 等. 聚乙二醇/聚乙烯吡咯烷酮修饰的纳米Fe3O4粒子的制备与表征[J]. 化工学报, 2013, 63(12): 4089–4095. |
| [14] | Li Z, Yi PW, Sun Q, et al. Ultrasmall water-soluble and biocompatible magnetic iron oxide nanoparticles as positive and negative dual contrast agents[J]. Adv Funct Mater, 2012, 22(11): 2387–2393. DOI:10.1002/adfm.v22.11 |
| [15] | Zhao X, Zhao H, Chen Z, et al. Ultrasmall superparamagnetic iron oxide nanoparticles for magnetic resonance imaging contrast agent[J]. J Nanosci Nanotechnol, 2014, 14(1): 210–220. DOI:10.1166/jnn.2014.9192 |
| [16] | 杨蕊梦, 唐文洁, 韦敏燕, 等. 双靶点磁性、荧光双模态分子探针的制备及对乳腺癌体外靶向结合的可行性[J]. 中华放射学杂志, 2016, 50(1): 41–46. DOI:10.3760/cma.j.issn.1005-1201.2016.01.010 |
| [17] | Situ JQ, Wang XJ, Zhu XL, et al. Multifunctional SPIO/DOX-loaded A54 homing peptide functionalized Dextran-g-PLGA micelles for tumor therapy and MR imaging[J]. Sci Rep, 2016, 24(6): 35910. |
| [18] | Niu C, Wang Z, Lu G, et al. Doxorubicin loaded superparamagnetic PLGA-iron oxide multifunctional microbubbles for dual-mode US/MR imaging and therapy of metastasis in lymph nodes[J]. Biomaterials, 2013, 34(9): 2307–2317. DOI:10.1016/j.biomaterials.2012.12.003 |
| [19] | Sun Y, Zheng Y, Ran H, et al. Superparamagnetic PLGA-iron oxide microcapsules for dual-modality US/MR imaging and high intensity focused US breast cancer ablation[J]. Biomaterials, 2012, 33(24): 5854–5864. DOI:10.1016/j.biomaterials.2012.04.062 |
| [20] | 李奥, 王志刚, 吴伟, 等. 载Fe3O4液态氟碳纳米粒增强磁共振成像的实验研究[J]. 中国医学影像技术, 2011, 27(3): 453–456. |
 2018, Vol. 44
2018, Vol. 44


