扩展功能
文章信息
- 王雪婷, 周广宇, 王艺璇, 郭莹, 尹敏, 吴晨
- WANG Xueting, ZHOU Guangyu, WANG Yixuan, GUO Ying, YIN Min, WU Chen
- 贝前列素钠联合免疫抑制剂治疗原发性肾病综合征的疗效和安全性评价
- Efficacy and evaluation on safety of beraprost sodium combined with immunosuppressor in treatment of primary nephrotic syndrome
- 吉林大学学报(医学版), 2018, 44(06): 1291-1297
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1291-1297
- 10.13481/j.1671-587x.20180631
-
文章历史
- 收稿日期: 2017-10-25
2. 吉林省长春市人民医院肾内科, 吉林长春 130051
2. Department of Nephrology, People's Hospital, Changchun City, Jilin Province, Changchun 130051, China
原发性肾病综合征(primary nephrotic syndrome, PNS)患者血液常呈高凝状态,长期反复应用糖皮质激素(glucocorticoid, GC)会加重PNS患者的高凝状态,导致患者出现血栓栓塞并发症,影响治疗效果,增加PNS患者的病死率及致残率[1]。因此除免疫调节治疗外,有针对性的抗凝或抗血小板等对症治疗同样是PNS治疗的关键。研究[2-3]证实前列腺素类药物(prostaglandins, PGs)在PNS的治疗方面有较好的疗效,贝前列素钠(beraprost sodium, BPS)是全球首个化学结构稳定的前列环素(postacyclin I2, PGI2)前体药物的口服制剂,具有与PGI2相似的药理作用,有抗血小板聚集、扩张血管、改善微循环、提高红细胞变形及抗炎的作用。BPS逐渐在肾脏疾病等领域的治疗中发挥重要作用,但目前国内外尚无关于BPS用于PNS治疗的相关研究。本研究首次对BPS联合GC和(或)免疫抑制剂治疗PNS的疗效和安全性进行评价,为BPS治疗PNS提供临床证据及新的治疗方案。
1 资料与方法 1.1 一般资料选取2014年9月—2016年1月于吉林大学中日联谊医院肾内科住院并明确诊断为PNS的患者86例。纳入标准:符合PNS的临床诊断标准;年龄≥18岁;3个月内未应用过GC或免疫抑制剂;无重金属、有机溶剂等接触史;依从性好。排除标准:过敏性紫癜肾炎、乙型肝炎病毒相关性肾炎、系统性红斑狼疮肾炎、糖尿病肾病、骨髓瘤性肾病、淋巴瘤及药物因素等所致的继发性肾病综合征;心理障碍或精神疾病者;严重心脏、消化、血液、内分泌及神经系统疾病;结核等感染性疾病及其他出血性疾病者;孕妇及哺乳期妇女;激素使用不规范患者;不接受随访的患者。
1.2 分组根据2组患者病理分型及2014年《中国成人肾病综合征免疫抑制治疗专家共识》[4],制订免疫抑制治疗方案后,由医生依次向患者介绍抗血小板聚集治疗药物,根据患者意愿自行选择并完成分组。患者分为BPS组[应用BPS联合GC和(或)免疫抑制剂进行治疗]和对照组(采用双嘧达莫或阿司匹林联合GC或免疫抑制剂进行治疗)。纳入患者12个月均坚持用药,无退出病例。
1.3 检测指标记录患者年龄、病程、血压和治疗前后24 h尿蛋白定量、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、白蛋白(albumin,ALB)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、红细胞压积(hematocrit, HCT)、空腹血糖(fasting blood glucose, FBG)、血小板计数(platelet, PLT)、凝血酶原时间、纤维蛋白原(fibrinogen, FIB)、D-二聚体(D-two polymer, DD)、血清肌酐(serum creatinine, Scr)和病理类型[包括膜性肾病(membranous nephropathy,MN)、微小病变肾病(minimal-change disease, MCD)、IgAN肾病、局灶节段性肾小球硬化(facal segmental glomerular sclerosis, FSGS)、微灶性肾小球肾病(mesangiocapillary glomerulonephrits, MCGN)]等,上述指标均由吉林大学中日联谊医院检验科测定。根据MDRD公式计算患者肾小球滤过率(GFR)。MDRD公式:GFR(mL·min-1·1.73 m-2)= 175×(Scr-1.234)×(年龄-0.179)×0.79(女性)。
1.4 治疗方案所有患者根据病情选择单用GC、他克莫司、环磷酰胺治疗或GC联合他克莫司/环磷酰胺治疗的方案:① GC治疗方案,给予甲泼尼龙40 mg每日1次静脉滴注,出院后改为每日甲泼尼龙40 mg口服,足量甲泼尼龙治疗6~8周后开始逐渐减量,每2~3周减至原用量的10%。最小维持量为0.4~0.5 mg·kg-1·d-1,持续约6个月。②他克莫司治疗方案,给予他克莫司0.05~0.10 mg·kg-1·d-1,分2次间隔12 h,空腹服用,维持血药谷浓度为5~10 μg·L-1,根据血药浓度调整他克莫司剂量,至少应用6个月;③环磷酰胺治疗方案,给予环磷酰胺400 mg每周1次静推,连用2周后改为环磷酰胺片50 mg,每日1次口服,直到累积量达到6~8 g;④ BPS治疗方案,120 μg·d-1,三餐后口服,连续服用6个月;⑤对照组患者抗血小板治疗方案,阿司匹林100 mg·d-1,每日1次,或双嘧达莫75 mg·d-1,每日3次,均为空腹服用,连续服用6个月;⑥抗凝治疗方案,ALB低于20 g·L-1或MN患者给予低分子肝素钙抗4 100 IU,每日1次皮下注射,疗程视病情而定;⑦其他治疗方案,血压>140/90 mmHg患者同时应用ARB类、CCB类或二者联合的降压治疗方案;所有患者均给予他汀类药物降脂治疗;水肿患者给予间断利尿或间断利尿联合间断输注白蛋白等对症治疗。
1.5 随访所有患者均于治疗后1、2、3、6和12个月时定期通过医院复诊或电话进行随访,记录相关复查实验室指标。记录治疗期间患者出现的并发症及药物不良反应发生率。
1.6 治疗反应评价根据随访6个月时的实验室指标,将治疗反应分为:①完全缓解(complete remission, CR)组,治疗后24 h尿蛋白≤0.3 g,Scr和ALB在正常范围内;②部分缓解(partial remission, PR)组,在肾功能稳定的前提下,24 h尿蛋白为0.3~3.5 g,且下降的幅度超过基础值的50%;③未缓解(no remission, NR)组,24 h尿蛋白下降的幅度不超过基础值的50%,或者24 h尿蛋白≥3.5 g,或者Scr上升的幅度超过基础值的50%。复发:已获得CR或PR的患者,重新出现24 h尿蛋白定量≥3.5 g,并持续1周。总有效率=(CR患者数+PR患者数)/总患者数×100%。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。2组患者年龄、病程、血压、24 h尿蛋白定量、ALT、ALB、TC、TG、HCT、PLT、FBG、凝血酶原时间、FIB、DD、Scr和GFR以x±s表示,两组间样本均数比较采用t检验,多组间样本均数比较采用单因素方差分析;组间病理类型比例、药物应用比例、缓解率、总有效率、复发率、患者病理类型、治疗方案构成比和不良反应发生率组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组患者基线临床资料2组患者年龄、病程、治疗前24 h舒张压(systolic blood pressure, SBP)、收缩压(diastolic blood pressure,DBP)、24 h尿蛋白定量、ALT、ALB、TC、TG、HCT、PLT、FBG、凝血酶原时间、FIB、DD、Scr、GFR和病理类型等比较差异均无统计学意义(P>0.05)。见表 1。
| Group | n | Gender (Male/Female) |
Age (year) | Time of onset (t·m-1) |
SBP (P/mmHg) |
DBP (P/mmHg) |
24 h urine protein (g·d-1) | ALT [λB/(IU·L-1)] |
Serum ALB [ρB/(g·L-1)] |
TC [cB/(mmol·L-1)] |
TG [cB/(mmol·L-1)] |
HCT (η/%) |
PLT (×109 L-1) |
FBG [cB /(mmol·L-1)] |
Thrombin time (t/s) |
FIB [ρB/(g·L-1)] |
DD [ρB/(mg·L-1)] |
Scr [cB/(μmol·L-1)] |
GFR (mL·min-1·1.73 m-2) | Renal biopsy patient[n (η/%)] | MN [n (η/%)] |
MCD [n (η/%)] |
IgAN [n (η/%)] |
FSGS [n (η/%)] |
MCGN [n (η/%)] |
| Control | 44 | 32/12 | 45.05±4.02 | 3.84±0.80 | 144.10±12.73 | 90.08±11.09 | 9.64±1.42 | 29.80±2.46 | 20.72±0.98 | 9.31±0.72 | 3.08±0.31 | 0.41±0.04 | 192.13±44.2 | 5.74±0.68 | 19.63±0.83 | 4.30±0.71 | 2.48±0.65 | 103.56±46.72 | 76.56±19.01 | 29 (65.91) | 13 (29.55) | 7 (15.91) | 6 (13.64) | 2 (4.55) | 1 (2.27) |
| BPS | 42 | 28/14 | 49.32±3.80 | 3.82±0.86 | 144.32±10.64 | 90.12±10.87 | 9.21±1.30 | 30.83±2.27 | 19.93±1.26 | 10.81±0.55 | 3.04±0.29 | 0.42±0.05 | 189.12±41.3 | 5.89±0.79 | 20.85±0.81 | 4.29±0.67 | 2.54±0.58 | 105.76±37.35 | 75.48±18.89 | 30 (71.43) | 15 (35.71) | 8 (19.05) | 4 (9.52) | 2 (4.76) | 1 (2.38) |
2组患者均根据病情选择GC和(或)免疫抑制剂治疗,同时给予抗凝、降压、降脂、利尿、补钙及保护胃黏膜等治疗。86例PNS患者中单用激素者39例(45.35%),单用他克莫司者9例(10.47%),单用环磷酰胺者3例(3.49%),采用激素联合免疫抑制剂者35例(40.70%)。BPS组和对照组患者治疗方案构成比比较差异均无统计学意义(P>0.05)。见表 2。
| [n (η/%)] | |||||||||
| Group | n | GC alone | Tacrolimus alone | Cyclophosphamide alone | GC and immunosuppressives | Low molecular weight heparin | ARBs | Calcitriol | Statins |
| Control | 44 | 19 (43.18) | 4 (9.09) | 2 (4.55) | 19 (43.18) | 38 (86.36) | 28 (63.64) | 38 (86.36) | 44 (100.00) |
| BPS | 42 | 20 (47.62) | 5 (11.90) | 1 (2.39) | 16 (38.10) | 34 (80.95) | 30 (71.43) | 36 (85.71) | 42 (100.00) |
经过6个月的随访,BPS组和对照组患者的总有效率分别为92.86%和72.73%,组间比较差异有统计学意义(P<0.05);BPS患者未缓解率(7.14%)低于对照组(27.27%),组间比较差异有统计学意义(P<0.05)。见表 3。
| [n (η/%)] | ||||||
| Group | n | CR | PR | NR | TR | Recrudesce |
| Control | 44 | 17 (38.64) | 15 (34.09) | 12 (27.27) | 32 (72.73) | 5 (11.36) |
| BPS | 42 | 17 (40.47) | 22 (52.38) | 3 (7.14) | 39 (92.86) | 3 (7.14) |
| χ2 | 0.154 | 2.932 | 6.047 | 6.047 | 0.454 | |
| P | 0.695 | 0.087 | 0.014 | 0.014 | 0.501 | |
与治疗前比较,2组患者治疗后24 h尿蛋白、血清ALB、Scr、GFR、TC和TG均有不同程度的改善。见表 4。
| Group | 24 h urine protein(g·d-1) | Serum ALB [ρB/(g·L-1)] |
Scr [cB/(μmol·L-1)] |
GFR (mL·min-1·1.73m-2) |
TC [cB /(mmol·L-1)] |
TG [cB /(mmol·L-1)] |
| Control | ||||||
| Before treatment | 9.64±1.42 | 20.72±2.98 | 103.56±46.72 | 76.56±19.01 | 9.31±0.72 | 3.08±0.31 |
| 1 month after treatment | 7.95±2.99* | 22.06±3.95 | 97.72±30.01 | 83.13±21.22 | 7.65±1.63* | 2.10±0.71* |
| 2 months after treatment | 4.29±3.53* | 27.96±4.34* | 93.66±23.55 | 84.65±22.06 | 6.43±1.45△ | 2.03±0.68* |
| 3 months after treatment | 2.91±2.08* | 31.41±4.90* | 82.29±22.70 | 96.35±25.64 | 5.75±1.32△ | 1.92±0.50* |
| 6 months after treatment | 2.24±1.37* | 32.18±3.56* | 76.59±19.33* | 103.52±29.01* | 5.48±1.01△ | 1.77±0.65* |
| 12 months after treatment | 0.97±0.91* | 40.87±6.40* | 77.33±19.20* | 102.53±32.43* | 4.22±1.22△ | 1.62±0.55△ |
| BPS | ||||||
| Before treatment | 9.21±1.30 | 19.93±1.26 | 105.76±37.35 | 75.48±18.89 | 10.81±0.55 | 3.04±0.29 |
| 1 months after treatment | 4.34±4.92*△ | 27.18±2.99*△ | 98.05±35.21 | 81.54±20.46 | 7.72±1.86* | 2.08±0.68* |
| 2 months after treatment | 2.68±3.80* | 32.68±3.06* | 90.45±30.11 | 89.88±21.68 | 5.71±1.28* | 1.68±0.79* |
| 3 months after treatment | 2.09±1.97* | 34.55±4.21* | 75.03±22.26* | 107.85±28.60* | 5.25±1.63* | 1.59±0.61* |
| 6 months after treatment | 1.06±1.28*△ | 38.67±3.29*△ | 75.51±18.50* | 106.82±26.64* | 4.04±0.94*△ | 1.51±0.51* |
| 12 months after treatment | 0.45±0.34* | 41.54±4.84* | 72.14±15.34* | 112.13±30.68* | 3.98±0.62* | 1.35±0.60* |
| * P < 0.05 compared with before treatment in the same group; △ P < 0.01 compared with control group at the same time point. | ||||||
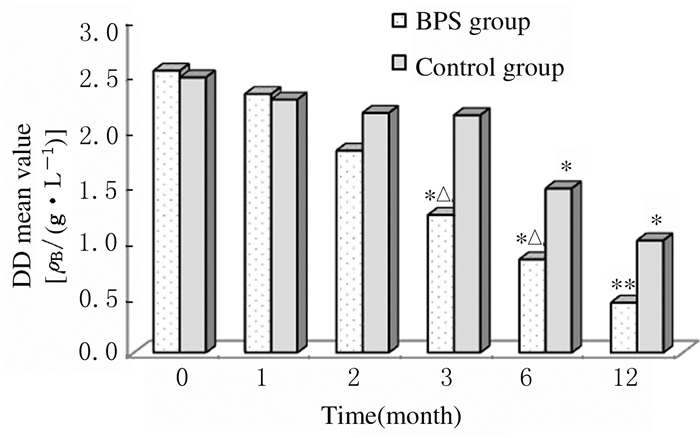
BPS组患者治疗3、6和12个月时FIB和DD水平明显降低,与治疗前比较差异有统计学意义(P<0.05或P<0.01);对照组患者治疗6和12个月时FIB和DD水平明显降低,与治疗前比较差异有统计学意义(P<0.05);治疗3和6个月时,与随访同期对照组比较,BPS组患者FIB和DD水平明显降低(P<0.05)。见图 1和2。

|
| *P < 0.05, **P < 0.01 compared with before treatment(0 month); △P < 0.05 compared with control group. 图 1 2组患者治疗前后FIB水平 Figure 1 FIB levels of patients in two groups before and after treatment |
|
|
|
| *P < 0.05, **P < 0.01 compared with before treatment (0 month); △P < 0.05 compared with control group. 图 2 2组患者治疗前后DD水平 Figure 2 DD levels of patients in two groups before and after treatment |
|
|
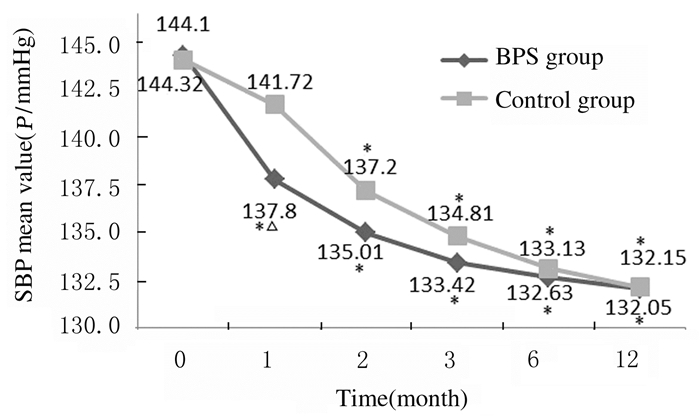
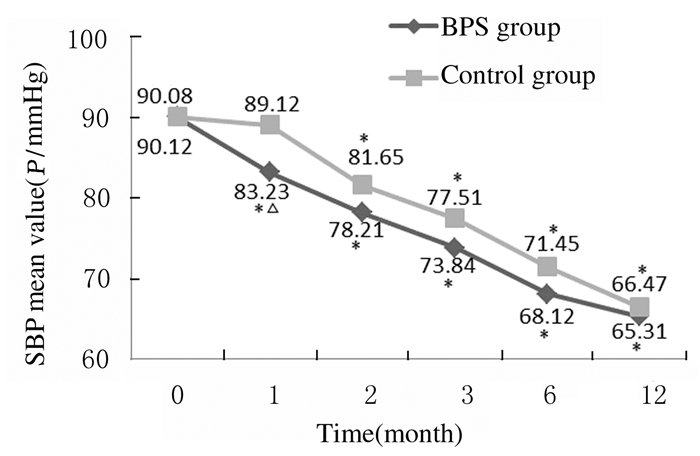
2组患者于治疗后出现不同程度的血压降低。其中治疗1和2个月时BPS组患者SBP和DBP明显降低,与治疗前比较差异均有统计学意义(P<0.05);治疗1个月时BPS组患者SBP和DBP明显低于同期对照组(P<0.05)。2组患者治疗2、3、6和12个月时DBP和SBP比较差异均无统计学意义(P>0.05)。见图 3和4。
|
| *P < 0.05 compared with before treatment(0 month); △P < 0.05 compared with control group. 图 3 2组患者治疗前后SBP水平 Figure 3 SBP levels of patients in two groups before and after treatment |
|
|
|
| *P < 0.05 compared with before treatment(0 month); △P < 0.05 compared with control group. 图 4 2组患者治疗期间DBP水平 Figure 4 DBP levels of patients in two groups before and after treatment |
|
|
2组患者治疗过程中均无出血性疾病、心肌梗死和间质性肺炎等严重情况的发生。与对照组比较,BPS组基础血压正常患者的血压升高发生率明显降低(P < 0.05),头晕和头痛发生率升高(P < 0.05)。2组患者并发症和不良反应发生率见表 5。
| [n (η/%)] | ||||||||||||||
| Group | n | Infection | Thromboembolism | Acute renal injury | Blushing | Headache and dizziness | Palpitation | Hepatic lesion | Elevating blood glucose | Elevating blood pressure | Hypotension | Gastrointestinal discomfort | Gastrointestinal bleeding | Osteoporosis |
| Control | 44 | 10(22.73) | 2(4.55) | 1(2.27) | 1(2.27) | 1(2.27) | 2(4.55) | 2(4.55) | 3(6.82) | 4(9.09) | 0 | 7(15.91) | 2(4.55) | 8(18.18) |
| BPS | 42 | 8(19.05) | 1(2.38) | 1(2.38) | 5(11.90) | 6(14.29)* | 5(11.90) | 2(4.76) | 2(4.76) | 0* | 0 | 5(11.90) | 0 | 7(16.67) |
| *P < 0.05 compared with control group. | ||||||||||||||
迄今为止,PNS治疗方案仍以GC和细胞毒药物等抑制免疫与炎症反应治疗为主,同时给予抗凝及抗血小板治疗以改善PNS患者的血液高凝状态。BPS是血栓素A2(thromboxane A2,TXA2)的生理性拮抗剂,其化学结构稳定[5];作为PGs家族的重要成员,BPS可以与细胞膜表面前列环素受体(prostacyclin receptor, IP)结合,激活cAMP/PKA信号途径,抑制细胞中Ca2+内流等,发挥抑制血小板聚集和扩张血管的作用,并通过调节血管活性因子的平衡,减轻内皮细胞损伤,同时还有抑制炎症因子表达、弱降压及抗细胞增殖等作用[6-7]。BPS可降低尿毒症患者毒素,提高肾小球血流量而不影响肾小球滤过,达到轻度改善肾小球性高血压的作用[8-9]。BPS在肾功能受损患者中并无肾脏相关的药代动力学改变,所以肾功能不全患者应用时不必调整BPS剂量[10],这使其在肾脏疾病的治疗中具有更大优势。
本研究首次观察了BPS联合GC和(或)免疫抑制剂对PNS的疗效及安全性。本研究结果表明:在免疫抑制治疗的基础上,应用BPS较传统抗血小板药物可以更有效地提高PNS治疗的缓解率和缓解速度,降低蛋白尿水平,改善患者的肾功能,且疗效优于传统抗血小板药物。Koyama等[11]观察了16例口服BPS的慢性肾脏病(CKD)患者的有效肾血浆流量,明确了BPS可通过减少CKD患者肾小球入球和出球小动脉的血管阻力以调节肾血流量,改善肾小球球内压,减少肾小球高滤过,从而减缓肾功能损害进展。研究[12]证明:BPS可抑制氧化应激反应,避免氧自由基诱导的肾小球损伤,维持肾小球基底膜完整性等作用,有利于保护肾功能和延缓肾脏病进展。本研究结果证实:BPS具有减少蛋白尿、延缓肾小球硬化、提高肾小球血流量和改善肾功能的作用,其辅助GC和(或)免疫抑制剂治疗可获得更好的PNS缓解率和更快的缓解速度,疗效优于GC和(或)免疫抑制剂联合传统抗血小板药物。
PNS患者血液常处于高凝状态,研究[13]显示:TC水平异常升高往往与PNS患者蛋白尿水平高密切相关,而血脂的异常升高可使PNS患者的肾功能进行性下降,加速血管内皮损伤、动脉粥样硬化及血栓的发生[14]。FIB和DD水平的升高反映体内存在高凝及继发性纤溶活性增强,其与静脉血栓的发生密切相关[15]。本研究结果显示:治疗后BPS组患者TC、TG、FIB和DD水平较对照组下降得更快,表明BPS联合GC和(或)免疫抑制剂治疗可更快和更好地改善PNS患者的血液高凝状态,优于传统抗血小板药物。陈怡等[16]给予CKD患者前列地尔联合BPS序贯治疗14周,发现该治疗方法可减少尿白蛋白排泄率,改善GFR,同时FIB和DD均较治疗前有明显降低,但PLT计数较治疗前均无明显差异。该研究结果与本研究结果基本一致,分析其可能的原因为:BPS联合GC和(或)免疫抑制剂治疗可促使PNS疾病更快缓解,因此有利于PNS患者高凝状态更快地改善;与传统抗血小板药物比较,BPS可更有效地改善血液高凝状态。目前PNS经典的抗血小板聚集药物以阿司匹林和双嘧达莫为主。阿司匹林抗血小板治疗会使消化性溃疡和出血等并发症的发生率增加2倍[17]。双嘧达莫在治疗PNS时需加大药物剂量至200~300 mg·d-1才起到抗凝效果,而药物剂量过大易引起严重头痛,出血增加,甚至中断治疗。Yamada等[18]研究肾功能不全大鼠模型时发现:BPS可有效阻止尿蛋白、Scr、BUN升高和GFR降低,但双嘧达莫则无抑制Scr升高和改善肾功能的作用。这个差异考虑可能与BPS较传统的抗血小板药物能更有效地改善PNS血液高凝状态、降低尿蛋白、改善肾小球高滤过状态、从而延缓肾功能进展有关。本研究中,与传统抗血小板药物比较,BPS改善高凝状态效果更好,虽然组间血栓栓塞发生率比较差异无统计学意义,但较对照组有减少的趋势,考虑可能与纳入试验的样本量较小有关,故BPS对于降低血栓栓塞并发症的疗效尚需进一步研究证实。本研究中BPS的不良反应中仅头痛头晕不良反应的发生率较传统抗血小板药物有所增加,但其他不良反应均较轻微,且无严重不良反应发生,考虑本药在临床应用中安全性较高,耐受性尚可。
研究[19]显示:长期应用GC的患者多会表现出一定程度的血压升高。本研究结果显示:BPS具有一定程度的降压作用,这与以往的文献[20]报道一致。治疗后对照组中4例血压升高者均为应用GC的患者,而BPS组患者未出现血压升高,考虑治疗过程中对照组患者血压的升高与GC有关,且BPS可能在一定程度上抵消GC引起的血压升高;其机制考虑为BPS通过改善肾小球滤过功能、减轻水钠潴留、保护血管内皮细胞和舒张血管等作用,拮抗了GC对血管内皮细胞的不利影响及血管平滑肌对缩血管物质的高反应性,并抵消了GC降低PGs的作用,最终协同GC疗效,降低GC引起的高血压不良反应的发生,优于传统的抗血小板药物。同时因FIB与高血压患者血压水平呈正相关关系,考虑BPS有明确的改善血液高凝状态和优化血管舒缩的功能,同样是改善血压的重要因素[21]。目前尚未见类似文献报道与本研究相似结果,尚需大样本量的深入临床研究以证实。
综上所述,BPS联合激素和(或)免疫抑制剂治疗可明显降低PNS患者尿蛋白水平,升高血清ALB水平,提高PNS治疗的总缓解率,明显改善PNS患者血液高凝状态,优于传统抗血小板药物;BPS联合降压治疗可早期改善PNS患者的高血压,并可能在一定程度上抵消GC对PNS患者血压的影响。但本研究纳入的患者未全部行病理检查,尚不足以用来分析BPS对不同病理类型PNS患者的疗效,故需进一步对比研究BPS对不同病理类型PNS患者的疗效差异。期待通过该领域的深入研究,进一步证实BPS可提高PNS的疗效,减少并发症发生,降低GC等药物的不良反应,从而更好地将BPS应用于PNS患者。
| [1] | 王海燕. 肾脏病学[M]. 3版. 北京: 人民卫生出版社,2008: 269-948. |
| [2] | 韩世盛, 卢嫣, 王怡. 前列腺素E1治疗原发性肾病综合征的系统评价[J]. 中国中西医结合肾病杂志, 2014, 15(8): 721–724. DOI:10.3969/j.issn.1009-587X.2014.08.023 |
| [3] | Cooper LT. Beraprost for the treatment of intermittent claudication[J]. J Am CollCardiol, 2003, 41(10): 1687–1689. DOI:10.1016/S0735-1097(03)00308-5 |
| [4] | 中国成人肾病综合征免疫抑制治疗专家组. 中国成人肾病综合征免疫抑制治疗专家共识[J]. 中华肾脏病杂志, 2014, 30(6): 467–474. DOI:10.3760/cma.j.issn.1001-7097.2014.06.014 |
| [5] | Awsakulsutthi S, Punpho K, Mamom J, et al. Beraprost sodium for chronic diabetic foot ulcer:a randomized controlled trial in thammasat university hospital[J]. Ann Vasc Dis, 2014, 7(1): 40–45. DOI:10.3400/avd.oa.13-00092 |
| [6] | Guan J, Long L, Chen YQ, et al. Effects of beraprostsodium on renal function and inflammatory factors of rats withdiabetic nephropathy[J]. Genet Mol Res, 2014, 13(2): 4154–4158. DOI:10.4238/2014.June.9.1 |
| [7] | Watanabe M, Nakashima H, Mochizuki S, et al. Amelioration of diabetic nephropathy in OLETF rats by prostaglandin I2 analog, beraprost sodium[J]. Am J Nephrol, 2009, 30(1): 1–11. DOI:10.1159/000195722 |
| [8] | Ohba Y, Matsuyama Y, Suzuki K, et al. Beraprost improves renal function and decreases uremic toxin in renal insufficiency[J]. Nihon JinzoGakkai Shi, 2015, 57: 487. |
| [9] | Takenaka M, Iio A, Sato R, et al. A double-blind, placebo-controlled, multicenter, prospective randomized study of beraprost sodium treatment for cats with chronic kidney disease[J]. J Vet Intern Med, 2018, 32(1): 236–248. DOI:10.1111/jvim.14839 |
| [10] | Shimamura M, Miyakawa J, Doi M, et al. The pharmacokinetics of beraprost sodium following single oral administration to subjects with impaired kidney function[J]. J Clin Pharmacol, 2017, 57(4): 524–535. DOI:10.1002/jcph.v57.4 |
| [11] | Koyama A, Fujita T, Gejyo F, et al. Orally active prostacyclin analogue beraprost sodium in patients with chronic kidney disease:a randomized, double-blind, placebo-controlled, phase Ⅱ dose finding trial[J]. BMC Nephrol, 2015, 16: 165. DOI:10.1186/s12882-015-0130-5 |
| [12] | Peng L, Li J, Xu Y, et al. The protective effect of beraprost sodium on diabetic nephropathy by inhibiting inflammation and p38 MAPK signaling pathway in high-fat diet/streptozotocin-induced diabetic rats[J]. Int J Endocrinol, 2016, 2016: 1690474. |
| [13] | Vaziri ND. Molecular mechanisms of lipid disorders in nephroticsyndrome[J]. Kidney Int, 2003, 63(5): 1964–1976. DOI:10.1046/j.1523-1755.2003.00941.x |
| [14] | Hillege HL, Fidler V, Diercks GF, et al. Urinary albumin excretion predicts cardiovascular and noncardiovascular mortality in general population[J]. Circulation, 2002, 106(14): 1777–1782. DOI:10.1161/01.CIR.0000031732.78052.81 |
| [15] | Cushman M, Folsom AR, Wang L, et al. Fibrin fragment D-dimer and the risk of future venous thrombosis[J]. Blood, 2003, 101(4): 1243–1248. DOI:10.1182/blood-2002-05-1416 |
| [16] | 陈怡, 万建新, 江德文, 等. 前列地尔联合贝前列素钠序贯治疗慢性肾脏病[J]. 南方医科大学学报, 2013, 33(10): 1521–1524. |
| [17] | Hiraishi H, Maeda M, Sasai T, et al. Strategy to manage low dose aspirin-induced gastrointestinal injury[J]. Nippon Rinsho, 2011, 69(2): 369–375. |
| [18] | Yamada M, Sasaki R, Sato N, et al. Amelioration by beraprost sodium, a prostacyclin analogue, of established renal dysfunction in rat glomerulonephritis model[J]. Eur J Pharmacol, 2002, 449(1/2): 167–176. |
| [19] | Nootheti S, Bielory L. Risk of cataracts and glaucoma with inhaled steroid use in children[J]. Compr Ophthalmol Update, 2006, 7(1): 31–39. |
| [20] | Goto Y, Yamaguchi S, Tamura M, et al. A prostacyclin analog prevents the regression of renal microvascular network by inhibiting mitochondria-dependent apoptosis in the kidney of rat progressive glomerulonephritis[J]. Prostaglandins Other Lipid Mediat, 2014, 112: 16–26. DOI:10.1016/j.prostaglandins.2014.06.001 |
| [21] | 鱼建平. 缬沙坦联合贝前列素钠对高血压合并早期肾损伤患者肾功能、凝血功能以及内皮损伤的影响[J]. 海南医学院学报, 2016, 22(24): 58–61. |
 2018, Vol. 44
2018, Vol. 44


