扩展功能
文章信息
- 王嘉欣, 武宁, 金顺子, 王彦君, 张萱
- WANG Jiaxin, WU Ning, JIN Shunzi, WANG Yanjun, ZHANG Xuan
- 人血浆抗谷胶蛋白抗体与不同年龄段精神分裂症患者发病的关联性
- Associations between human plasma anti-gliadin antibodies and occurrence of schizophrenia in patients with different ages
- 吉林大学学报(医学版), 2018, 44(06): 1263-1268
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1263-1268
- 10.13481/j.1671-587x.20180626
-
文章历史
- 收稿日期: 2018-03-21
2. 吉林大学中日联谊医院放疗科, 吉林 长春 130033;
3. 吉林大学公共卫生学院卫生部放射生物学重点实验室, 吉林 长春 130021
2. Department of Radiotherapy, China-Japan Union Hospital, Jilin University, Changchun 130033, China;
3. Key Laboratory of Radiobiology Research, Ministry of Health, School of Public Health, Jilin University, Changchun 130021, China
精神分裂症属于多基因遗传疾病,疾病易感基因本身并不能单独致病,需要与环境因素共同作用而诱发疾病[1]。2018年Belbasis等[2]对精神分裂症的危险因素及外周生物标记物进行伞状综述,确定98个相关因素与精神分裂症发病有关联,其中小麦中的谷胶蛋白是一种重要的环境风险因子,可能通过诱发自身免疫性反应导致脑组织损伤,从而诱发精神分裂症[3]。有学者[4]发现小麦面筋的主要成分谷蛋白与精神分裂症有密切关系,控制精神分裂症患者摄入富含谷蛋白的食品可明显改善其精神症状[5]。近期研究[6]显示:谷胶蛋白结合谷氨酸受体,可作为研究精神分裂症动物模型的新途径。
已有报道[7]证实:精神分裂症患者人血浆抗谷胶蛋白抗体水平明显高于正常人,并且首发精神分裂症患者体内IgA和IgG抗体水平高于多次发作精神分裂症患者。本课题组前期已经对于谷胶蛋白与精神分裂症发病的关系进行研究[8],发现中国北方汉族精神分裂症患者人血浆抗谷胶蛋白IgA抗体阳性率明显升高,与国外相关研究[9-10]结论一致,30%的精神分裂症患者抗谷胶蛋白IgG抗体水平升高[11],证实谷胶蛋白是诱发精神分裂症的环境风险因子。但精神分裂症主要在青少年和成年早期起病。40岁前后患者的患病率达到高峰,此后逐渐降低[12]。因此考虑环境风险因子谷胶蛋白可能与不同年龄段精神分裂症患者的发病有关联。
本研究采用大样本病例-对照关联研究方法收集315例中国北方汉族精神分裂症患者和健康对照者462人的全血样品,分离血浆,采用酶联免疫吸附试验(ELISA)法检测人血浆抗谷胶蛋白IgA和IgG抗体水平。采用Mann-Whitney U检验比较不同年龄段精神分裂症患者和健康对照者人血浆抗谷胶蛋白IgA和IgG抗体水平。进一步探讨人血浆抗谷胶蛋白IgA和IgG抗体与不同年龄段中国北方汉族人群精神分裂症发病的关系。
1 资料与方法 1.1 研究对象所有研究对象均为中国北方汉族人,313例精神分裂症患者(精神分裂症组)为2016年1月—2018年1月吉林省长春市心理医院住院患者,平均年龄(37.10±12.36)岁。①纳入标准:所有纳入对象均经2名经验丰富的临床医师按照《国际疾病分类标准第10版(ICD-10)》精神分裂症诊断标准确诊为精神分裂症。②排除标准:有严重脑器质性与严重躯体疾病、酒精或药物依赖者、药物过敏、妊娠或哺乳期妇女;③本研究获得患者或监护人知情同意。健康对照者408人(健康对照组),平均年龄(40.48±13.17)岁,来源于吉林大学第二医院的工作人员和健康献血者,身体健康,无严重的躯体疾病,无精神疾病及精神疾病家族史。临床资料的评定参照精神科评定量表,根据研究需要设计一系列代表疾病症状的变量。由主管医师根据患者的病史资料记录详细情况,建立临床表型数据库。
1.2 样本的收集和保存采集精神分裂症患者与健康对照者外周静脉血5 mL,分离血浆,-80℃分装保存。
1.3 人血浆抗谷胶蛋白IgA和IgG抗体水平检测采用中国EUROIMMUN公司的抗谷胶蛋白IgA和IgG抗体ELISA试剂盒进行检测。采用Curve Expert 1.3软件根据标准品制作抗体水平标准曲线,在标准曲线上按照点对点的方式,应用对应的吸光度(A)值计算每份血浆样本中抗体相对水平(RU·mL-1)。根据试剂盒的诊断标准:< 25 RU·mL-1为抗体水平阴性,≥25 RU·mL-1为抗体水平阳性。
1.4 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组研究对象抗谷胶蛋白IgA和IgG抗体水平与年龄的相关性分析采用Pearson’s相关分析法;由于抗体水平表达不服从正态分布,故不同年龄段精神分裂症组和健康对照组研究对象人血浆抗谷胶蛋白IgA和IgG抗体水平两两比较采用Mann-Whitney U检验。人血浆抗谷胶蛋白IgA和IgG抗体水平在精神分裂症患者诊断中的价值应用受试者工作特征(ROC)曲线进行分析,以ROC曲线下面积(AUC)作为评价诊断价值的指标。以P < 0.05为差异有统计学意义。
2 结果 2.1 人血浆抗谷胶蛋白IgA和IgG抗体水平与研究对象年龄的相关性本研究检测了313例精神分裂症患者和408名健康对照者人血浆抗谷胶蛋白IgA和IgG抗体水平。分析了人血浆抗谷胶蛋白IgA和IgG抗体水平与研究对象年龄和不同年龄段(< 20岁, 20~30岁, 30~40岁, 40~50岁, 50~60岁, >60岁)的相关性,结果显示:人血浆抗谷胶蛋白IgA抗体水平与研究对象年龄和年龄段呈正相关关系(r=0.177, P < 0.01;r=0.171, P < 0.01),人血浆抗谷胶蛋白IgG抗体水平与研究对象年龄和年龄段呈负相关关系(r=-0.104,P < 0.01; r=-0.127, P < 0.01)。见表 1。
| Antibody | Age | Age range | |||
| r | P | r | P | ||
| IgA | 0.177 | 0.000 | 0.171 | 0.000 | |
| IgG | -0.104 | 0.005 | -0.127 | 0.001 | |
比较2组不同年龄段研究对象人血浆抗谷胶蛋白IgA抗体水平,Mann-Whitney U检验结果显示:与健康对照组比较,精神分裂症组患者人血浆抗谷胶蛋白IgA水平明显升高(P=0.001),精神分裂症组20~30岁患者人血浆抗谷胶蛋白IgA抗体水平明显升高(P < 0.01),50~60岁患者人血浆抗谷胶蛋白IgA水平升高(P=0.029),其余年龄段2组研究对象人血浆抗体水平比较差异无统计学意义(P>0.05)。见表 2。
| (x±s, RU·mL-1) | |||||||||
| Group | n | Level of anti-gliadin IgA antibody | Level of anti-gliadin IgA antibody | ||||||
| Age(year) < 20 | 20-30 | 30-40 | 40-50 | 50-60 | >60 | Total | |||
| Healthy control | 408 | 11.35±12.06 | 11.11±20.09 | 18.69±22.46 | 16.68±21.14 | 18.21±23.27 | 40.23±55.81 | 17.20±25.08 | |
| Schizophrenia | 313 | 21.67±32.24 | 23.17±26.82 | 19.24±31.59 | 23.86±31.24 | 31.72±57.29 | 89.30±134.76 | 25.38±42.80 | |
| Z | -0.287 | -3.746 | -0.048 | -1.598 | -2.186 | -0.945 | -3.349 | ||
| P | 0.774 | 0.000 | 0.962 | 0.110 | 0.029 | 0.360 | 0.001 | ||
比较2组不同年龄段研究对象人血浆抗谷胶蛋白IgG抗体水平,Mann-Whitney U检验结果显示:与健康对照组比较,精神分裂症组20~30岁患者人血浆抗谷胶蛋白IgG抗体水平升高,但组间比较差异无统计学意义(P>0.05)。见表 3。
| (x±s, RU·mL-1) | ||||||||
| Group | n | Level of human plasma anti-gliadin IgG antibody | Level of human plasma anti-gliadin IgG antibody | |||||
| Age(year) < 20 | 20-30 | 30-40 | 40-50 | 50-60 | >60 | Total | ||
| Healthy control | 408 | 22.25±29.29 | 18.30±30.01 | 16.23±23.70 | 9.63±11.09 | 15.47±24.29 | 12.76±18.55 | 15.12±23.23 |
| Schizophrenia | 313 | 21.34±43.09 | 25.08±32.11 | 16.39±24.49 | 17.17±26.77 | 9.66±11.10 | 14.62±16.29 | 18.28±27.79 |
| Z | -0.687 | -1.809 | -0.469 | -1.015 | -0.900 | 0.777 | -0.939 | |
| P | 0.492 | 0.070 | 0.639 | 0.310 | 0.368 | 0.780 | 0.348 | |
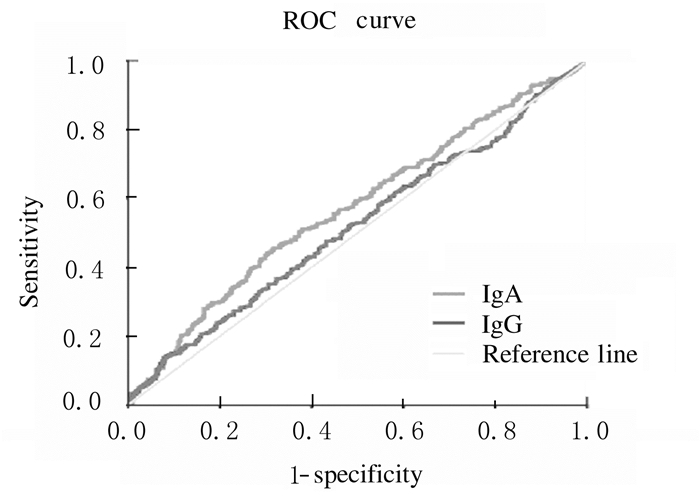
ROC曲线分析结果显示:人血浆抗谷胶蛋白IgA和IgG抗体水平的AUC分别为0.573(SE=0.022, 95%CI:0.53~0.62)和0.520(SE=0.022, 95%CI:0.48~0.56),在特异度为92.2%时灵敏度分别为13.7%和12.8%。ROC曲线分析结果显示:精神分裂症组患者人血浆抗谷胶蛋白IgA抗体水平在精神分裂症中的诊断价值优于IgG抗体水平。见表 4和图 1。
| Antibody | AUC | SE | 95%CI | Sensitivity (η/%) |
| IgA | 0.573 | 0.022 | 0.53-0.62 | 13.7 |
| IgG | 0.520 | 0.022 | 0.48-0.56 | 12.8 |
|
| 图 1 人血浆抗谷胶蛋白IgA和IgG抗体水平诊断精神分裂症的ROC曲线 Figure 1 ROC curves of human plasma anti-gliadin IgA and IgG antibody levels in diagnosis of schizophrenia |
|
|
本研究结果显示:人血浆抗谷胶蛋白IgA和IgG抗体水平与患者年龄存在相关性。人血浆抗谷胶蛋白IgA抗体与患者年龄和年龄分段呈正相关关系,人血浆抗谷胶蛋白IgG抗体与年龄和年龄分段呈负相关关系。因存在相关性,本研究定量比较了2组不同年龄段研究对象人血浆抗谷胶蛋白IgA和IgG抗体水平,与健康对照组比较,精神分裂症组20~30岁年龄段和50~60岁年龄段患者人血浆抗谷胶蛋白IgA抗体水平升高。与健康对照组比较,精神分裂症组20~30岁患者人血浆抗谷胶蛋白IgG抗体水平升高。ROC曲线分析结果显示人血浆抗谷胶蛋白IgA抗体水平在精神分裂症中的诊断价值优于IgG抗体。因此人血浆抗谷胶蛋白抗体水平升高与不同年龄段精神分裂症患者发病密切相关,人血浆抗谷胶蛋白抗体在精神分裂症年轻亚组中可能发挥重要作用。
近年来,国内外研究[13-15]表明精神分裂症患者存在某种免疫功能紊乱。精神分裂症是一种复杂和多因素的精神障碍,具有明确的症状和终身过程,但目前为止其发病的病因机制尚不明确。越来越多的证据表明:免疫和炎症反应可能在精神分裂症发生发展过程中发挥重要作用,本文作者观察到人血浆抗谷胶蛋白IgA和IgG抗体在精神分裂症患者中存在免疫水平改变,并且抗体水平与年龄有相关性。
在分组研究中,本文作者发现:人血浆抗谷胶蛋白IgA抗体阳性存在于20~30岁和50~60岁患者中,而精神分裂症组20~30岁患者人血浆抗谷胶蛋白IgG抗体水平高于其他年龄段患者。研究[12]显示:精神分裂症主要在青少年和成年早期起病,40岁前后患者的患病率达到高峰,此后逐渐降低。这一发现与以前的研究[16-17]结论一致,发现精神分裂症组患者抗谷胶蛋白IgA抗体阳性率明显升高,证实谷胶蛋白是诱发精神分裂症的环境风险因子。近期研究[2, 18]表明:精神分裂症患者免疫功能和炎症状态均有所改变,但并非所有患者的外周抗体均持续升高,提示抗体水平的升高可能仅存在于亚组中。研究[19]显示:约30%的精神分裂症患者IgG型抗球蛋白抗体水平升高,提示人血浆抗谷胶蛋白抗体水平升高与不同年龄段精神分裂症患者发病有密切关联,人血浆抗谷胶蛋白抗体在精神分裂症年轻亚组中可能发挥重要作用。
人血浆抗谷胶蛋白抗体在精神分裂症年轻亚组中可能发挥重要作用,考虑原因可能为:①精神分裂症年轻亚组患者的免疫功能优于年老组,因此体内抗体水平高;②精神分裂症年轻亚组患者中,服用抗精神分裂症的药物时间短,抗体未被药物作用降低;③对于精神分裂症抗体检测研究应首选首发精神分裂症患者,这样对于抗体因素影响较少。
本研究结果与本课题组前期研究[8]一致,大量临床研究[10, 20-21]同时证实精神分裂症患者抗谷胶蛋白抗体水平升高。在以往研究的基础上进一步分析发现人血浆中抗谷胶蛋白抗体水平升高与不同年龄段精神分裂症患者发病密切相关,人血浆抗谷胶蛋白抗体在精神分裂症年轻亚组中可能发挥重要作用。提示首发或年轻的精神分裂症患者比多次发作或年龄大的患者体内的IgA和IgG抗体水平更高。本研究存在一定的局限性,20~30岁精神分裂症患者数相对较少,以后应进一步扩大样本量并在收集样本时注意纳入首发精神分裂症患者。
| [1] | van Os J, Rutten BP, Myin-Germeys I, et al. Identifying gene-environment interactions in schizophrenia:contemporary challenges for integrated, large-scale investigations[J]. Schizophr Bull, 2014, 40(4): 729–736. DOI:10.1093/schbul/sbu069 |
| [2] | Belbasis L, Köhler CA, Stefanis N, et al. Risk factors and peripheral biomarkers for schizophrenia spectrum disorders:an umbrella review of meta-analyses[J]. Acta Psychiatr Scand, 2018, 137(2): 88–97. DOI:10.1111/acps.2018.137.issue-2 |
| [3] | Proepper C, Johannsen S, Liebau S, et al. Abelson interacting protein 1(Abi-1) is essential for dendrite morphogenesis and synapseformation[J]. EMBO J, 2007, 26(5): 1397–1409. DOI:10.1038/sj.emboj.7601569 |
| [4] | Dohan FC, Grasberger JC. Relapsed schizophrenics:earlier discharge from the hospital after cereal-free, milk-free diet[J]. Am J Psychiatry, 1973, 130(6): 685–688. DOI:10.1176/ajp.130.6.685 |
| [5] | Kalaydjian AE, Eaton W, Cascella N, et al. The gluten connection:the association between schizophrenia and celiac disease[J]. Acta Psychiatr Scand, 2006, 113(2): 82–90. DOI:10.1111/acp.2006.113.issue-2 |
| [6] | Garcia-Quintanilla A, Miranzo-Navarro D. Extraintestinal manifestations of celiac disease:33-mer gliadin binding to glutamate receptor GRINA as a new explanation[J]. Bioessays, 2016, 38(5): 427–439. DOI:10.1002/bies.201500143 |
| [7] | Dickerson F, Stallings C, Origoni A, et al. Markers of gluten sensitivity and celiac disease in recent-onset psychosis and multi-episode schizophrenia[J]. Biol Psychiatry, 2010, 68(1): 100–104. DOI:10.1016/j.biopsych.2010.03.021 |
| [8] | 王嘉欣, 武宁, 杜伟利, 等. 人血浆抗谷胶蛋白IgA和IgG抗体与精神分裂症发病及临床表型的关联性分析[J]. 吉林大学学报:医学版, 2014, 40(5): 1051–1057. |
| [9] | Reichelt KL, Landmark J. Specific IgA antibody increases in schizophrenia[J]. Biol Psychiatry, 1995, 37(6): 410–413. DOI:10.1016/0006-3223(94)00176-4 |
| [10] | Cascella NG, Kryszak D, Bhatti B, et al. Prevalence of celiac disease and gluten sensitivity in the United States clinical antipsychotic trials of intervention effectiveess study population[J]. Schizophr Bull, 2011, 37(1): 94–100. DOI:10.1093/schbul/sbp055 |
| [11] | Gaston F, Cihakova D, Talor MV, et al. Antigliadin Antibodies (AGA IgG) Are Related to Neurochemistry in Schizophrenia[J]. Front Psychiatry, 2017, 19(8): 104. |
| [12] | Charlson FJ, Ferrari AJ, Santomauro DF, et al. Global Epidemiology and Burden of schizophrenia:Findings from the global burden of disease study 2016[J]. Schizophr Bull, 2018, 44(6): 1195–1203. DOI:10.1093/schbul/sby058 |
| [13] | Chew LJ, Fusar-Poli P, Schmitz T, et al. Oligodendroglial alterations and the role of microglia in white matter injury:relevance to schizophrenia[J]. Dev Neurosci, 2013, 35(2/3): 102–129. |
| [14] | Erta M, Quintana A, Hidalgo J. Interleukin-6, a major cytokine in the central nervous system[J]. Int J Biol Sci, 2012, 8(9): 1254–1266. DOI:10.7150/ijbs.4679 |
| [15] | Ayhan SS, Oztürk S, Erdem A, et al. Relation of neutrophil/lymphocyte ratio with the presence and severity of coronary artery ectasia[J]. Turk Kardiyol Dern Ars, 2013, 41(3): 185–190. DOI:10.5543/tkda.2013.83030 |
| [16] | Lau MS, Mooney PD, White WL, et al. The role of an IgA/IgG-deamidated gliadin peptide point-of-care test in predicting persistent villous atrophy in patients with celiac disease on a gluten-free diet[J]. Am J Gastroenterol, 2017, 112(12): 1859–1867. DOI:10.1038/ajg.2017.357 |
| [17] | Okusaga O, Yolken RH, Langenberg P, et al. Elevated gliadin antibody levels in individuals with schizophrenia[J]. World J Biol Psychiatry, 2013, 14(7): 509–515. DOI:10.3109/15622975.2012.747699 |
| [18] | Sekar A, Bialas AR, de Rivera H, et al. Schizophrenia risk from complex variation of complement component 4[J]. Nature, 2016, 530(7589): 177–183. DOI:10.1038/nature16549 |
| [19] | Lammers KM, Chieppa M, Liu L. Gliadin induces neutrophil migration via engagement of the formyl peptide receptor, FPR1[J]. PLoS One, 2015, 10(9): e0138338. DOI:10.1371/journal.pone.0138338 |
| [20] | Dohan FC, Martin L, Grasberger JC, et al. Antibodies to wheat gliadin in blood of psychiatric patients:Possible role of emotional factors[J]. Biol Pyschiatry, 1972, 5(2): 127–137. |
| [21] | Jin SZ, Wu N, Xu Q, et al. A study of circulating gliadin antibodies in schizophrenia among a Chinese population[J]. Schizophr Bull, 2012, 38(3): 514–518. DOI:10.1093/schbul/sbq111 |
 2018, Vol. 44
2018, Vol. 44


