扩展功能
文章信息
- 雷晓燕, 孙永红, 陈星星, 高霞, 宋元春, 赛依帕, 刘璟, 袁宏
- LEI Xiaoyan, SUN Yonghong, CHEN Xingxing, GAO Xia, SONG Yuanchun, SAI Yipa, LIU Jing, YUAN Hong
- 乙型肝炎病毒相关性肾小球肾炎患儿血清中HBV-cccDNA水平检测及其临床意义
- Detection of HBV-cccDNA level in children with hepatitis B virus associated glomerulonephritis and its clinical significance
- 吉林大学学报(医学版), 2018, 44(06): 1256-1262
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1256-1262
- 10.13481/j.1671-587x.20180625
-
文章历史
- 收稿日期: 2018-02-08
2. 兰州大学附属第一医院传染病科, 甘肃 兰州 730000
2. Department of Infectious Diseases, First Affliated Hospital, Lanzhou University, Lanzhou 730000, China
乙型肝炎病毒(hepatitis B virus,HBV)复制中间体——闭合环状双链DNA(covalently closed circular DNA,cccDNA)是HBV复制过程中的前基因组RNA模板,其是病毒复制发生的第一步指标。HBV-cccDNA也是引起停药后病毒学反弹的主要因素,有学者[1]已经证实血清中HBV RNA来自感染肝细胞中cccDNA的活性转录,血清中HBV RNA水平能反映肝细胞中cccDNA的状态, 故建议将传统的基于病毒DNA检测的病毒学应答重新定义为血清HBV DNA和RNA的共同持续消失(低于检测下限),并以此作为安全停药的病毒学指标[1]。HBV-cccDNA是目前乙型肝炎病毒研究中的热点DNA,国内外已有多个研究[2-5]对其检测方法及临床意义进行了探讨,但关于血清或肝细胞中HBV-cccDNA是否与HBV感染的严重程度相关,目前尚存在争论。
乙型肝炎病毒相关性肾小球肾炎(hepatitis B virus associated glomerulonephritis,HBV-GN)就是由HBV直接或间接诱发的肾小球肾炎, 也是儿童继发性肾小球肾炎的主要病因之一[6]。目前对于HBV-GN的诊断主要参照全国HBV-GN专题讨论诊断标准(北京)和《小儿肾小球疾病临床分类和肾病综合征治疗方案》中HBV-GN的诊断标准(珠海)[7],其诊断主要依赖肾活检,目前对于儿童HBV-GN的治疗主要以干扰素抗病毒治疗为主。对于药物疗效的观察及其预后评估多依赖于血清HBVDNA水平、丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)水平检测,但是这些项目的测定在HBV-GN的治疗监测方面还不够敏感。因此寻找无创检查,增加对儿童HBV-GN的早期诊断及其抗病毒疗效评估显得尤其重要。由于血清HBV-cccDNA水平检测在儿童HBV-GN诊断中的意义目前报道较少,因此本文作者检测HBV-GN患儿外周血HBV-cccDNA水平,同时对10例明确诊断且规范治疗的患儿进行随访,初步探讨HBV-GN患儿外周血中HBV-cccDNA水平检测的临床意义。
1 资料与方法 1.1 一般资料选取2012年9月—2016年9月甘肃省人民医院儿科和兰州大学附属第一医院感染科明确诊断为HBV-GN的初治39例患儿作为研究对象(观察组),所有患儿均接受肝脏和肾脏穿刺,其中男性23例,女性16例,平均年龄(10.2±5.7)岁。对照组选取肝功能正常HBV携带患儿40例,男性22例,女性18例,平均年龄(10.7± 5.1)岁,所有对照组患儿均未发现血尿及蛋白尿,无血尿素氮(blood urine nitrogen, BUN)及血清肌酐(serum creatinine, Scr)升高,无内生肌酐清除率(creatinine clearance, Ccr)降低等肾损害表现。2组患儿性别和年龄比较差异无统计学意义(P>0.05)。所有肝脏、肾脏活检病例,均向患儿家属告知情况,本研究获得甘肃省人民医院伦理委员会批准同意。
1.2 诊断标准和排除标准HBV-GN诊断标准:参照《儿童常见肾脏疾病诊治循证指南(试行)解读(五)中乙型肝炎病毒相关性肾炎诊断和治疗》[7]中的诊断标准。①血清HBV标志物阳性:大多数为HBsAg、HBeAg和HBcAb同时阳性,少数为HBsAg、HBeAb和HBcAb同时阳性,个别患者血清HBsAg阴性但HBV-DNA阳性;②患肾病或肾炎并除外其他肾小球疾病:大多数表现为肾病综合征,少数表现为蛋白尿和血尿;③肾小球中有1种或多种HBV抗原沉积:大多数有HBsAg、HBcAg或HBeAg在肾小球沉积;④肾脏病理改变:绝大多数为膜性肾病(membranous nephropathy, MN),少数为膜增生性肾炎(membranoproliferative glomerulonephritis, MPGN)和系膜增生性肾小球肾炎(mesaugial proliferative glomerulonephritis, MsPGN)。确诊标准:同时具备上述第①、②和③条依据;同时具备上述第①、②条依据,并且第④条依据中为MN;个别患者具备上述第②、③条依据,血清HBV标志物阴性也可确诊。仅具备第①、②条但不具备③时,不能进行诊断。HBV-GN排除标准:排除其他肝炎病毒感染、自身免疫性肝病、药物性肝损害和酒精性肝损害等肝脏疾病;排除原发性和除肝炎以外的继发性肾脏疾病;排除肾脏肿瘤、多囊肾、孤立肾和泌尿系统结石等疾病;排除膀胱、输尿管、外尿道和外阴疾病。
1.3 实验室指标和HBV-cccDNA水平检测收集本院检验科提供的肝肾功能、HBV五项、HBVDNA滴度测定、尿常规和24 h尿蛋白定量等检测结果,以上检测结果均在治疗前采集外周静脉血完成。BUN>8.2 mmol·L-1为异常, Scr>132 μmol·L-1为异常,ALT>50 U·L-1为异常,AST>40 U·L-1为异常,Ccr < 80 mL·min-1为异常。采用PCR荧光分子信标(试剂盒购自广州蓝星生物科技开发有限公司)技术检测:于清晨采用一次性注射器采血,分离200 μL血清存放于-18℃保存备检,PCR扩增:先取DNA聚合酶1.2 μL加入反应液管内(DNA聚合酶及反应液管用前需短暂离心5 s),然后取处理后的样本上清液、阴性对照上清液及标准品Ⅰ、Ⅱ和Ⅲ各5 μL分别加入反应液管内,混匀后短暂离心5 s,上机扩增。同时设置空白对照管:空白对照只需在反应液管内加入5 μL去离子水,混匀后10 000 r·min-1离心10 s,上机按以下程序扩增:预变性94℃、3 min;循环条件:94℃、35 s,55℃、35 s,72℃、40 s,共循环38次;72℃延伸3 min,28℃保温8 min以上。荧光检测:待各PCR反应液管充分冷却至28℃后短暂离心,置于荧光检测仪,读取并记录荧光值,荧光激发波长为487 nm,检测波长为518 nm。HBV-cccDNA荧光值的计算方法:Ax值=标本或者各对照的荧光值-空白对照的荧光值。Ax值>21判定为阳性,反之判定为阴性。根据HBV-cccDNA水平将39例HBG-GN患儿分为HBV-cccDNA阳性组(24例)和HBV-cccDNA阴性组(15例)。
1.4 患儿肝组织形态表现的观察在B超引导下行肝组织穿刺病理活检,要求肝组织长度>1.0 cm,肝组织经固定、脱水、石蜡包埋、切片后HE染色及网状纤维染色,光镜下观察肝组织形态表现,按照2000年全国病毒性肝炎学术会议修订的标准[8],将肝组织炎症分为G0~G4,纤维化分为S0~S4级。
1.5 患儿肾组织形态表现的观察将经皮肤肾脏穿刺取得的肾组织送至兰州大学医学院病理教研室。光镜观察肾小球的病理改变,电镜观察肾小球的超微结构变化。免疫荧光法检测肾组织中HBsAg、HBeAg和HBcAg检出率,MN患儿肾组织中HBsAg、HBeAg和HBcAg病毒抗原主要沿肾小球毛细血管袢呈颗粒状连续分布。
1.6 HBV-cccDNA诊断价值的评价HBV-cccDNA在HBV-GN中的诊断价值采用受试者工作特征(receiver operating characteristic, ROC)曲线及曲线下面积(area under ROC curve, AUC)进行评价。
1.7 治疗后随访观察组患儿在接收抗病毒治疗后第2、4、8和12周时检测血清HBV DNA和HBV-cccDNA水平、肝肾功能、尿常规及24 h尿蛋白定量。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。HBV-cccDNA阳性组和HBV-cccDNA阴性组患儿血中肝酶(ALT/AST)、HBeAg、血尿、蛋白尿、BUN、Scr和Ccr表达率组间比较采用χ2检验或Fisher确切概率法。以P < 0.05为差异有统计学意义。
2 结果 2.1 HBV-cccDNA阳性和HBV-cccDNA阴性组HBV-GN患儿的肝肾功能指标在不同年龄(≤6岁和>6岁)和不同性别HBV-GN患儿中HBV-cccDNA水平比较差异无统计学意义(P>0.05)。HBV-cccDNA阳性组HBV-GN患儿肝酶(AST/ALT)水平异常率、HBeAg和尿蛋白阳性率均高于HBV-cccDNA阴性组患儿(P<0.05),其余血尿、BUM、Scr及Ccr组间比较差异均无统计学意义(P>0.05), 见表 1。HBV-cccDNA阴性组患儿中有5例无血尿和蛋白尿,其中2例虽无血尿,但患儿有乙肝病史,血清乙肝病毒标志物阳性,病毒低复制,有眼皮水肿、高血压和补体C3降低等急性肾炎表现,排除其他肾脏疾病,肾组织活检为膜增生性肾炎;3例患儿虽无蛋白尿,但有乙肝病史,血清乙肝病毒标志物阳性,病毒复制,有血脂高,双下肢浮肿等肾病综合征表现,排除其他肾疾病,肾组织活检为MN。
| [n(η/%)] | ||||||||
| Group | n | Abnormal AST/ALT | HBeAg(+) | Hematuria (+) | Urine protein(+) | BUN | Scr | Ccr |
| HBV-cccDNA positive | 24 | 13(54.2) | 16(66.7) | 5(20.8) | 19(79.2) | 10(41.7) | 8(33.3) | 3(12.5) |
| HBV-cccDNA negative | 15 | 3(20.0) | 4(26.7) | 4(26.7) | 6(40.0) | 6(40.0) | 4(26.7) | 2(13.3) |
| Total | 16(41.0) | 20(51.3) | 9(3.1) | 25(64.1) | 16(41.0) | 12(30.8) | 5(12.8) | |
| χ2 | 4.454 | 5.912 | 0.177 | 6.154 | 0.011 | 0.193 | 0.006 | |
| P | 0.035 | 0.022 | 0.674 | 0.019 | 0.918 | 0.734 | 1.000 | |
肝组织炎症活动度活跃主要集中在G0~G1,HBV-cccDNA阳性组和HBV-cccDNA阴性组患儿肝组织炎症活动度活跃的病例数分别为18(75.0%)和12(80.0%)例,组间比较差异无统计学意义(P>0.05)。2组患儿中肝组织纤维化分期以S0期为主,HBV-cccDNA阳性组和HBV-cccDNA阴性组HBV-GN患儿S0期病例数分别为13(54.2%)和9(60.0%)例,组间比较差异无统计学意义(P>0.05)。见表 2。
| Group | n | Inflammation degree (G0-4) | Fibrosis degree(S0-4) | |||||||||
| G0 | G1 | G2 | G3 | G4 | S0 | S1 | S2 | S3 | S4 | |||
| HBV-cccDNA positive | 24 | 8 | 10 | 4 | 1 | 1 | 13 | 4 | 2 | 3 | 2 | |
| HBV-cccDNA negative | 15 | 6 | 6 | 2 | 1 | 0 | 9 | 4 | 1 | 1 | 0 | |
| χ2 | 0.925 | 2.095 | ||||||||||
| P | 1.000 | 0.775 | ||||||||||
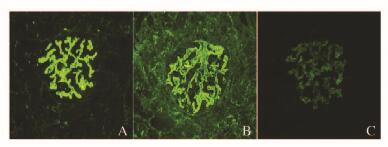
39例HBV-GN患儿经肾脏穿刺活检确诊为HBV-GN,其中32例MN、5例MPGN和2例MsPGN。32例MN患儿中有25例患儿肾小球中检测出HBV抗原,5例MPGN患儿中2例患儿检出HBV抗原,2例MsPGN患儿中未检出HBV抗原,MN患儿中肾小球HBV抗原检出率明显高于MPGN及MsPGN患儿(78.1% vs 28.6% vs 0%,P=0.02)。免疫荧光法检出MN患儿肾组织中有HBsAg、HBeAg和HBcAg阳性形态表现,其中3种病毒抗原主要沿肾小球毛细血管袢呈颗粒状连续分布,见图 1(插页五)。HBV抗原成分的检出以HBeAg和HBcAg为主(表 3)。cccDNA阳性组患儿HBeAg和HBcAg的检出率明显高于HBV-cccDNA阴性组(P < 0.05),2组患儿HBsAg检出率比较差异无统计学意义(P>0.05)。
|
| 图 1 HBV-GN患儿肾组织HBV抗原形态表现(免疫荧光,×400) Figure 1 Morphology of HBV antigens in kidney tissue of HBV-GN patients(Immunofluorescence, ×400) |
|
|
| [n(η/%)] | ||||
| Group | n | HBsAg | HBeAg | HBcAg |
| HBV-cccDNA positive | 24 | 8(33.33) | 21(79.16) | 20(83.75) |
| HBV-cccDNA negative | 15 | 3(20.00) | 8(53.33) | 4(26.67) |
| χ2 | 0.810 | 5.652 | 12.523 | |
| P | 0.477 | 0.027 | 0.001 | |
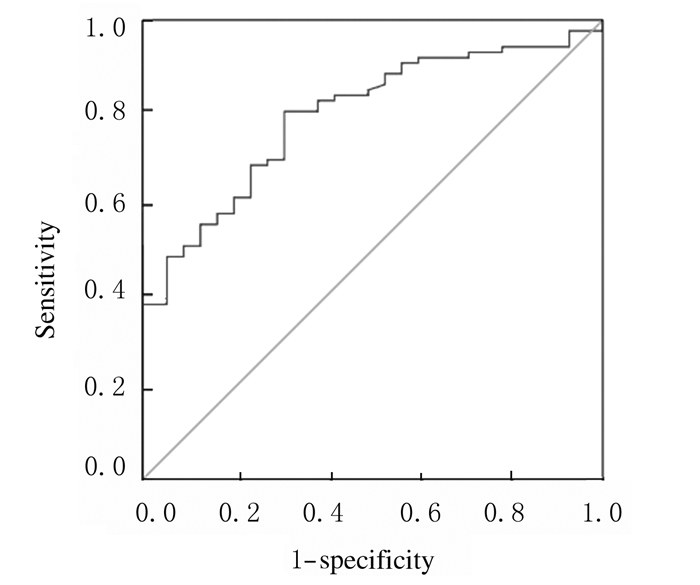
采用ROC曲线评价HBV-cccDNA水平能否作为HBV-GN患儿辅助诊断的一个潜在标志,结果显示:HBV-cccDNA水平检测能有效鉴别观察组和对照组患儿,AUC=0.804(95%CI:0.709~0.883);在血清HBV-cccDNA(log)值为7.6时,其诊断HBV-GN的敏感度和特异度分别为98%和100%。见图 2。
|
| 图 2 HBV-cccDNA诊断HBV-GN的ROC曲线 Figure 2 ROC curve of HBV-cccDNA in diagnosis of HBV-GN |
|
|
39例HBV-GN患儿中规范抗病毒治疗者10例,其中男性8例,女性2例,该10例患儿血中HBeAg均呈阳性,AST水平升高者2例,以肉眼血尿为主要表现者2例,以大量蛋白尿为主要表现者8例,8例MN和2例MPGN患儿均未见肾功能不全。对该10例患儿建立长期随访资料。在抗病毒治疗后2、4、8和12周时检测血清HBV DNA及HBV-cccDNA水平,在治疗前和治疗后第2、4、8、12周时HBVDNA的中位水平分别为6.8、6.5、4.8、3.5和2.5;在治疗前和治疗后第2、4、8、12周时HBV-cccDNA的中位水平分别为5.8、5.0、3.2、2.4和2.0。
治疗至第12周时其中7例患儿HBeAg转阴,无蛋白尿和血尿症状,ACT和AST水平均正常;而3例患儿HBeAg仍呈阳性,尿蛋白持续阳性,继续治疗至6个月,仍无明显改变。治疗无效的3例患儿外周血HBV DNA和HBV-cccDNA水平检测结果显示:治疗前该3例患儿血液标本中HBV-cccDNA水平(7.3、6.8和6.4)均高于其余7例标本(6.2、5.8、5.8、5.2、4.8、4.3和3.8)。在治疗第2周时患儿外周血HBV-cccDNA水平明显降低,且下降速度较HBV DNA快,至治疗12周时HBV-cccDNA下降水平可达2个对数级。
3 讨论HBV-GN是我国儿童常见的继发性肾小球疾病之一,也是儿童期MN的主要原因[9],其发生与HBV感染有密切关系,发病率也大致与HBV感染率平行。而儿童免疫功能尚未发育完善,故HBV-GN发病率明显高于成人[9],其临床表现以不同程度蛋白尿、标志物阳性、镜下血尿及肝肾功能损害为主要特征。2006年我国乙型肝炎流行病学调查[10]结果表明:1~59岁人群HBsAg携带率为7.18%,而其中HBV-GN发生率为6.8%~20.0%。目前对于慢性感染者来讲,抗病毒治疗面临着两个问题:第一,清除细胞质中病毒DNA复制;第二,耗竭细胞核中的HBV-cccDNA。HBV- cccDNA是HBV复制过程中的前基因组RNA模板,国内外多项研究[3, 5, 11-12]结果表明:HBV-cccDNA的复制是HBV持续感染和HBV复制的突出标志,是评价HBV感染状态和药物疗效的重要指标。研究[12-13]显示:血清HBsAg水平与具有转录活性的cccDNA水平密切相关,反映了HBV-cccDNA在肝细胞中的复制情况可作为替代肝组织中HBV cccDNA检测的潜在指标, 但有关HBsAg的转录、调控及清除机制目前尚未阐明,尤其融合在宿主基因组的HBV DNA转录生成HBsAg的调控机制尚有待进一步深入研究。目前对于HBV-cccDNA的研究多集中于HBV-cccDNA的检测及其在慢性乙型肝炎(chronic hepatitis B, CHB)的诊断及抗病毒预后指导方面[14-17],而其对儿童HBV-GN的诊断及治疗价值报道较少。
本研究结果提示:HBV-cccDNA阳性患儿肝酶水平、HBeAg和尿蛋白阳性率均高于HBV-cccDNA阴性患儿,提示HBV-cccDNA的复制水平与患儿肝肾功能的损害有关。本课题组既往研究[18]结果表明:CHB患儿随着病情的加重,HBV-cccDNA检出率升高,HBV-cccDNA的检测结果可以反映该病的严重程度。当肝脏组织处于炎症活动阶段时, 存在于肝细胞质和线粒体中的转氨酶等酶类在肝细胞被破坏时能释放到血液中, 存在于肝细胞核中的HBV-cccDNA在肝细胞变性和坏死时也可以释放到血液中,且病情越严重,变性坏死的细胞越多[19]。由于HBV-cccDNA存在于肝细胞核中,因此采用肝组织检测cccDNA结果较为可靠和准确,但肝脏穿刺活检属于有创性检查,在临床难以普及,故检测外周血中HBV-cccDNA水平更易于被接受,同时也能较好地反映病毒复制状态。本研究同时分析了HBV-cccDNA复制与肝脏病理炎症分级及纤维化分期的关系,并未发现HBV-cccDNA与肝脏的病理变化有关联。根据本实验结果推测可能原因:在儿童乙型肝炎早期,由于肾小球局部病毒复制或者循环中HBV感染的细胞在肾小球局部滞留,导致HBV-cccDNA在肾小球局部滞留,肝组织中HBV-cccDNA复制水平较低; 本实验所选标本量较小,HBV-cccDNA能否引起肝脏炎症及纤维化的加重,还需进一步大样本的研究证实。
MN和MPGN是儿童HBV-GN的主要病理类型[9], 而本研究中HBV-GN患儿的肾脏病理类型与以上结果一致,进一步分析结果显示:MN患儿的肾小球HBV抗原检出率明显高于MPGN患儿,而HBV抗原成分的检出以HBeAg及HBcAg为主,这与崔敏等[6]的研究结果相似,HBV-cccDNA阳性组患儿HBeAg和HBcAg检出率均明显高于HBV-cccDNA阴性组。研究[6]显示:HBV-GN患者肾小球中检测到了HBV-cccDNA的存在,且HBV-cccDNA出现与循环中HBV-cccDNA检出高度一致,说明HBV抗原的检出与HBV-cccDNA的复制有关联,但这具体是由于肾小球局部病毒复制所致还是循环中HBV感染的细胞在肾小球局部滞留或是被细胞吞噬的病毒颗粒,还有待于进一步的定位研究。
急性自限性乙型肝炎(acute self limiting hepatitis B,AHB)患者和抗病毒治疗后实现持续性病毒学反应和HBsAg血清学清除的CHB患者肝细胞中存有极微量的HBV-cccDNA,肝细胞中HBV-cccDNA水平有望成为预测抗病毒治疗预后的可靠指标[20]。研究[5]显示:乙型肝炎患者外周血单个核细胞中HBV-cccDNA水平对其抗病毒治疗效果的监测和预后判断均有重要的临床意义。本研究首次应用ROC曲线评价HBV-cccDNA表达水平能否作为HBV-GN患儿辅助诊断的一个潜在标志,结果显示:HBV-cccDNA水平检测能有效鉴别观察组HBV-GN患儿和对照组患儿,说明HBV-cccDNA水平检测对诊断HBV-GN具有一定的临床价值。对10例干扰素规范抗病毒治疗儿童随访结果显示:HBV-cccDNA水平降低较HBV DNA水平降低出现早,且在3例治疗效果不理想患儿中其治疗前HBV-cccDNA复制水平均高于其他7例患儿,提示在治疗初期检测血清HBV-cccDNA水平较HBV DNA水平更为敏感,且对治疗效果的评估存在潜在的研究价值。在未来大样本的临床研究基础上可以考虑将血清HBV-cccDNA水平检测纳入HBV-GN的诊断,以更好地评估病情及治疗效果。
综上所述,HBV-cccDNA复制可能参与HBV-GN患儿的肝肾损害,且与肾小球免疫复合物沉积相关。HBV-cccDNA是HBV-GN发病过程中的一个关键分子,检测其复制水平可用于HBV-GN患儿的辅助诊断和疾病状态监测,同时对疗效评估及预后的判断具有潜在的临床应用价值。
| [1] | 鲁凤民, 王杰, 陈香梅, 等. 乙型肝炎病毒RNA病毒样颗粒的发现及其对抗病毒治疗临床实践的潜在影响[J]. 中华肝脏病杂志, 2017, 2(25): 105–110. |
| [2] | Morikawa K, Shimazaki T, Takeda R, et al. Hepatitis B:progress in understanding chronicity, the innate immune response, and cccDNA protection[J]. Ann Transl Med, 2016, 4(18): 337. DOI:10.21037/atm |
| [3] | Testoni B, Durantel D, Zoulim F. Novel targets for hepatitis B virus therapy[J]. Liver Int, 2017, 37(Suppl 1): 33–39. |
| [4] | 崔敏, 刘志红, 朱丽晶, 等. 乙型肝炎病毒感染肾炎患者肾组织病毒抗原和复制中间体的检测及其意义[J]. 肾脏病与透析肾移植杂志, 2004, 13(4): 301–325. DOI:10.3969/j.issn.1006-298X.2004.04.001 |
| [5] | 肖晓光, 李艳莲, 王晶, 等. 乙型肝炎患者外周血单个核细胞HBVcccDNA含量的检测及其临床意义[J]. 大连医科大学学报, 2010, 3(32): 348–351. |
| [6] | 孙利, 徐虹, 周利军, 等. 接种乙型肝炎疫苗对儿童乙型肝炎病毒相关性肾炎患病的影响[J]. 中华儿科杂志, 2003, 41(9): 666–669. DOI:10.3760/j.issn:0578-1310.2003.09.008 |
| [7] | 周建华. 儿童常见肾脏疾病诊治循证指南(试行)解读(五):乙型肝炎病毒相关性肾炎诊断和治疗[J]. 中华儿科杂志, 2010, 48(8): 746–749. |
| [8] | 中华医学会传染病与寄生虫学分会, 病毒学分会. 病毒性肝炎防治方案[J]. 中华肝脏病杂志, 2000, 8(1): 324–329. |
| [9] | 刘玉梅, 汪年松. 儿童乙型肝炎病毒相关性肾炎诊断治疗指南解读[J]. 临床内科杂志, 2015, 32(4): 287–288. DOI:10.3969/j.issn.1001-9057.2015.04.027 |
| [10] | Liang X, Bi S, Yang W, et al. Epidemiological serosurvey of Hepahepatitis B in China-declining HBV prevalence due to Hepatitis B vaccination[J]. Vaccine, 2013, 31(Suppl9): J21–J28. |
| [11] | Bengsch B, Chang KM. Evolution in our understanding of hepatitis B virus virology and immunology[J]. Clin Liver Dis, 2016, 20(4): 629–644. DOI:10.1016/j.cld.2016.06.001 |
| [12] | 史艳, 敏储芳, 史策, 等. HBV cccDNA及HBsAg定量对慢性乙型肝炎患儿抗病毒疗效判断的应用价值[J]. 中华肝脏病杂志, 2018, 1(26): 63–65. |
| [13] | 谢琴秀, 江晓平, 张亚飞, 等. HBV共价闭合环状DNA与血清HBV DNA、HBsAg、ALT、年龄的相关性研究[J]. 中华肝脏病杂志, 2015, 23(6): 418–421. DOI:10.3760/cma.j.issn.1007-3418.2015.06.005 |
| [14] | 曹经琳, 窦剑, 周文亭, 等. HBV共价闭合环状DNA Real-time PCR检测方法比较[J]. 中华实验和临床病毒学杂志, 2017, 1(31): 71–74. |
| [15] | Dong J, Ying J, Qiu X, et al. Advanced strategies for eliminating the cccDNA of HBV[J]. Dig Dis Sci, 2018, 63(1): 7–15. DOI:10.1007/s10620-017-4842-1 |
| [16] | Allweiss L, Dandri M. The role of cccDNA in HBV maintenance[J]. Viruses, 2017, 9(6): pii:E156. DOI:10.3390/v9060156 |
| [17] | Lucifora J, Protzer U. Attacking hepatitis B virus cccDNA-The holy grail to hepatitis B cure[J]. J Hepatol, 2016, 64(1 Suppl): S41–S48. |
| [18] | 孙永红, 雷晓燕, 杨菊兰, 等. 儿童乙型肝炎血清HBV cccDNA及病毒基因型研究[J]. 中华流行病学杂志, 2011, 32(12): 1247–1249. DOI:10.3760/cma.j.issn.0254-6450.2011.12.015 |
| [19] | 李红, 唐红. 乙肝病毒cccDNA检测方法及临床意义的研究进展[J]. 生物医学工程学杂志, 2009, 26(3): 662–665. DOI:10.3321/j.issn:1001-5515.2009.03.043 |
| [20] | 阮鹏.乙肝患者肝内cccDNA水平、HBV整合状况及其临床意义研究[D].武汉: 武汉大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10486-1014249940.htm |
 2018, Vol. 44
2018, Vol. 44


