扩展功能
文章信息
- 朱德强, 陈学军
- ZHU Deqiang, CHEN Xuejun
- 白花丹素对肝癌索拉菲尼耐药细胞HepG2R增殖和凋亡的影响及其机制
- Effects of plumbagin on proliferation and apoptosis of hepatocellular carcinoma HepG2R cells resistant to sorafenib and its mechanism
- 吉林大学学报(医学版), 2018, 44(06): 1223-1229
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1223-1229
- 10.13481/j.1671-587x.20180620
-
文章历史
- 收稿日期: 2018-03-11
索拉菲尼作为肝癌临床一线药物,能够抑制酪氨酸、苏氨酸和丝氨酸等多种激酶[1],有效抑制细胞的增殖。但随着药物的长期使用,临床已经出现严重的耐药现象[2],降低了索拉菲尼的治疗效果,急需寻找一种药物联合使用以增强其疗效。白花丹素(plumbagin, PLB)作为一种中药单体,研究[3-5]已证实PLB能够明显抑制食管癌、鼻咽癌、肺癌和前列腺癌等细胞的增殖。Pan等[6]研究显示PLB可诱导前列腺癌细胞发生G/M期阻滞,引起其生长受限。Checker等[7]发现:PLB能够上调淋巴瘤细胞中caspase-3、聚腺苷二磷酸核糖聚合酶和磷酸化组蛋白的表达水平,破坏DNA双链结构,提高细胞中活性氧(reactive oxygen species, ROS)水平,使得肿瘤细胞增殖受抑。研究[8]证明:PLB能升高癌症细胞中ROS水平,但PLB在肝癌索拉菲尼耐药细胞中的作用及机制尚未可知。本研究建立肝癌耐药细胞株HepG2R,观察PLB对耐药细胞增殖和凋亡的影响,探讨其对耐药细胞的具体作用机制。
1 材料与方法 1.1 细胞株、主要试剂和仪器人肝癌HepG2细胞株购自中国科学院细胞库。索拉菲尼(Sorafenib)和PLB购自美国Sigma公司,DMEM高糖培养基和胎牛血清(FBS)购自美国Gibco公司,MTT购自美国Promega公司,结晶紫染色液、Hoechst33342染色、细胞凋亡检测试剂盒和ROS检测试剂盒购自上海碧云天公司,cleaved Caspase-3、Bax、Bcl-2抗体和兔抗人单克隆抗体购自英国Abcam公司。CO2孵育箱购自美国Thermo公司,细胞流式细胞仪购自美国BD公司,激光共聚焦显微镜购自德国LEICA公司。
1.2 细胞培养和分组人肝癌HepG2细胞培养在DMEM培养基中(含10%FBS、100 IU·mL-1青霉素和100 mg·L-1链霉素、pH7.2~7.4),置于37℃、5%CO2孵箱中培养,胰蛋白酶消化,每隔2 d以1:3比例传代,调整细胞状态,待细胞处于对数生长期时进行实验。索拉菲尼和PLB分别溶于二甲基亚砜(DMSO)中,存储浓度为10 mmol·L-1,-20℃保存,实验时现配现用,无血清培养基稀释使用。采用逐步提高索拉菲尼浓度持续诱导HepG2细胞建立耐药细胞株HepG2R, 药物浓度依次为2、5、8、11、14、17和19 μmol·L-1,反复诱导12周,细胞最终在19 μmol·L-1药物浓度的培养基中稳定生长。将HepG2R细胞随机分为对照组、索拉菲尼(5 μmol·L-1)组、PLB(2 μmol·L-1)组、索拉菲尼(5 μmol·L-1)联合PLB(2 μmol·L-1)组(联合组)。
1.3 MTT法检测各组细胞活力检测各组药物对细胞增殖的抑制作用。将处于对数增殖期的HepG2和HepG2R细胞铺至96孔培养板,每孔约6 000个细胞,每孔加入100 μL完全培养基,每组设立5个复孔,以不含药物处理的细胞作为阴性对照组。细胞培养48 h后,加入MTT(5 g·L-1)溶液,每孔20 μL MTT和80 μL无血清培养基,37℃、5%CO2环境中培养4 h,轻轻抽掉培养液,每孔加入150 μL DMSO,室温震荡10 min,促使细胞中甲瓒充分溶解,采用酶标仪于波长490 nm处测定各孔内吸光度(A)值,计算各组细胞活力。细胞活力=给药组A值/空白组A值×100%;绘制细胞活力图,计算HepG2和HepG2R细胞对索拉菲尼的半数抑制浓度(IC50)值;采用同样操作,检测不同浓度PLB作用48h时和2μmol·L-1PLB处理不同时间时各组细胞活力,绘制细胞活力直条图。实验均重复5次。
1.4 克隆形成实验检测各组细胞的克隆形成率取对数生长期HepG2R细胞,铺6孔板,每孔细胞约5×105个,根据分组情况进行药物处理, 药物作用时间约为2周。待阴性对照组细胞长满,取出细胞,PBS轻轻漂洗2次;以5%甲醛固定30 min,PBS轻轻漂洗3次;结晶紫染色30 min,PBS漂洗3次;晾干照相;计算克隆形成率。克隆形成率=给药组细胞数/对照组细胞数×100%。
1.5 Hoechst33342实验检测各组细胞凋亡形态表现取对数生长HepG2R细胞,以胰蛋白酶消化,均匀铺在12孔培养板中,待细胞贴壁后,各组分别加入相应药物作用48 h,弃去培养液,以PBS漂洗3次,加入Hoechst33342染色液(1 mg·L-1),避光37℃孵育20 min,以PBS漂洗,荧光显微镜随机选取多个视野进行观察并照相。
1.6 流式细胞术(flow cytometry, FCM)检测各组细胞凋亡率取对数生长期HepG2R细胞,均匀铺在6孔板中培养。按各药物分组,药物处理48 h后消化、离心,预冷PBS重悬,将细胞密度调至细胞1×105 mL-1,按Annexin Ⅴ-FETC/PI试剂盒说明书染色,采用流式细胞仪检测各组细胞凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.7 Western blotting法检测各组细胞中cleaved Caspase-3、Bax和Bcl-2相对表达水平各组细胞经药物作用48 h后,PBS漂洗2次,消化、离心;采用RIPA缓冲液(含1% NP-40、0.5%脱氧胆酸钠、1% SDS、0.1%PMSF)裂解;按照BCA定量说明书定量;SDS-PAGE电泳;PVDF膜转膜,1% BSA封闭1 h;一抗(1:1 000稀释)4℃孵育过夜,TBST漂洗3次,每次10 min;洗膜,二抗(1:1 000)室温孵育1 h,TBST洗涤3次;ECL显影,计算蛋白相对表达水平。各蛋白相对表达水平=给药组灰度值/对照组灰度值,Bax/Bcl-2比值=给药组Bax灰度值/给药组Bcl-2灰度值。
1.8 各组细胞中ROS水平检测取对数生长期HepG2R细胞,胰蛋白酶消化,均匀铺于6孔板中,待细胞贴壁后,各组分别加入相应药物作用48 h,按照ROS检测试剂盒操作并照相,计算ROS水平。ROS水平=实验组绿色荧光细胞数/对照组绿色荧光细胞数×100%。
1.9 统计学分析采用SPSS 23.0统计软件进行统计学分析。各组细胞增殖抑制率,细胞凋亡率,细胞中cleaved Caspase-3、Bax和Bcl-2蛋白表达水平以及ROS水平以x±s表示,多组间均数比较采用单因素方差分析,组间两两均数比较采用最小显著差(least significant difference, LSD)法。以P < 0.05为差异有统计学意义。
2 结果 2.1 肝癌索拉菲尼耐药细胞的建立和鉴定小剂量持续给药建立肝癌耐药细胞株HepG2R,MTT法检测索拉菲尼对正常肝癌细胞株HepG2和耐药细胞株HepG2R增殖的抑制作用,以细胞活力为纵轴、以药物梯度为横轴绘制药效曲线,见图 1。耐药细胞株HepG2R对索拉菲尼的IC50值是HepG2的4.5倍(P=0.025),耐药细胞株建立成功,见图 2。
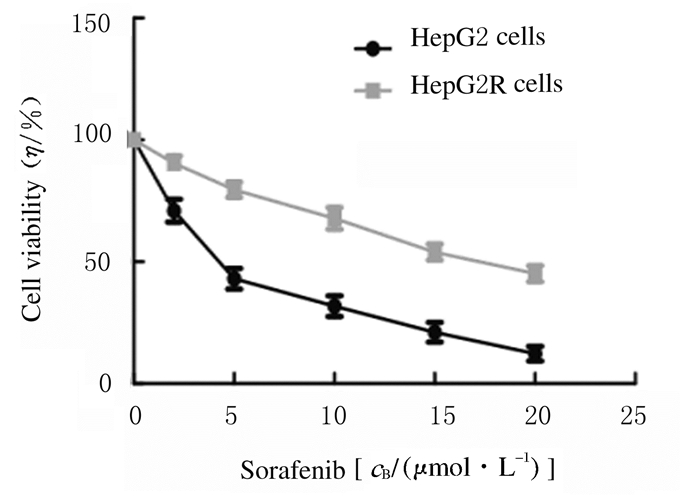
|
| 图 1 HepG2和HepG2R细胞对索拉菲尼的药效曲线 Figure 1 Pharmacodynamic curves of HepG2 and HepG2R cells for sorafenib |
|
|

|
| *P<0.05 compared with HepG2 cells. 图 2 HepG2和HepG2R细胞对索拉菲尼的IC50值 Figure 2 IC50values of HepG2 and HepG2R cells for sorafenib |
|
|
PLB(0 μmol·L-1)处理细胞时,加入索拉菲尼(5μmol·L-1)处理细胞对HepG2R细胞活力无影响(P=3.579);PLB(1 μmol·L-1)处理细胞时,与未加索拉菲尼组比较,加入索拉菲尼(5 μmol·L-1)后细胞活力降低(P=0.032);PLB (2 μmol·L-1)处理细胞时,与未加索拉菲尼组比较,加入索拉菲尼(5 μmol·L-1)后细胞活力降低(P=0.006);随着PLB浓度升高,HepG2R细胞对索拉菲尼敏感性升高,见图 3A。药物作用24 h, 与索拉菲尼组比较, 联合组细胞活力降低(P=0.029);药物作用48 h后,与索拉菲尼组比较, 联合组细胞活力明显降低(P=0.000);药物作用48 h,与PLB组比较,联合组细胞活力降低(P=0.012),见图 3B。
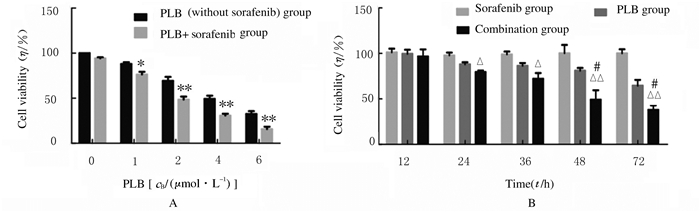
|
| *P < 0.05 compared with PLB(without sorafenib) group; △P < 0.05, △△P < 0.01 compared with sorafenib group; #P < 0.05 compared with PLB group. 图 3 不同浓度PLB作用48 h时(A)和2μmol·L-1PLB作用不同时间时(B)各组细胞活力 Figure 3 Cell vitalities in various groups after treated with different concentrations of PLBat 48 h after treatment (A) and treated with 2 μmol·L-1 PLB for different treatment time |
|
|
作用2周后,联合组细胞克隆形成率(58.29%±1.16%)明显低于索拉菲尼组(88.32%±2.06%)和PLB组(81.65%±1.32%),差异有统计学意义(P=0.000,P=0.021)。见图 4和5。

|
| A:Control group; B:Sorafenib group; C:PLB group; D:Combination group. 图 4 各组细胞克隆形成情况 Figure 4 Clone formation of cells in various groups |
|
|

|
| *P < 0.01 compared with sorafenib group; △P < 0.05 compared with PLB group. 图 5 各组细胞克隆形成率 Figure 5 Clone formation rates of cells in various groups |
|
|
Hoechst 33342染色结果显示:各组药物作用48 h后,对照组细胞核淡染,索拉菲尼组和PLB组细胞核少部分浓染、明亮,联合组细胞核大部分浓染,细胞核染色质固缩、明亮。见图 6(插页五)。
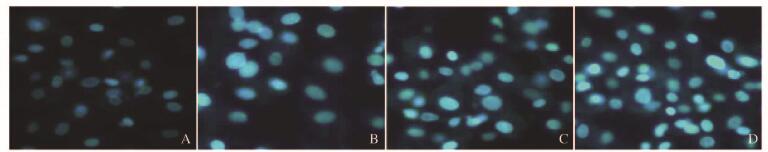
|
| A:Control group; B:Sorafenib group; C:PLB group; D:Combination group. 图 6 各组细胞核凋亡形态表现(Hoechst33342,×200) Figure 6 Apoptotic morphology of cell nucleus in various groups(Hoechst33342, ×200) |
|
|
联合组细胞凋亡率(35.92%±1.02%)明显高于索拉菲尼组(7.16%± 0.83%)和PLB组(9.27%±0.97%)(P=0.003,P=0.001)。见图 7。
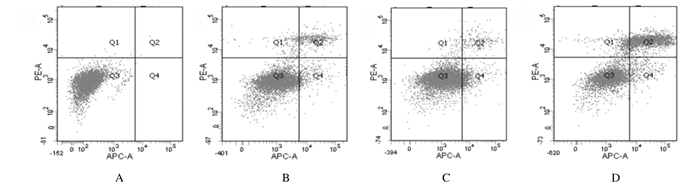
|
| A:Control group; B:Sorafenib group; C:PLB group; D:Combination group. 图 7 流式细胞术检测各组细胞凋亡率 Figure 7 Apoptotic rates of cells in various groupsdetected by FCM |
|
|
各组药物作用48 h后,Western blottiing法检测各组细胞中凋亡相关蛋白相对表达水平。与索拉菲尔组比较,联合组细胞中cleaved Caspase-3相对表达水平和Bax/Bcl-2比值升高(P=0.000,P=0.001);与PLB组比较,联合组细胞中cleaved Caspase-3相对表达水平和Bax/Bcl-2比值升高(P=0.001,P=0.002)。见图 8和9。

|
| Lane 1:Control group; Lane 2:Sorafenib group; Lane 3:PLB group; Lane 4:Combination group. 图 8 各组细胞中凋亡相关蛋白表达电泳图 Figure 8 Electrophoregram of expressions of apoptosis-related proteins in cells in various groups |
|
|
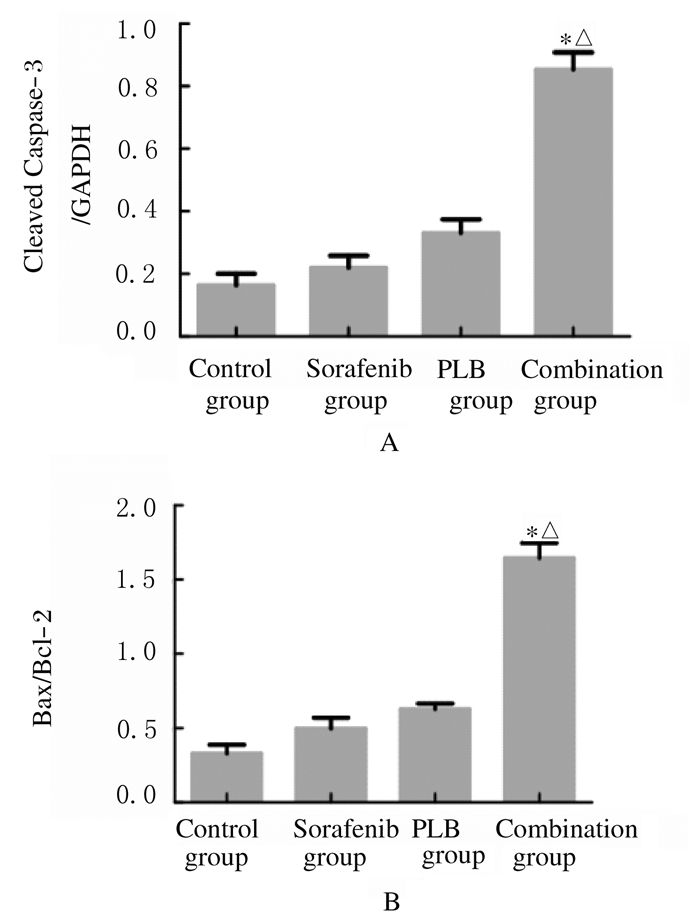
|
| *P < 0.01 compared with sorafenib group; △P < 0.01 compared with PLB group. 图 9 各组细胞中凋亡相关蛋白表达水平 Figure 9 Expression levels of apoptosis-related proteins in cells in various groups |
|
|
对照组、PLB组和索拉菲尼组细胞中ROS水平较低,联合组细胞中ROS水平明显高于索拉菲尼组(P=0.002)和PLB组(P=0.005)。见图 10(插页五)和图 11。

|
| 图 10 各组细胞中ROS的表达强度(免疫荧光,×200) Figure 10 Expression intensities of ROS in cells in various groups (Immnofluorescence, ×200) |
|
|

|
| 图 11 各组细胞中ROS水平 Figure 11 ROS level in cells in various groups |
|
|
肝细胞癌作为我国最常见的恶性肿瘤,其发病率和致死率居高不下,临床多以手术治疗为主,但术后极易复发[2, 9],一些化疗药物的出现延缓了肝癌的进展,缓解了病情。索拉菲尼作为肝癌临床治疗的一线化疗药物,能有效地抑制丝氨酸/苏氨酸激酶和血小板衍生生长因子受体,还能抑制受体酪氨酸激酶血管表皮生长因子受体2、网织红细胞以及酪氨酸激酶受体等,从而阻止肿瘤细胞增殖和血管生成, 但是肝癌索拉菲尼耐药现象的出现严重限制其治疗效果和应用。
肝癌对索拉菲尼耐药的机制十分复杂,随着耐药现象的出现,药物疗效的不断下降,急需寻找一种化疗增敏剂来抵抗药物耐受。研究[10-12]显示:天然药物PLB具有良好的抗肿瘤作用,PLB来源于白花丹的根部提取物,对前列腺癌、乳腺癌和肺癌等具有良好的治疗效果。研究[13]显示:PLB能提高肿瘤细胞ROS水平,使肿瘤细胞增殖受到抑制。PLB还可降低急性髓性白血病HL-60细胞中Bcl-2表达水平,增加Bax表达水平,明显升高caspase-3表达水平,促进细胞凋亡。
氧化应激是体内微环境改变导致的一种氧化反应,引起大量氧化中间产物的形成,其中ROS包括超氧阴离子(O2-)、羟自由基(OH)和过氧化氢(H2O2)等,体内多种疾病的发生均与之有关[14-17]。文献[18-19]报道:ROS水平升高能够抑制细胞增殖,促进细胞凋亡,与降低细胞线粒体膜电位有关,细胞因缺少ATP会引起自噬。自噬作为细胞的一种应激反应[20-23],细胞本身吞噬自身细胞质蛋白或细胞器使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,藉此实现本身的代谢需要和某些细胞器的更新。本实验通过索拉菲尼小剂量持续给药培养肝癌HepG2细胞,制备耐药细胞模型HepG2R,采用MTT实验确定药物作用浓度和时间,根据筛选的药物浓度和时间进行分组,比较各组细胞增殖和凋亡情况,发现PLB能明显增强耐药细胞对索拉菲尼的敏感性,并且提高耐药细胞中ROS水平,与既往研究结论相符。
本研究为临床肝癌索拉菲尼耐药的治疗提供了理论和实验依据,但仍存在诸多不足,未来应该进行更多动物实验和临床研究探讨耐药细胞增敏的具体机制,为临床治疗肝癌耐药提供一个新方案。
| [1] | Chen X, Ma Z, Huang Y, et al. Multiparametric MR diffusion-weighted imaging for monitoring the ultra-early treatment effect of sorafenib in human hepatocellular carcinoma xenografts[J]. J Magn Reson Imaging, 2017, 46(1): 248–256. |
| [2] | 史蕤, 李然, 赵冰清. 索拉菲尼血药浓度与疗效和不良反应的关系以及在肝细胞癌治疗应用[J]. 中国临床药理学杂志, 2015, 31(17): 1793–1795. |
| [3] | 刘正端, 赵智伟, 陈亚娟. 白花丹素下调FoxM1对食管鳞癌细胞增殖、凋亡的影响[J]. 药学学报, 2017, 52(4): 563–568. |
| [4] | 刘方方, 谢军平, 历风元. 白花丹素体内外抗Lewis肺癌的效果及机制研究[J]. 中国药学杂志, 2017, 52(7): 581–586. |
| [5] | Na S, Zhang J, Zhou X, et al. Plumbagin-mediating GLUT1 suppresses the growth of human tongue squamous cell carcinoma[J]. Oral Dis, 2018, 24(6): 920–929. DOI:10.1111/odi.12799 |
| [6] | Pan M, Li W, Yang J, et al. Plumbagin-loaded aptamer-targeted poly D, L-lactic-co-glycolic acid-b-polyethylene glycol nanoparticles for prostate cancer therapy[J]. Medicine (Baltimore), 2017, 96(30): e7405. DOI:10.1097/MD.0000000000007405 |
| [7] | Checker R, Gambhir L, Sharma D, et al. Plumbagin induces apoptosis in lymphoma cells via oxidative stress mediated glutathionylation and inhibition of mitogen-activated protein kinase phosphatases (MKP1/2)[J]. Cancer Lett, 2015, 357(1): 265–278. DOI:10.1016/j.canlet.2014.11.031 |
| [8] | Chao CC, Hou SM, Huang CC, et al. Plumbagin induces apoptosis in human osteosarcoma through ROS generation, endoplasmic reticulum stress and mitochondrial apoptosis pathway[J]. Mol Med Rep, 2017, 16(4): 5480–5488. DOI:10.3892/mmr.2017.7222 |
| [9] | 张晓媛, 黄鹏, 李燕京. 晚期原发性肝癌治疗的研究进展[J]. 现代肿瘤医学, 2017, 25(10): 1655–1659. DOI:10.3969/j.issn.1672-4992.2017.10.037 |
| [10] | Pan ST, Qin Y, Zhou ZW, et al. Plumbagin induces G2/M arrest, apoptosis, and autophagy via p38 MAPK-and PI3K/Akt/mTOR-mediated pathways in human tongue squamous cell carcinoma cells[J]. Drug Des Devel Ther, 2015, 9: 1601–1626. |
| [11] | Khaw AK, Sameni S, Venkatesan S, et al. Plumbagin alters telomere dynamics, induces DNA damage and cell death in human brain tumour cells[J]. Mutat Res Genet Toxicol Environ Mutagen, 2015, 793: 86–95. DOI:10.1016/j.mrgentox.2015.06.004 |
| [12] | Zhang W, Cheng L, Hou Y, et al. Plumbagin protects against spinal cord injury-induced oxidative stress and inflammation in wistar rats through Nrf-2 upregulation[J]. Drug Res (Stuttg), 2015, 65(9): 49–59. |
| [13] | Casadei Gardini A, Faloppi L, Aprile G, et al. Multicenter prospective study of angiogenesis polymorphism validation in HCC patients treated with sorafenib. An innovate study protocol[J]. Tumori, 2017, 15(6): 32–41. |
| [14] | Zhang N, Liu L, Dou Y, et al. Glycogen synthase kinase-3β antagonizes ROS-induced hepatocellular carcinoma cell death through suppression of the apoptosis signal-regulating kinase 1[J]. Med Oncol, 2016, 33(7): 60. DOI:10.1007/s12032-016-0776-2 |
| [15] | Seol HS, Lee SE, Song JS, et al. Glutamate release inhibitor, Riluzole, inhibited proliferation of human hepatocellular carcinoma cells by elevated ROS production[J]. Cancer Lett, 2016, 382(2): 157–165. DOI:10.1016/j.canlet.2016.08.028 |
| [16] | Liu J, Wei X, Wu Y, et al. Giganteaside D induces ROS-mediated apoptosis in human hepatocellular carcinoma cells through the MAPK pathway[J]. Cell Oncol (Dordr), 2016, 39(4): 333–342. |
| [17] | Zheng R, You Z, Jia J, et al. Curcumin enhances the antitumor effect of ABT-737 via activation of the ROS-ASK1-JNK pathway in hepatocellular carcinoma cells[J]. Mol Med Rep, 2016, 13(2): 1570–1576. DOI:10.3892/mmr.2015.4715 |
| [18] | Simo A. Hepatocellular carcinoma:portuguese data in chronic hepatitis B patients on antiviral therapy and treatment results with sorafenib[J]. GE Port J Gastroenterol, 2016, 23(5): 231–232. DOI:10.1016/j.jpge.2016.08.001 |
| [19] | Jia D, Lu W, Zhang X, et al. Calf spleen extractive injection (CSEI), a small peptides enriched extraction, induces human hepatocellular carcinoma cell apoptosis via ROS/MAPKs dependent mitochondrial pathway[J]. J Pharmacol Sci, 2016, 132(2): 122–130. DOI:10.1016/j.jphs.2016.08.006 |
| [20] | Jian KL, Zhang C, Shang ZC, et al. Eucalrobusone C suppresses cell proliferation and induces ROS-dependent mitochondrial apoptosis via the p38 MAPK pathway in hepatocellular carcinoma cells[J]. Phytomedicine, 2017, 25: 71–82. DOI:10.1016/j.phymed.2016.12.014 |
| [21] | Hu Z, Dong N, Lu D, et al. A positive feedback loop between ROS and Mxi1-0 promotes hypoxia-induced VEGF expression in human hepatocellular carcinoma cells[J]. Cell Signal, 2017, 31(9): 79–86. |
| [22] | 王帅, 尚志梅, 黄利敏, 等. 表没食子儿茶素没食子酸酯对肝癌细胞增殖的抑制作用研究[J]. 解放军医学杂志, 2016, 41(3): 199–203. |
| [23] | 刘亮, 刘江惠, 陈乐彤, 等. 青蒿琥酯对肝癌细胞生长的抑制作用及其机制[J]. 解放军医学杂志, 2018, 43(7): 594–599. |
 2018, Vol. 44
2018, Vol. 44


