扩展功能
文章信息
- 刘林娜, 陈婕妤, 吕方怡, 花扣珍, 蔡大敏, 银国利, 王俊娟
- LIU Linna, CHEN Jieyu, LYU Fangyi, HUA Kouzhen, CAI Damin, YIN Guoli, WANG Junjuan
- 芬戈莫德对神经干细胞和星形胶质细胞增殖及迁移的影响及其对小鼠脊髓损伤的保护机制
- Effect of fingolimod on proliferation and migration of neural stem cells and astrocytes and its protective mechanism against spinal cord injury in mice
- 吉林大学学报(医学版), 2018, 44(06): 1218-1222
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1218-1222
- 10.13481/j.1671-587x.20180619
-
文章历史
- 收稿日期: 2018-05-16
2. 杭州医学院基础医学与法医学院人体解剖与组织胚胎学教研室, 浙江 杭州 310014
2. Department of Human Anatomy, Histology and Embryology, School of Basic Medical Sciences and Forensic Sciences, Hangzhou Medical College, Hangzhou 310014, China
脊髓损伤(spinal cord injury,SCI)是骨科临床较常见的疾病[1],随着现代社会交通、建筑事业的快速发展,SCI患者日渐增多,目前美国每100万人口中有906例SCI患者[2]。SCI容易致残,使患者丧失部分或者全部劳动力,给社会和家庭造成严重负担。由于神经系统内源性再生能力极弱[3],目前除了SCI 8 h内给予大剂量甲基强的松龙对于治疗SCI有一定治疗效果外,并无其他更有效的治疗办法。因此针对SCI继发性损伤的机制探讨及探索新的治疗方式成为当前研究的热点。SCI后会发生复杂的病理变化,如局部组织缺血、水肿引起神经元凋亡和坏死,坏死的神经元轴突断裂并发生脱髓鞘反应,同时在局部形成脊髓空洞[4-5]。局部炎症反应可以刺激星形胶质细胞异常活化、聚集和增生形成胶质瘢痕,形成的胶质瘢痕一方面构成了神经元再生修复的物理屏障,一方面通过分泌阻碍再生的炎症因子构成了神经元再生的化学屏障[6-7]。因此促进神经元再生与修复,减弱脱髓鞘反应和局部的胶质瘢痕形成可以有效地促进SCI的修复。
芬戈莫德(fingolimod,FTY720)是一种鞘氨醇-1-磷酸受体调节剂,具有良好的免疫调节特性,是第一个被批准用于治疗复发缓解型多发性硬化症的口服药物,其神经保护作用已经得到认可[6]。研究[7]显示:FTY720可以有效抑制T细胞迁移进入中枢神经系统,减少病灶处的局部免疫反应起到相应的治疗作用。FTY720是一类亲脂小分子, 可以轻易穿过血脑屏障[8],在神经元、神经干细胞(neural stem cells,NSCs)和星形胶质细胞等多种细胞中也有FTY720受体表达[9]。实验[10-12]证实:对SCI和阿尔茨海默病等非免疫原因引起的中枢神经系统疾病患者给予口服FTY720治疗能够明显改善疾病的预后,提示FTY720可以通过直接作用于NSCs和星形胶质细胞等起到神经保护作用,但其具体机制尚未见报道。开发一种新型药物并探讨其具体机制对于治疗SCI具有重大意义,本研究围绕FTY720作为治疗SCI新型药物的问题,观察FTY720对NSCs和星形胶质细胞等增殖及迁移的影响,探讨FTY720参与SCI修复的机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器25只体质量约为25 g的成年C57BL/6雄鼠,购自上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2012-0002,使用许可证号:SVXK(浙)2013-0814。FTY720(美国Cayman Chemical公司),4’6-二脒基-2-苯基吲哚(4’6-diamidino-2-phenylindole, DAPI)(索莱宝科技有限公司),Nestin和胶质纤维酸性蛋白(glial fibrill acidic protein, GFAP)(美国Thermo Fisher公司),TaKaRa逆转录试剂盒(大连宝生物工程有限公司)。BX41光学显微镜及成像系统(日本Olympus公司),Leitz 1512石蜡切片机(德国Leitz公司)。
1.2 细胞的体外分离和分组取5只出生后24 h内的C57BL/6小鼠,酒精消毒后置入D-Hanks’液,洗涤,取其整条脊柱,去除外层肌肉,将剪刀沿脊柱将椎板打开,暴露整个脊髓,除去脊髓表面结缔组织和血管, 分离大鼠脊髓组织。加入1 mL胰酶消化后加入少量含血清的培养基终止消化,离心5 min。将分离得到的细胞分别在装有NSCs和星形胶质细胞的培养基中培养。将2种细胞分别随机分成对照组(采用PBS进行处理)和实验组(采用0.1μmol·L-1FTY720进行处理)。
1.3 SCI动物模型构建取20只C57BL/6小鼠,确定小鼠体表T10的标志,暴露椎板,用咬骨钳和小镊子咬去T9棘突,打开椎板,暴露一段5 mm长的脊髓。采用显微解剖刀对准并避开脊髓后正中动脉,贯穿脊髓,向右侧平移至完全横断右侧脊髓。缝合软组织及皮肤。术后3 d给予抗生素预防感染常规排尿护理。
1.4 动物分组和给药方式将上述已造模小鼠随机分成对照组和实验组,每组10只。对照组小鼠口服PBS,实验组小鼠口服1 mg·kg-1·d-1FTY720,均连续给药14 d。
1.5 Transwell实验观察2组NSCs迁移细胞数当培养的NSCs长到约90%时,吸走培养基后加入适量无菌PBS洗涤2次。加入胰酶消化后加入少量含血清的培养基终止消化,离心5 min。采用移液枪轻轻吹打培养皿底部细胞,将吹打下的细胞收集至15 mL离心管中,1 300 r·min-1离心5 min。弃去上清后重悬细胞并计数,然后稀释至5×106 mL-1, 取0.1 mL细胞悬液,分别加入Transwell上室,在Transwell下室中加入0.6 mL培养基,在培养箱中37℃、5%CO2的环境中迁移12 h。将Transwell小室膜上下的细胞采用1×PBS洗涤3次,每次5 min。采用4%多聚甲醛固定15 min。1×PBS洗涤3次,每次5 min。将小室上层细胞采用医用棉签轻轻擦拭,留下小室下层细胞DAPI染色后光学显微镜下观察计数。取对照组和实验组培养的NSCs或者SCI4周后的脊髓冰冻切片,采用PBS洗涤3次,每次5 min,4%多聚甲醛溶液固定15 min后,PBS洗去多余固定液。采用0.2%TritonX-100透膜5 min,采用PBS洗涤3次,每次5 min。采用5% BSA室温封闭30 min,采用1%BSA稀释一抗Nestin或者GFAP,加入稀释好的一抗,放在湿盒里孵育,4℃过夜。次日,采用PBS洗涤3次,每次5 min。加入1%BSA稀释的488二抗(山羊抗鼠)避光孵育1 h后,采用PBS洗涤3次。加入DAPI进行细胞核染色5 min,采用PBS洗涤3次,每次5 min。采用免疫荧光封片剂封片,暗盒保存。取对照组和实验组星形胶质细胞,以与NSCs同样方式进行上述实验操作。在荧光显微镜下观察NSCs迁移细胞数和增殖神经球数以及星形胶质细胞迁移细胞数,体内检测小鼠SCI震中GFAP荧光强度,以此表示星形胶质细胞数。
1.6 HE染色检测小鼠SCI空洞面积造模4周后,采用10%水合氯醛麻醉小鼠,剪开右心耳,经左心室灌入PBS直到小鼠肝脏变白,然后灌入4%多聚甲醛直到小鼠尾巴翘起变硬。经4%多聚甲醛内固定后以10%~30%蔗糖梯度脱水。取损伤中心前后约1 cm长(头尾各50 mm)脊髓组织进行连续冰冻切片,切片厚约20 μm。将切片放置烘箱过夜烘干。蒸馏水滴洗样本2 min,将样本放入苏木素中染色5 min,采用自来水冲洗。迅速插入盐酸乙醇, 分化1 s后拔出。样本置于自来水中浸泡15 min,伊红溶液中30 s。在光学显微镜下对HE染色后的脊髓切片进行照相,采用PS软件直接测量SCI空洞面积。
1.7 Basso Mouse Scale(BMS)评分评估小鼠运动能力的恢复情况术后1、2、3、4和5周分别以改良标准BMS评分法评估所有小鼠的后肢关节活动度、协调性、脚爪姿态、躯干稳定性及尾巴姿势等。所有观察均在上午10:00~12:00进行,每次持续2 min。同时采用数码摄像机记录小鼠行为。所有评分均在单盲情况下进行。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。2组NSCs迁移数、NSCs增殖神经球数和SCI空洞面积以x±s表示, 组间比较采用t检验。以P<0.05为差异有统计学意义。
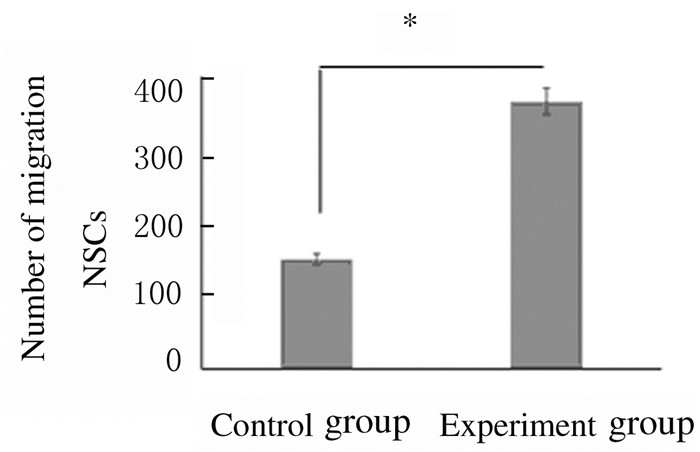
2 结果 2.1 2组小鼠NSCs迁移细胞数与对照组比较,实验组NSCs迁移细胞数增多(P < 0.05)。DAPI染色结果显示:实验组NSCs迁移细胞数增多,即0.1μmol·L-1 FTY720能促进NSCs的迁移。见图 1和2(插页四)。
|
| *P < 0.05 vs control group. 图 1 小鼠2组NSCs的迁移细胞数 Figure 1 Number of migration cells of NSCs of mice in two groups |
|
|
|
| A:Control group; B: Experiment group. 图 2 2组NSCs的迁移细胞的形态表现(DAPI,bar=200 μm) Figure 2 Morphology of migration cells of NSCs in two groups (DAPI, bar=200 μm) |
|
|
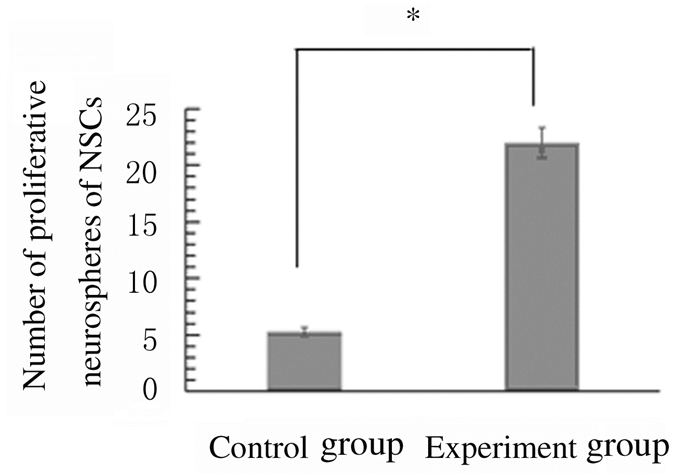
与对照组比较,实验组NSCs增殖神经球数增多(P < 0.05),形态较饱满。见图 3和4(插页四)。
|
| *P < 0.05 vs control group. 图 3 2组小鼠NSCs的增殖神经球数 Figure 3 Numberof proliferative neurospheres of NSCs of mice in two groups |
|
|

|
| A:Control group; B: Experiment group. 图 4 2组NSCs增殖神经球形态表现(免疫荧光,bar=200 μm) Figure 4 Morphology of proliferative neurospheres of NSCs in two groups(Immunofluorescence, bar=200 μm) |
|
|
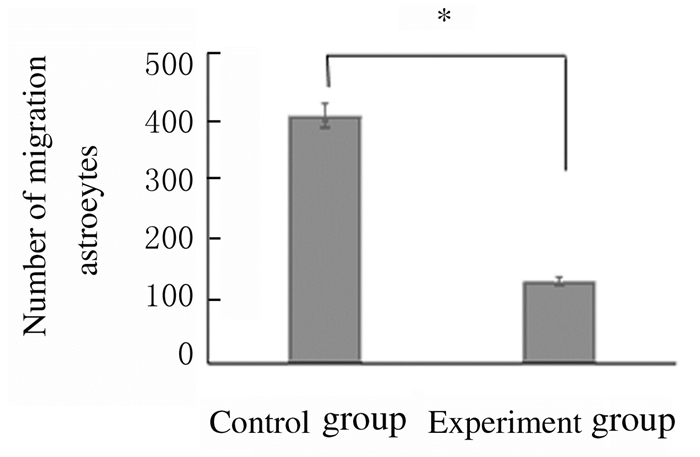
与对照组比较,实验组小鼠星形胶质细胞迁移细胞数减少(P < 0.05),细胞形态较瘪。见图 5和6(插页五)。
|
| *P < 0.05 vs control group. 图 5 2组小鼠星形胶质细胞的迁移细胞数 Figure 5 Number of migration cells of astrocytes of mice in two groups |
|
|
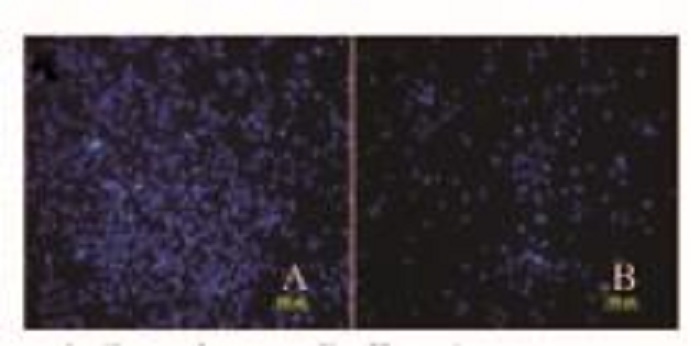
|
| 图 6 2组星形胶质细胞的迁移细胞形态表现 Figure 6 Morphology of migration cells of astrocytes in two groups |
|
|
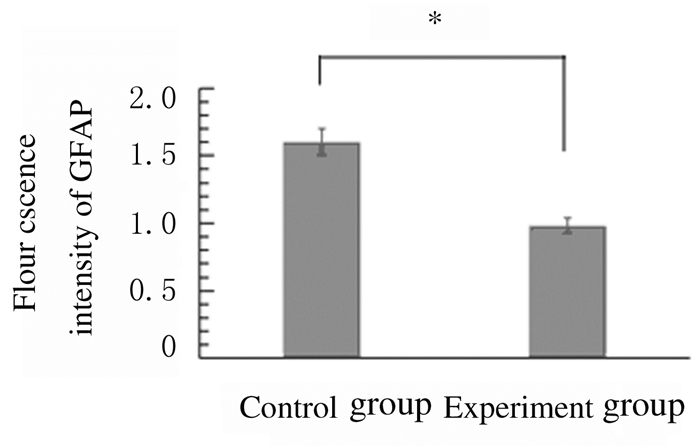
与对照组比较,实验组小鼠SCI震中星形胶质细胞数减少(P < 0.05),细胞形态不完整;对照组小鼠SCI震中星形胶质细胞数较多,细胞形态完整。见图 7和8(插页五)。
|
| *P < 0.05 vs control group. 图 7 2组小鼠SCI震中GFAP荧光强度 Figure 7 Fluorescence intensities of GFAP in damaged SCI of mice in two groups |
|
|
|
| A:Control group; B: Experiment group. 图 8 2组小鼠星形胶质细胞形态表现(免疫荧光,bar=100 μm) Figure 8 Morphology of actrocytes of mice in two groups (Immunofluorescence, bar=100 μm) |
|
|
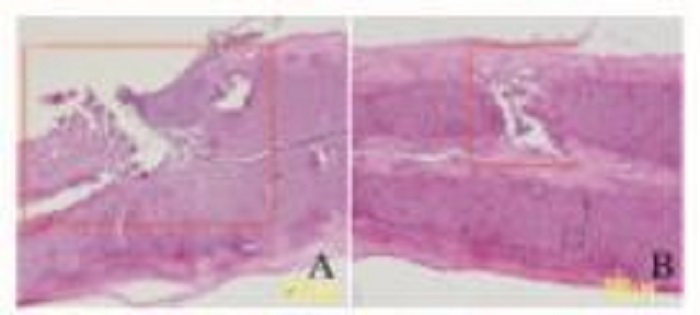
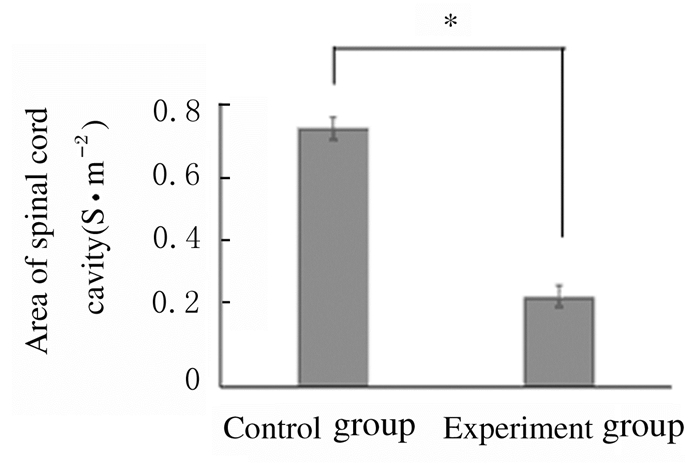
与对照组比较,FTY720组小鼠SCI空洞面积缩小(P < 0.05)。见图 9和10(插页五)。
|
| *P < 0.05 vs control group. 图 9 2组小鼠SCI空洞面积 Figure 9 Areas of SCI cavities in mice in two groups |
|
|
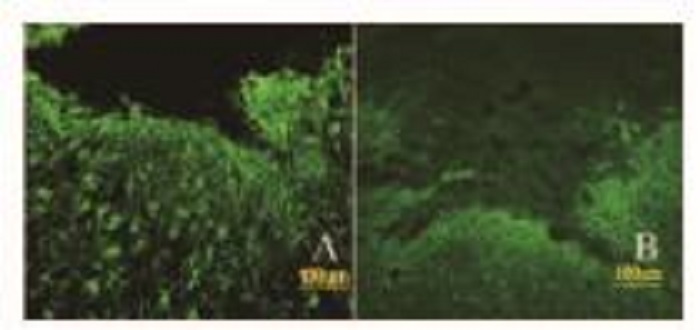
|
| A:Control group; B:Sorafenib group; C:PLB group; D:Combination group. 图 10 2组小鼠SCI空洞面积 Figure 10 Areas of SCI cavities of mice in two groups |
|
|
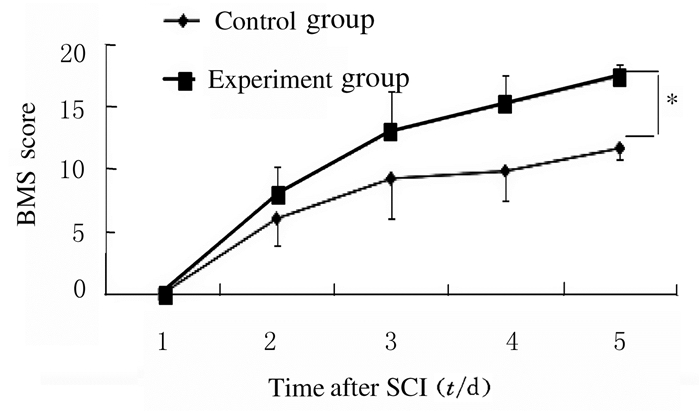
随着时间的推移,2组小鼠BMS评分均升高,但实验组小鼠BMS评分升高更明显。与对照组比较,实验组小鼠BMS评分明显升高(P < 0.05)。见图 11。
|
| *P < 0.05 vs control group. 图 11 SCI后实验组和对照组小鼠BMS评分与时间关系图 Figure 11 Diagram of relationship between BMS scores and time of mice in expriment group and control group after SCI |
|
|
虽然FTY720对于SCI的保护作用已有报道,但是以往的研究[13]结果显示:FTY720主要通过抑制T细胞迁移而减少血液中T细胞水平,使其停留在淋巴结中发挥相应的作用。最近有研究[14]显示:FTY720对重症联合免疫缺陷小鼠SCI后的神经保护作用与野生型小鼠无异,引起研究者对于FTY720的再次关注。本研究结果显示:FTY720可以促进小鼠SCI后的组织学修复和运动功能恢复,该结果与以往的研究结果[14]吻合。
星形胶质细胞在SCI损伤过程中扮演了重要的角色,其可以在损伤处大量聚集,分泌抑制神经再生的因子,构成SCI修复的物理及化学屏障[6-7]。因此,有效抑制星形胶质细胞的增殖活化和迁移至损伤局部可以有效地促进SCI的修复[14]。本研究采用Transwell实验检测了FTY720对于星形胶质细胞迁移能力的影响,结果显示:FTY720在体外可以显著抑制星形胶质细胞的迁移;荧光染色结果显示:FTY720可以明显减少星形胶质细胞在SCI震中的聚集,促进小鼠SCI后运动功能修复。研究[15]显示:FTY720对于敲除了星形胶质细胞表面受体多发性硬化小鼠治疗无效,提示FTY720可能通过作用于星型胶质细胞起到治疗多发性硬化的作用,本研究结果在体内和体外再次验证了FTY720对于星形胶质细胞的作用。
NSCs可以分化为神经元和少突胶质细胞,可加速神经结构的重构,同时改善SCI的局部炎症,抑制局部炎症环境毒性作用,促进NSCs在SCI后增殖和迁移至损伤局部以有效地改善SCI后的损伤修复[16-19]。本研究结果显示:FTY720在体外可以明显促进NSCs的增殖和迁移,该结果再次从非免疫角度阐明了FTY720对于SCI修复的可能作用机制,为FTY720作为治疗SCI药物的研发提供了理论依据。
本研究结果初步证实:FTY720可以直接作用于NSCs和星形胶质细胞,影响其增殖或者迁移,从而促进SCI的恢复。本研究结果初步阐明了FTY720对于SCI修复的可能作用机制,为FTY720作为治疗SCI药物的研发提供了理论依据。
| [1] | Lima R, Monteiro S, Lopes JP, et al. Systemic interleukin-4 administration after spinal cord injury modulates inflammation and promotes neuroprotection[J]. Pharmaceuticals, 2017, 10(4): 83. DOI:10.3390/ph10040083 |
| [2] | Singh A, Tetreault L, Kalsi-Ryan S, et al. Global prevalence and incidence of traumatic spinal cord injury[J]. Clin Epidemiol, 2014, 6: 309–331. |
| [3] | Iyer NR, Wilems TS, Sakiyama-Elbert SE. Stem cells for spinal cord injury:Strategies to inform differentiation and transplantation[J]. Biotechnol Bioeng, 2017, 114(2): 245–259. DOI:10.1002/bit.26074 |
| [4] | Dumont RJ, Okonkwo DO, Verma S., et al. Acute spinal cord injury, part Ⅰ:pathophysiologic mechanisms[J]. Clin Neuropharmacol, 2001, 24(5): 254–264. DOI:10.1097/00002826-200109000-00002 |
| [5] | Tator CH. Strategies for recovery and regeneration after brain and spinal cord injury[J]. Inj Prev, 2002, 8(Suppl 4): V33–V36. |
| [6] | Chen L, Li J, Wu L, et al. Synergistic actions of olomoucine and bone morphogenetic protein-4 in axonal repair after acute spinal cord contusion[J]. Neural Regen Res, 2014, 9(20): 1830–1838. DOI:10.4103/1673-5374.143431 |
| [7] | 任浩.局部释放夫拉平度调控局部星形胶质细胞和炎症反应促进脊髓损伤修复[D].杭州: 浙江大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10335-1017119082.htm |
| [8] | Ambrosius B, Pitarokoili K, Schrewe L, et al. Fingolimod attenuates experimental autoimmune neuritis and contributes to Schwann cell-mediated axonal protection[J]. J Neuroinflammat, 2017, 14(1): 92. DOI:10.1186/s12974-017-0864-z |
| [9] | Kretzschmar B, Pellkofer H, Weber MS. The use of oral disease-modifying therapies in multiple sclerosis[J]. Curr Neurol Neurosci, 2016, 16(4): 38. DOI:10.1007/s11910-016-0639-4 |
| [10] | Chun J, Hartung HP. Mechanism of action of oral fingolimod (FTY720) in multiple sclerosis[J]. Clin Neuropharmacol, 2010, 33(2): 91–101. DOI:10.1097/WNF.0b013e3181cbf825 |
| [11] | Dusaban SS, Chun J, Rosen H, et al. Sphingosine 1-phosphate receptor 3 and RhoA signaling mediate inflammatory gene expression in astrocytes[J]. J Neuroinflammat, 2017, 14(1): 111. DOI:10.1186/s12974-017-0882-x |
| [12] | Zhu Z, Fu Y, Tian D, et al. Combination of an immune modulator fingolimod with alteplase in acute ischemic stroke:a pilot trial[J]. Circulation, 2015, 132(12): 1104–1112. DOI:10.1161/CIRCULATIONAHA.115.016371 |
| [13] | Zhang J, Zhang A, Sun Y, et al. Treatment with immunosuppressants FTY720 and tacrolimus promotes functional recovery after spinal cord injury in rats[J]. Tohoku J Exp Med, 2009, 219(4): 295–302. DOI:10.1620/tjem.219.295 |
| [14] | Norimatsu Y, Ohmori T, Kimura A, et al. FTY720 improves functional recovery after spinal cord injury by primarily nonimmunomodulatory mechanisms[J]. AmJPathol, 2012, 180(4): 1625–1635. |
| [15] | Chen L, Li J, Wu L, et al. Synergistic actions of olomoucine and bone morphogenetic protein-4 in axonal repair after acute spinal cord contusion[J]. Neural Regen Res, 2014, 9(20): 1830–1838. DOI:10.4103/1673-5374.143431 |
| [16] | Ren H, Han M, Zhou J, et al. Repair of spinal cord injury by inhibition of astrocyte growth and inflammatory factor synthesis through local delivery of flavopiridol in PLGA nanoparticles[J]. Biomaterials, 2014, 35(24): 6585–6594. DOI:10.1016/j.biomaterials.2014.04.042 |
| [17] | Choi JW, Gardell SE, Herr DR, et al. FTY720(fingolimod) efficacy in an animal model of multiple sclerosis requires astrocyte sphingosine 1-phosphate receptor 1(S1P1) modulation[J]. Proc Natl Acad Sci USA, 2011, 108(2): 751–756. DOI:10.1073/pnas.1014154108 |
| [18] | Snyder EY, Teng YD. Stem cells and spinal cord repair[J]. N Engl J Med, 2012, 366(20): 1940–1942. DOI:10.1056/NEJMcibr1200138 |
| [19] | Hsuan YC, Lin C, Chang C, et al. Mesenchymal stem cell-based treatments for stroke, neural trauma, and heat stroke[J]. Brain Behav, 2016, 6(10): 1–11. |
 2018, Vol. 44
2018, Vol. 44


