扩展功能
文章信息
- 张萍, 张良祥
- ZHANG Ping, ZHANG Liangxiang
- 高压氧对运动疲劳小鼠肝脏组织抗氧化能力和ATP酶代谢的影响
- Effects of hyperbaric oxygen on antioxidant capacity and ATPase metabolism in liver tissue of mice with exercise-induced fatigue
- 吉林大学学报(医学版), 2018, 44(06): 1200-1204
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1200-1204
- 10.13481/j.1671-587x.20180616
-
文章历史
- 收稿日期: 2018-02-26
近年来,随着竞技运动要求越来越高,为了取得好成绩,运动员在平时训练时过度训练的现象时常发生,且呈逐渐升高趋势[1],然而,过度训练会导致机体组织缺氧而产生大量自由基,不仅不利于运动成绩的提高,而且会对多种组织器官产生损伤[2]。肝脏作为机体重要的贮血和解毒器官,在自由基代谢和抗氧化中发挥重要作用,有助于延缓运动性疲劳的发生[3]。研究[4]显示:力竭性运动训练可不同程度地损害肝组织结构及功能。高压氧(hyperbaric oxygen,HBO)作为治疗多种疾病的辅助手段,可通过改善机体氧含量而达到保护器官的目的,同时在抗疲劳等方面发挥重要作用[5-6]。研究[7]显示:HBO有助于防止反复跳跃的特定运动的肌肉过度疲劳。研究[8]显示:HBO可保护疲劳大鼠免受肾脏损伤。但尚未见关于HBO对疲劳动物模型肝脏影响的报道。本研究通过制备小鼠运动疲劳模型,观察HBO干预对小鼠肝脏组织抗氧化能力及ATP酶代谢的影响,以期为运动疲劳相关机制研究提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康雄性昆明小鼠30只,购自上海斯莱克实验动物有限公司,动物合格证号:SCXK(沪)2007-0005,10周龄,体质量(24±2)g,饲养于标准环境下,自由饮水和进食。适应性饲养7 d后完成实验操作。丙二醛(MDA)和过氧化氢酶(CAT)检测试剂盒均购自上海源叶生物科技有限公司,超氧化物歧化酶(SOD)、谷胱甘肽-过氧化物酶(GSH-Px)和总抗氧化能力(T-AOC)检测试剂盒均购自南京建成生物工程研究所,ATP酶试剂盒购自上海星科生物科技有限公司,考马斯亮蓝(Bradford)法蛋白浓度测定试剂盒购自上海美季生物技术有限公司。动物高压氧舱购自上海七零一所杨园高压氧舱有限公司,透射电镜购自日本日立公司。
1.2 运动疲劳小鼠模型的制备采用随机数字表将小鼠随机分为对照组、疲劳组和HBO干预组,每组10只。按照参考文献[9]中介绍的方法制备小鼠运动疲劳模型。建模前,测量3组小鼠体质量。将疲劳组和HBO干预组小鼠尾部按照体质量的3%负重铅丝,于水深30 cm的Morris水迷宫中游泳,水温28 ℃,每天下午5:00开始,直至出现力竭现象:头部全部没入水中持续10 s不能浮出,捞出后置于水平面上不能翻正。每天1次,持续2周,最后一次力竭训练时,记录2组小鼠游泳时间。对照组小鼠进行正常活动,每天下午5:00开始进行一次无负重游泳训练,持续2周。每次力竭训练后,疲劳组小鼠放回笼中,HBO干预组小鼠立即置于铺有新鲜钠石灰的高压氧舱中,舱内压0.25 MPa,O2浓度>90%,稳定吸氧60 min,匀速减压15 min至常压后出舱。检测各组小鼠力竭游泳时间。
1.3 ELISA法检测各组小鼠肝脏组织中MDA、CAT、SOD、GSH-Px和T-AOC水平于最后一次游泳结束后,将各组小鼠脱臼处死,快速取肝脏组织,用预冷生理盐水冲洗,滤纸吸干。称取1.0 g肝脏组织,按1:9的比例加入生理盐水,冰浴匀浆,4℃、10 000 r·min-1离心20 min,留取上清,ELISA法检测各组小鼠肝脏组织中MDA、CAT、SOD、GSH-Px水平和T-AOC,所有操作均在标准实验室中并按照试剂盒说明完成。
1.4 电镜观察各组小鼠肝脏组织形态表现取1 mm×1 mm×1 mm肝脏组织,采用体积分数3%的戊二醛固定组织3 h,盐酸缓冲液洗涤3次,以1%锇酸固定,梯度浓度乙醇脱水,环氧树脂包埋,超薄切片,双电子染色后电镜下观察肝脏组织形态表现。
1.5 各组小鼠肝脏组织中ATP酶活性检测取各组小鼠1.0 g肝脏组织,预冷生理盐水漂洗,滤纸吸干。按1:9的比例加入冷生理盐水,用匀浆器制备匀浆液,4℃、3 000 r·min-1离心20 min,留取上清保存于-30℃冰箱以备检。采用Bradford法蛋白浓度测定试剂盒对肝组织中总蛋白水平进行检测。采用比色法,根据ATP酶试剂盒说明书检测各组小鼠肝脏组织中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和总ATP酶活性,以每小时每毫克蛋白分解1个ATP产生1μmol无机磷作为一个活性单位[10],即U·mg-1。
1.6 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组小鼠力竭游泳时间,肝脏组织中MDA、CAT、SOD、GSH-Px和T-AOC水平,Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和总ATP酶活性以x±s表示,组间比较采用t检验,多组间比较采用单因素方差分析和LSD-t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组小鼠力竭游泳时间最后一次力竭训练时,HBO干预组小鼠力竭游泳时间为(75.6±13.3)min,明显长于疲劳组[(56.9±8.4)min],组间比较差异有统计学意义(t=3.701,P=0.002)。
2.2 各组小鼠肝脏组织中MDA、CAT、SOD、GSH-Px和T-AOC水平与对照组比较,疲劳组和HBO干预组小鼠肝脏组织中MDA水平升高(P < 0.05),而CAT、SOD、GSH-Px和T-AOC水平均降低(P < 0.05);与疲劳组比较,HBO干预组小鼠肝脏组织中MDA水平降低(P < 0.05),而CAT、SOD、GSH-Px和T-AOC水平均升高(P < 0.05)。见表 1。
| (n=10, x±s) | |||||
| Group | MDA [mB/(nmol·mg-1)] |
CAT [λB/(U·mg-1)] |
SOD [λB/(U·mg-1)] |
GSH-Px [λB/(U·mg-1)] |
T-AOC [λB/(U·mg-1)] |
| Control | 2.97±0.34 | 19.41±3.66 | 18.27±4.05 | 128.70±15.06 | 5.85±0.39 |
| Fatigue | 5.62±0.49* | 12.11±2.38* | 11.45±1.81* | 53.59±5.39* | 2.27±0.17* |
| HBO intervention | 3.98±0.29*△ | 15.91±2.74*△ | 14.72±3.61*△ | 86.71±5.93*△ | 9.35±0.34*△ |
| F | 119.581 | 15.046 | 10.675 | 146.131 | 262.440 |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 |
| * P < 0.05 compared with control group; △ P < 0.05 compared with fatigue group. | |||||
对照组小鼠肝脏组织细胞膜完整,核膜光滑、可见核仁,线粒体外膜完整,嵴结构清晰完整,未见明显异常改变;疲劳组小鼠肝脏组织细胞出现浓缩,内质网增生,线粒体出现肿胀或浓缩,嵴结构发生断裂、变形、融合;HBO干预组小鼠肝脏组织细胞膜完整,线粒体改变较疲劳组减轻,嵴结构完整,内质网改变亦减轻。见图 1。
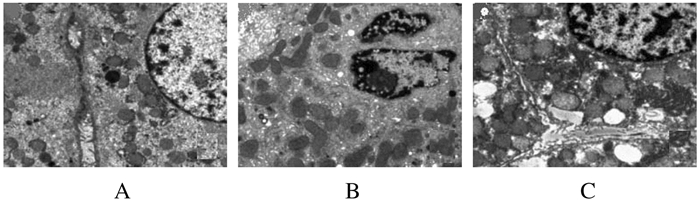
|
| A:Control group; B: Fatigue group; C: HBO intervention group. 图 1 电镜观察各组小鼠肝脏组织超微结构(×20 000) Figure 1 Ultrastructures of liver tissue of mice in various groups observed by electron microscope (×20 000) |
|
|
与对照组比较,疲劳组和HBO干预组小鼠肝脏组织中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和总ATP酶活性均降低(P < 0.05);与疲劳组比较,HBO干预组小鼠肝脏组织中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和总ATP酶活性均升高(P < 0.05)。见表 2。
| (n=10, x±s) | |||
| Group | Na+-K+-ATPase activity | Ca2+-Mg2+-ATPase activity | Total ATPase activity |
| Control | 2.45±0.17 | 0.84±0.08 | 1.62±0.09 |
| Fatigue | 1.90±0.08* | 0.37±0.10* | 0.99±0.05* |
| HBO intervention | 2.20±0.12*△ | 0.63±0.10*△ | 1.38±0.12*△ |
| F | 45.469 | 57.770 | 116.347 |
| P | < 0.001 | < 0.001 | < 0.001 |
| * P < 0.05 compared with control group;△ P < 0.05 compared with fatigue group. | |||
正常生理情况下,机体可将运动过程中产生的乳酸和氧自由基等有害物质有效代谢而不损害健康,但随着运动强度增加,尤其是长时间疲劳性运动,会导致机体内代谢失衡,使大量的氧自由基等有害物质堆积于机体而损坏健康[11-12],尤其是对于竞技运动员,不利于运动成绩的提高,已成为运动医学研究的热点和难点。研究[13-14]显示:运动性疲劳与肝脏代谢有密切关联。肝脏不仅是人体内重要的能量代谢器官,而且在解毒、贮血等方面发挥重要作用,可以有效代谢运动过程中产生的乳酸、氧自由基等有害物质[15],研究[16-17]显示:运动性疲劳可破坏肝脏的超微结构,影响肝组织正常代谢功能。本研究采用经典的力竭游泳方式制备小鼠运动性疲劳模型,结果显示:与对照组比较,疲劳组小鼠肝脏组织中MDA水平升高,而CAT、SOD、GSH-Px和T-AOC水平均降低。MDA是脂质过氧化物的代谢产物,在反映机体内脂质过氧化程度及自由基对细胞破坏程度方面具有重要意义[18];而CAT、SOD、GSH-Px和T-AOC则是反映机体抗氧化能力的主要指标,在抗氧化、消除自由基中发挥重要作用[19]。本研究结果提示:力竭运动使小鼠肝脏代谢能力出现异常,抗氧化能力减弱。ATP酶作为生物膜上重要的活性蛋白酶,在能力转化、代谢和信息传递中发挥重要作用,其中,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶对维持细胞膜内外离子稳态具有重要意义,2种酶活性降低会导致细胞内外离子稳定失衡而损伤细胞线粒体结构及功能[20],本研究结果显示:力竭运动小鼠肝脏组织中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和总ATP酶活性均降低;电镜检查结果显示:力竭运动小鼠肝脏超微结构发生改变,细胞出现受损表现,线粒体被破坏。
HBO治疗作为近年来临床上多种疾病辅助治疗手段,可快速升高机体氧及血氧含量,改善组织有氧代谢情况,增加能量生成[21-23]。研究[8]显示:HBO暴露可减轻疲劳大鼠肾脏损伤。本研究对力竭运动小鼠进行HBO干预后,HBO干预组小鼠力竭游泳时间明显长于疲劳组,说明HBO干预对改善力竭小鼠疲劳状态有效,具有抗疲劳的作用。本研究结果显示:与疲劳组比较,HBO干预组小鼠肝脏组织中MDA水平降低,而CAT、SOD、GSH-Px和T-AOC水平均升高,说明HBO干预可有效提高肝脏抗氧化能力,增加抗氧化酶活性。本研究结果显示:HBO干预组小鼠肝脏组织中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和总ATP酶活性均升高;电镜结果显示:HBO干预组小鼠肝脏细胞破坏程度减轻,线粒体改变减少,进一步提示HBO干预可减少疲劳性运动对小鼠肝组织的破坏,这可能与其提高肝脏组织抗氧化能力及ATP酶活性有关。
综上所述,HBO干预可有效延长力竭运动小鼠游泳时间,保护肝脏功能,其机制可能与提高肝脏组织抗氧化能力及ATP酶活性有关。本研究结论有望为提高竞技运动员运动水平和防治运动损伤提供重要线索。
| [1] | Williams TD, Tolusso DV, Fedewa MV, et al. Comparison of periodized and non-periodized resistance training on maximal strength:A meta-analysis[J]. Sports Med, 2017, 47(10): 2083–2100. DOI:10.1007/s40279-017-0734-y |
| [2] | Watson AM. Sleep and athletic performance[J]. Curr Sports Med Rep, 2017, 16(6): 413–418. DOI:10.1249/JSR.0000000000000418 |
| [3] | 马海峰, 吴瑛, 杨锐. 针刺运动性疲劳模型大鼠不同穴位后心肌和肝脏组织的相关变化[J]. 中国组织工程研究, 2015, 19(27): 4282–4287. DOI:10.3969/j.issn.2095-4344.2015.27.004 |
| [4] | da Rocha AL, Pinto AP, Teixeira GR, et al. Exhaustive training leads to hepatic fat accumulation[J]. J Cell Physiol, 2017, 232(8): 2094–2103. DOI:10.1002/jcp.v232.8 |
| [5] | Cui HJ, He HY, Yang AL, et al. Hyperbaric oxygen for experimental intracerebral haemorrhage:Systematic review and stratified meta-analysis[J]. Brain Inj, 2017, 31(4): 456–465. DOI:10.1080/02699052.2017.1279752 |
| [6] | 张雯秀, 张妍, 张衍军, 等. 低氧预处理与高氧预处理在脊髓损伤后神经保护作用的相关研究进展[J]. 中国康复理论与实践, 2018, 24(1): 90–92. DOI:10.3969/j.issn.1006-9771.2018.01.017 |
| [7] | Shimoda M, Enomoto M, Horie M, et al. Effects of hyperbaric oxygen on muscle fatigue after maximal intermittent plantar flexion exercise[J]. J Strength Cond Res, 2015, 29(6): 1648–1656. DOI:10.1519/JSC.0000000000000809 |
| [8] | 滕进忠, 袁春华, 郭洋琴, 等. 高压氧对疲劳大鼠肾损伤的保护作用研究[J]. 中国运动医学杂志, 2013, 32(6): 525–528. DOI:10.3969/j.issn.1000-6710.2013.06.008 |
| [9] | 穆旭, 李金. 肉桂酸对小鼠运动疲劳的实验研究[J]. 重庆医学, 2015, 44(35): 4932–4935. DOI:10.3969/j.issn.1671-8348.2015.35.011 |
| [10] | 齐静, 侯红平, 张广平, 等. 黄药子水提物对小鼠肝毒性及其线粒体ATP酶和超氧化物歧化酶的抗氧化机制[J]. 中国药理学与毒理学杂志, 2016, 30(8): 802–807. DOI:10.3867/j.issn.1000-3002.2016.08.002 |
| [11] | Lewis NA, Towey C, Bruinvels G, et al. Effects of exercise on alterations in redox homeostasis in elite male and female endurance athletes using a clinical point-of-care test[J]. Appl Physiol Nutr Metab, 2016, 41(10): 1026–1032. DOI:10.1139/apnm-2016-0208 |
| [12] | Dirou S, Chambellan A, Chevallier P, et al. Deconditioning, fatigue and impaired quality of life in long-term survivors after allogeneic hematopoietic stem cell transplantation[J]. Bone Marrow Transplant, 2018, 53(3): 281–290. DOI:10.1038/s41409-017-0057-5 |
| [13] | 赵星龙, 吴晓光, 尹瑞欣. 运动性疲劳与肝脏、骨骼肌细胞的关系研究进展[J]. 亚太传统医药, 2016, 12(19): 59–63. |
| [14] | Zamanian M, Shamsizadeh A, Esmaeili Nadimi A, et al. Short-term effects of troxerutin (vitamin P4) on muscle fatigue and gene expression of Bcl-2 and Bax in the hepatic tissue of rats[J]. Can J Physiol Pharmacol, 2017, 95(6): 708–713. DOI:10.1139/cjpp-2016-0653 |
| [15] | Srinivasan PK, Yagi S, Nagai K, et al. Impact of oxygen free radicals in rat partial liver transplantation[J]. J Surg Res, 2014, 191(2): 469–475. DOI:10.1016/j.jss.2014.05.002 |
| [16] | 刘建民, 吕景芳, 王华, 等. "双固一通"电针法对老年阳虚证模型大鼠肝线粒体结构及ATP酶活性的影响[J]. 上海针灸杂志, 2015, 34(1): 63–66. |
| [17] | Surhio MM, Wang Y, Fang S, et al. Anti-fatigue activity of a Lachnum polysaccharide and its carboxymethylated derivative in mice[J]. Bioorg Med Chem Lett, 2017, 27(20): 4777–4780. DOI:10.1016/j.bmcl.2017.07.034 |
| [18] | Deodhar AA, Kumthekar A, Dubreuil M. Minimal disease activity in axial spondyloarthritis:the need of the hour and a proposal for development[J]. Curr Opin Rheumatol, 2017, 29(4): 293–297. DOI:10.1097/BOR.0000000000000387 |
| [19] | Xu LQ, Xie YL, Gui SH, et al. Polydatin attenuates d-galactose-induced liver and brain damage through its anti-oxidative, anti-inflammatory and anti-apoptotic effects in mice[J]. Food Funct, 2016, 7(11): 4545–4555. DOI:10.1039/C6FO01057A |
| [20] | 陈雷, 王丽纯, 张晓菲, 等. 丙酮酸乙酯对急性胰腺炎组织细胞线粒体功能的影响[J]. 广州医学院学报, 2013, 41(4): 26–29. DOI:10.3969/j.issn.1008-1836.2013.04.007 |
| [21] | Kaplan ST, Hemsinli D, Kaplan S, et al. Amputation predictors in diabetic foot ulcers treated with hyperbaric oxygen[J]. J Wound Care, 2017, 26(7): 361–366. DOI:10.12968/jowc.2017.26.7.361 |
| [22] | 蒋煜, 胡居龙, 马佳丽, 等. 非酒精性脂肪性肝炎大鼠模型中小檗碱抗氧化效应的观察[J]. 临床肝胆病杂志, 2018, 34(6): 1273–1276. DOI:10.3969/j.issn.1001-5256.2018.06.028 |
| [23] | 姚志山, 刘丁丁, 云翔. 清肝化湿活血汤联合保肝降酶药物治疗酒精性肝病的效果分析[J]. 临床肝胆病杂志, 2016, 32(8): 1557–1561. DOI:10.3969/j.issn.1001-5256.2016.08.025 |
 2018, Vol. 44
2018, Vol. 44


