扩展功能
文章信息
- 张鹏程, 冷向阳, 路博丞, 张远超, 王英, 王旭凯
- ZHANG Pengcheng, LENG Xiangyang, LU Bocheng, ZHANG Yuanchao, WANG Ying, WANG Xukai
- 鹿茸多肽联合GDNF基因修饰的雪旺细胞对Aβ25-35诱导脊髓神经元凋亡的保护作用
- Protective effect of Schwann cells modified by VAP combined with GDNF gene on apoptosis of spinal cord neurons induced by Aβ25-35
- 吉林大学学报(医学版), 2018, 44(06): 1190-1193
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1190-1193
- 10.13481/j.1671-587x.20180614
-
文章历史
- 收稿日期: 2018-01-29
2. 长春中医药大学附属医院骨伤科, 吉林 长春 130021
2. Department of Orthopedics, Affiliated Hospital, Changchun University of Traditional Chinese Medicine, Changchun 130021, China
脊髓损伤(spinal cord injury,SCI)属于中枢神经损伤的一种,伴有极严重的致残致死率,常见于交通和活动等意外,对个人及社会造成极其重大的影响[1]。SCI分为原发性损伤和继发性损伤两类。原发性损伤是直接暴力作用于脊髓所造成的,多属于高能量伤所致[2],可直接造成神经元、胶原及血管的即刻性细胞死亡。细胞凋亡是一种常见的生命现象,是某种或几种基因调控下的细胞主动死亡过程。SCI后,有许多因素可诱导脊髓神经元凋亡[3]。研究[4]显示在机体神经损伤的急性期细胞凋亡的作用尤为主要。近年来SCI后神经的修复问题一直是医学界研究的热点和难点,而其细胞凋亡机制研究受到高度重视[5]。鹿茸多肽(velvet antler polypeptides,VAP)是从鹿科雄性梅花鹿幼角中提取的一种蛋白多肽类活性因子,具有促进神经再生的功效[6]。研究[7]证实:VAP可使β淀粉样蛋白25-35(Aβ25-35)诱导大鼠腹部脊髓神经元凋亡,细胞中caspase-3表达下降,VAP对Aβ25-35诱导产生的大鼠腹部脊髓神经元凋亡具有一定抑制作用。体外实验[8]表明:胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)基因修饰的雪旺细胞(Schwann cells,SCs)可抑制脊髓神经元凋亡,并且对脊髓神经功能的修复具有一定的促进作用。本研究探讨VAP联合GDNF基因修饰的雪旺细胞对脊髓神经元凋亡的保护作用,旨在为临床上治疗SCI提供实验和理论依据。
1 材料与方法 1.1 实验动物、细胞、主要试剂和仪器选用清洁级8~16周性成熟Wistar大鼠160只,雌雄各半,雌性大鼠体质量200~ 220 g,雄性大鼠体质量220~250 g,动物合格证编号:SCXK-(吉)2011-2014,购自吉林省长春市亿斯实验动物技术有限公司。实验大鼠饲养温度保持为18℃~ 25℃,自然采光,通风良好,湿度保持在60%~ 70%,普通饲料喂养,食水正常。每日定期维护鼠笼的清洁,确保饲养环境的洁净无外界打扰。实验前饲养大鼠适应实验室5 d后开始实验。SCs和GDNF由吉林大学基础医学院医学生物学实验中心提供;VAP由长春中医药大学制药中心提供。多聚赖氨酸和2%戊巴比妥钠(美国Sigma公司),DMEM低糖培养基(美国Gibco公司),羊抗兔IgG和兔抗大鼠Bcl-2、Bax (武汉博士德生物工程有限公司),免疫组织化学试剂盒(北京中杉金桥生物技术有限公司),胎牛血清(浙江天杭科技股份有限公司),胰酶(上海雅心生物技术有限公司),Hank’ s液(北京谱析公司),PBS缓冲液(北京谱析公司)。CO2培养箱(日本YAMATO公司),离心机(日本Hitachi公司),倒置荧光显微镜(德国Olympus公司),培养皿、培养板和培养瓶(丹麦NUNCLON公司),流式细胞仪(美国贝克曼公司)。
1.2 胎鼠脊髓细胞悬液的培养和制备将雌雄大鼠按照1:1的比例在每日晚约21时进行合笼,次日上午8时采用滴管轻触阴门口处,如发现有乳白色、固态胶状物即阴道栓,由于阴道栓阻塞阴道口而使滴管不能进入阴道内,可判定为阳性;否则为阴性。孕鼠另取笼饲养,连续3 d未见阴栓则弃用。取孕16 d大鼠,采用2%戊巴比妥钠(3 mg·kg-1腹腔注射)麻醉大鼠后,仰卧位固定,于超净工作台上无菌取出胎鼠。将胎鼠经Hank’ s液冲洗后,于显微镜下操作完全剥离胎鼠皮肤及皮下组织,完全暴露椎管于镜下,再将椎管两侧呈楔形切开,剥离神经根,使脊髓完全暴露于视野中,并将脊髓组织分离出来。再次使用Hank’ s液冲洗剥离出来的完整脊髓组织,在镜下剪成1 mm × 1 mm× 1 mm糜状碎块。在pH= 8、37℃环境下采用0.25%胰蛋白酶消化15 min,采用5 mL移液管吹打数次后以0.075 mm筛孔尺寸滤网过滤,离心弃上清,在培养瓶中放置DMEM低糖培养基,并加入10%胎牛血清以1 × 106 mL-1接种。将培养瓶置于饱和湿度、恒温37℃、5%CO2培养箱中培养,每2~3 d更换培养基。
1.3 流式细胞术检测Aβ25-35诱导的脊髓神经元凋亡率取处于对数生长期的脊髓神经元,经过0.125%胰蛋白酶消化,采用5 mL移液管吹打数次后收集,收集后采用1 000 r·min-1室温离心5 min,弃上清。将脊髓神经元置于完全培养基中重悬,等细胞浓度调整为1 × 106mL-1后接种于24孔板。待细胞融合至80%时,加入10 μmol·L-1Aβ25-35,作用48 h后吸尽培养液,以4%多聚甲醛固定,得到实验所需细胞。4℃保存备用。镜下观察胎鼠脊髓神经元,悬液接种后初始脊髓神经元大多为圆形,诱导凋亡后细胞形态发生改变,计算细胞凋亡率。脊髓神经元凋亡率=凋亡细胞数/细胞总数×100%。
1.4 细胞分组将培养细胞分为6组,即正常细胞组(正常脊髓神经元)、诱导凋亡组(Aβ25-35诱导凋亡后的脊髓神经元)、SCs组(Aβ25-35诱导凋亡后的脊髓神经元+SCs)、GDNF组(Aβ25-35诱导凋亡后的脊髓神经元+GDNF)、SCs+GDNF组(Aβ25-35诱导凋亡后的脊髓神经元+GDNF转染的SCs)和VAP联合组(Aβ25-35诱导凋亡后的脊髓神经元+VAP联合GDNF转染的SCs)。
1.5 免疫组织化学染色检测各组脊髓神经元中caspase-3阳性细胞数将各组细胞置入24孔培养板上,采用甲醇固定10 min,采用37℃预热的0.1 mol·L-1PBS洗涤后再应用95%乙醇固定30 min,将一抗或二抗工作液稀释后滴加入其中,然后采用PBS洗涤3次,每次洗涤2 min再滴加适当由1%BSA-PBS稀释的生物素标记的二抗,37℃孵育10 min后冲洗复染、封片。免疫细胞化学染色结果在光镜下观察,诱导后有10%~30%细胞呈现棕色,强度不一,为阳性表达;诱导和未诱导细胞完全不显色为阴性表达。
1.6 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组脊髓神经元凋亡率以x±s表示,组间比较采用成组t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组脊髓神经元凋亡率与正常细胞组比较,诱导凋亡组脊髓神经元凋亡率明显升高(P < 0.05);与诱导凋亡组比较,SCs组、GDNF组、SCs+ GDNF组和VAP联合组脊髓神经元凋亡率降低(P < 0.05);与SCs组比较,GDNF和SCs+ GDNF组脊髓神经元凋亡率明显降低(P < 0.05);与SCs+ GDNF组比较,VAP联合组脊髓神经元凋亡率明显降低(P < 0.05)。见表 1。
| (x±s, η/%) | |
| Group | Apoptotic rate |
| Normal cell | 10.32±1.32 |
| Induced apoptosis | 58.61±4.33* |
| SCs | 40.33±3.56△ |
| GDNF | 36.21±3.09△# |
| SCs+ GDNF | 29.11±1.27△# |
| VAP combination | 23.11±2.25△○ |
| * P < 0.05 vs normal cell group;△ P < 0.05 vs induced apoptosis group;# P < 0.05 vs SCs group; ○ P < 0.05 vs SCs+GDNF group. | |
各组细胞中均有caspase-3表达,其中正常细胞组脊髓神经元中caspase-3阳性细胞数最少,细胞着色较淡;诱导凋亡组脊髓神经元中caspase-3阳性细胞数最多,细胞着色较深;VAP联合组脊髓神经元中caspase-3阳性细胞数较SCs组、GDNF组、SCs+ GDNF组减少,细胞着色差异明显;SCs组、GDNF组和SCs+ GDNF组细胞着色差异不大,caspase-3阳性细胞数相差不大,但与诱导凋亡组比较明显减少(P < 0.05)。见图 1(插页四)。
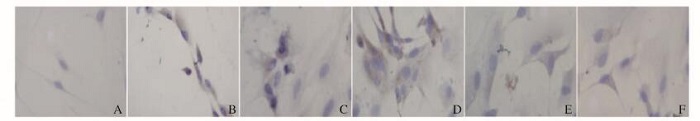
|
| A:Normal cell group; B:Induced apoptosis group; C:SCs group; D:GDNF group; E:SCs+GDNF group; F: VAP combination group. 图 1 各组脊髓神经元中caspase-3表达(免疫组织化学,×1 000) Figure 1 Expressions of caspase-3 in spinal cord neurons in various groups(Immunohistochemistry, × 1 000) |
|
|
SCI后可并发一系列病理改变,致使脊髓的损害加重,产生不同程度神经元坏死和组织变性等严重后果,最终导致神经功能异常或障碍。同时,由于中枢神经系统内神经营养因子缺乏,神经元的坏死与凋亡使得SCI后神经功能的恢复十分困难。GDNF是目前己知的神经营养因子中活性最强的运动神经营养因子[9],由于GDNF相对分子质量偏大、半衰期又相对较短,其不能自由通过血脑屏障,所以GDNF始终未能直接应用于临床。SCs可分泌多种神经营养因子,是周围神经系统的主要神经胶质细胞,能够有效促进神经元再生。研究[8, 10]显示:GDNF基因修饰的SCs可通过降低Bax mRNA表达水平和提高Bcl-2 mRNA表达水平,从而抑制脊髓神经元凋亡。本研究首先分离培养SCs,其次应用基因技术将GDNF转染SCs,得到生物活性更强的SCs,最后采用VAP联合GDNF转染的SCs进行体外实验,观察VAP联合GNDF修饰的SCs对SCI的保护作用。
鹿茸具有壮肾阳、益精血、强筋骨、调冲任和托疮毒[11]的功能。研究[12-15]显示:鹿茸中含有各种细胞生长因子,其中VAP具有促进骨及软骨愈合、加速周围神经组织再生、促进软骨细胞和成纤维细胞的增殖等功能[16-18]。研究[19-20]显示:VAP可使Bax表达水平下调和Bcl-2表达水平上调,从而抑制神经元凋亡。本文作者发现:VAP联合GDNF转染的SCs可使Aβ25-35诱导凋亡的脊髓神经元中caspase-3表达下调,从而抑制脊髓神经元凋亡。
综上所述,本研究探讨VAP联合GDNF基因修饰的SCs对Aβ25-35诱导的脊髓神经元凋亡的保护作用,证实VAP联合GDNF基因修饰的SCs对脊髓神经元具有保护作用,为临床治疗SCI寻找了新途径,也为临床优化组织工程中种子细胞的研究提供了实验和理论依据。在未来研究中,本课题组将对本研究的结论进行更深入的论证。
| [1] | 岳妍, 谭波涛, 刘媛, 等. FTY720对急性脊髓损伤大鼠神经功能及血脊髓屏障的影响[J]. 解放军医学杂志, 2015, 40(3): 200–205. |
| [2] | Stevens RD, Bhardwaj A, Kirsch JR, et al. Critical care and perioperative management in traumatic spinal cord injury[J]. J Neurosurg Anesthesiol, 2003, 15(3): 215–229. DOI:10.1097/00008506-200307000-00009 |
| [3] | Lang-Lazddunski L, Heurteaux C, Mignon A, et al. Ischemic spinal cord injury induced by aortic cross-clamping:prevention by riluzole[J]. Eur J Cardiothorac Surg, 2000, 18(2): 174–181. DOI:10.1016/S1010-7940(00)00430-9 |
| [4] | Yu WR, Liu T, Fehlings TK, et al. Involvement of mitochondrial signaling pathways in the mechanism of Fas-mediated apoptosis after spinal cord injury[J]. Eur J Neurosci, 2009, 29(1): 114–131. DOI:10.1111/ejn.2008.29.issue-1 |
| [5] | 凡进, 任永信, 蔡卫华, 等. 兔脊髓缺血再灌注损伤时BclxL/Bcl-2相关死亡启动因子的变化及其意义[J]. 中国脊柱脊髓杂志, 2011, 21(2): 142–147. DOI:10.3969/j.issn.1004-406X.2011.02.13 |
| [6] | 陈东, 孟晓婷, 刘佳梅, 等. 鹿茸多肽对胎大鼠脑神经干细胞体外诱导分化的实验研究[J]. 解剖学报, 2004, 35(3): 240–243. DOI:10.3321/j.issn:0529-1356.2004.03.004 |
| [7] | 王旭凯, 李振华, 赵宇, 等. 鹿茸多肽对辐射诱导大鼠腹部脊髓神经细胞凋亡后caspase-3表达的影响[J]. 中国老年学杂志, 2013, 33(24): 6185–6187. DOI:10.3969/j.issn.1005-9202.2013.24.054 |
| [8] | 胡文昕. GDNF基因修饰的雪旺细胞对大鼠脊髓损伤神经修复机制的实验研究[D].长春: 长春中医药大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10199-1012420652.htm |
| [9] | 龚庆, 杨春辉, 宋秋莹. 鹿茸多肽对骨髓间充质干细胞向神经元样细胞转化的促诱导作用[J]. 医药卫生:文摘版, 2016, 14(3): 230. |
| [10] | 王旭凯. GDNF基因修饰的雪旺细胞对大鼠脊髓损伤保护作用的实验研究[D].长春: 吉林大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10183-2009093632.htm |
| [11] | 国家药典委员会. 中华人民共和国药典:一部[M]. 北京: 中国医药科技出版社,2010: 303. |
| [12] | Gilbey A, Perezgonzalez JD. Health benefits of deer and elk velvet antler supplements:a systematic review of randomised controlled studies[J]. N Z Med J, 2012, 125(1367): 80–86. |
| [13] | 李晶峰, 金平, 边学峰, 等. 鹿茸在神经性疾病治疗中的作用[J]. 吉林中医药, 2018, 38(1): 62–63. |
| [14] | 王楠, 高晓霞, 秦雪梅, 等. 鹿茸药效物质基础、药理作用、临床应用及质量控制的研究进展[J]. 中草药, 2017, 11(48): 4784–4790. |
| [15] | 高冷, 王昊天, 牛晓晖, 等. 鹿茸多肽蛋白的提取及功能研究[J]. 吉林中医药, 2018, 38(3): 825–828. |
| [16] | Xiu ZB, Lin JH, Wu ZY, et al. Effect of pilose antler polypeptides on chondrogenic phenotype differentiation of bone marrow derived mesenchymal stem cells in vitro[J]. J Clin Rehabilit Tissue Engin Res, 2011, 15(19): 3563–3566. |
| [17] | 朱文赫, 李亚巍, 沈楠, 等. 不同交联方法制备的鹿茸多肽-胶原蛋白/壳聚糖复合材料对成骨细胞增殖的影响[J]. 中国实验方剂学杂志, 2014, 20(14): 5–8. |
| [18] | 杨光旭, 魏雪苗, 范红艳, 等. 鹿茸多肽药理学活性的研究进展[J]. 吉林医药学院学报, 2017, 38(4): 126–129. |
| [19] | 黄晓巍, 王艳玲, 李哲, 等. 鹿茸多肽对冈田酸致大鼠海马神经元损伤时Tau、Bcl-2和caspase-3表达的影响[J]. 吉林大学学报:医学版, 2017, 43(1): 26–31. |
| [20] | 李朝政, 徐岩, 黄晓巍, 等. 鹿茸多肽对神经细胞损伤修复的研究进展[J]. 中国老年学杂志, 2016, 36(3): 763–765. DOI:10.3969/j.issn.1005-9202.2016.03.110 |
 2018, Vol. 44
2018, Vol. 44


