扩展功能
文章信息
- 赵丽艳, 宋扬, 吕晓艳, 贾茗博, 朱洪权
- ZHAO Liyan, SONG Yang, LYU Xiaoyan, JIA Mingbo, ZHU Hongquan
- 上皮-间质转化胶质瘤细胞的干细胞样特性及白藜芦醇对其干细胞样特性的抑制作用
- Stem cell-like properties of glioma cells undergoing epithelial to mesenchymal transition and inhibitory effect of resveratrol on their stem cell-like properties
- 吉林大学学报(医学版), 2018, 44(06): 1185-1189
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1185-1189
- 10.13481/j.1671-587x.20180613
-
文章历史
- 收稿日期: 2018-06-21
2. 吉林大学第一医院神经外科, 吉林 长春 130021
2. Department of Neurosurgery, First Hospital, Jilin University, Changchun 130021, China
脑胶质瘤是最常见的预后不良颅内肿瘤,肿瘤呈侵袭性生长,治疗困难和复发率高。尽管近年采取多项积极的综合性治疗措施,但胶质瘤的预后仍然很差,特别是恶性胶质瘤,确诊后患者中位生存期仅为14.6个月[1]。近年大量研究[2-3]显示:上皮性肿瘤细胞经历上皮-间质转化(epithelial to mesenchymal transition, EMT)可以获得或呈现干细胞样性能,形成具有干细胞样特性的细胞,而具有肿瘤干细胞(cancer stem cells, CSCs)特性的细胞是肿瘤形成、进展、治疗抵抗、侵袭和复发的根本原因[4]。EMT在肿瘤进展中具有双重病理学意义:一方面EMT是肿瘤侵袭和转移的关键生物学基础;另一方面EMT过程能生成具有干细胞样特性的细胞。目前对EMT与肿瘤细胞侵袭和转移关系的研究比较深入,而对EMT过程中获得干细胞样特性的研究较少,特别是关于非上皮性肿瘤细胞如胶质瘤细胞发生EMT过程中获得干细胞样特性的研究尚未见报道。EMT与干细胞的关系已引起研究者[5-6]的高度关注,因为这可能是CSCs新的来源途径。本课题组前期研究[7]证明:胶质瘤细胞可以发生EMT,但尚不清楚胶质瘤细胞发生EMT过程中能否产生具有干细胞样特性的细胞。多酚化合物白藜芦醇(resveratrol, Res)能抑制胶质瘤细胞发生EMT,然而Res能否抑制胶质瘤细胞EMT过程中产生的干细胞样特性目前尚未见相关研究。
1 材料与方法 1.1 细胞、主要试剂和仪器人胶质母细胞瘤U87细胞购自美国ATCC细胞库。DMEM培养基、Neurobasal培养基、N2添加剂、B27添加剂、GlutaMax、肝素、Accutase消化液和胰酶-EDTA消化液为美国Gibco公司产品,胎牛血清(fetal bovine serum, FBS)、青霉素和链霉素购自美国Sigma公司,重组人表皮生长因子(recombinant human epidermal growth factor, EGF)、重组人碱性成纤维细胞生长因子(recombinant human basic fibroblast growth factor, bFGF)和转化生长因子β1 (transforming growth factor-β1, TGF-β1)购自美国Peprotech公司,Res购自美国ApexBio公司,抗N-钙黏蛋白(N-cadherin)、抗波形蛋白(Vimentin)、抗Snail、抗Slug、抗Zeb1、抗Bmi1和抗Sox2抗体购自美国Cell Signaling Technology公司,抗Twist1抗体购自中国万类生物公司,RIPA细胞裂解液、BCA蛋白浓度测定试剂盒和SDS蛋白上样缓冲液购自中国碧云天公司,蛋白Marker为美国Thermo公司产品,抗β-tubulin抗体购自美国Origene公司。细胞培养箱和超净工作台为美国Thermo公司产品,倒置显微镜购自日本Olympus公司,电泳仪和转膜仪为美国Bio-Rad公司产品。
1.2 胶质瘤U87细胞的培养人恶性胶质瘤U87细胞采用含10%FBS、100 U·mL-1青霉素和100 mg·L-1链霉素的DMEM培养基,在37℃、5%CO2饱和湿度培养箱内培养。每2~3 d更换1次培养基,每3~5 d采用胰酶-EDTA消化液消化后按1:2~1:3传代。
1.3 倒置显微镜观察胶质瘤U87细胞的形态表现为观察TGF-β1诱导胶质瘤细胞EMT后细胞的形态表现,取处于对数生长期的U87细胞接种于6孔板中,每孔3×105个细胞。细胞过夜贴壁后,更换含有10×10-6g·L-1 TGF-β1和1% FBS的DMEM培养基培养48 h。倒置显微镜观察细胞的形态表现,并照相记录。
1.4 Western blotting法检测胶质瘤细胞中间质标志物和诱导EMT转录因子表达水平取对数生长期U87细胞接种于10 cm细胞培养皿中,细胞密度为每皿5×105个,置于37℃培养箱中培养,待细胞生长至70%~80%汇合时,换为无血清培养基饥饿细胞12 h,再加入终浓度分别5×10-6g·L-1、10×10-6g·L-1和20 ×10-6g·L-1 TGF-β1,以不加入TGF-β1的细胞为对照组。作用48 h后吸弃培养基,收集细胞,离心,根据沉淀的量加入相应体积RIPA裂解液提取细胞蛋白,采用BCA试剂盒进行蛋白定量。每孔加入30~50 μg蛋白,进行聚丙烯酰胺凝胶电泳,电转蛋白至PVDF膜上,室温下使用含5%脱脂奶粉的TBS封闭1 h,而后分别加入含有抗N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、Snail、Slug、Zeb1、Twist1和β-tubulin的一抗(在TBST配制的5%脱脂奶粉中),4℃过夜孵育。次日,TBST洗膜3次,加入含有相应二抗、采用TBST配制的5%脱脂奶粉孵育1~2 h,再洗膜3次,加入ECL显色剂,在Sagecreation凝胶成像系统中显影。采用AlphaEaseFC软件分析目的条带灰度值,以β-tubulin为内参,目的条带相对灰度值=目的条带灰度值/β-tubulin灰度值,以目的条带相对灰度值代表检测物蛋白表达水平。
1.5 胶质瘤细胞发生EMT后分组确定胶质瘤U87细胞发生EMT后,将实验分为对照组(U87细胞不做任何处理)、EMT组(TGF-β1诱导U87细胞发生EMT)和Res处理组(EMT组基础上采用Res处理发生EMT的细胞)。
1.6 二代胶质球形成数和形态表现Neurobasal培养基成分包括:20 μg·L-1 EGF、20 μg·L-1 bFGF、2 mg·L-1肝素、1×B27添加剂、1×N2添加剂、1×GlutaMAX、100 U·mL-1青霉素和100 mg·L-1链霉素。按Song等[8]的方法检查胶质球形成数。将诱导发生EMT的胶质瘤U87细胞采用Neurobasal培养基重悬,按每孔5×103个细胞接种于超低黏度96孔板,在Neurobasal培养基中加入不同浓度(20和40μmol·L-1)Res,置于含5% CO2培养箱37℃培养7 d,每2~3 d换液1次并添加新鲜EGF和bFGF。待悬浮生长的胶质球直径大于40 μm时离心收集,即为一代胶质球。将一代胶质球采用Accutase消化液消化分散为单个细胞悬液后,接种于超低黏度96孔板,采用无血清Neurobasal培养基培养,每2 d补充Neurobasal培养基0.02 mL,7 d后倒置显微镜计数形成的二代胶质球数并观察其形态表现。
1.7 Western blotting法检测干细胞标志物Bmi1和Sox2表达水平取二代胶质球采用Accutase消化液消化分散为单个细胞悬液,加入或不加入终浓度为20和40 μmol·L-1Res作用48 h后弃掉培养基,收集细胞,离心后弃去上清,加入RIPA裂解液提取细胞蛋白,应用BCA试剂盒进行蛋白定量。使用的一抗为抗Bmi1和抗Sox2。其他操作同1.4。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。胶质瘤细胞中N-钙黏蛋白、波形蛋白、Snail、Slug、Zeb1和Twist1蛋白表达水平及二代胶质球形成数以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
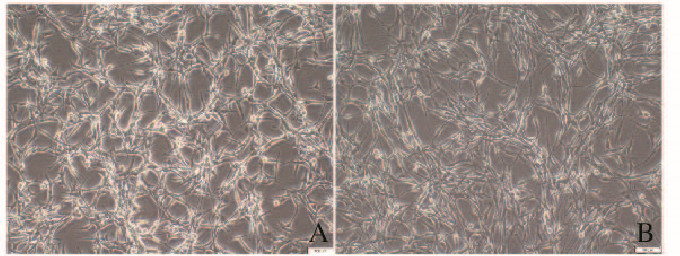
2 结果 2.1 胶质瘤U87细胞的形态表现与对照组比较,U87细胞暴露于各浓度TGF-β1 48 h后,细胞呈分散状,拉长,类似成纤维细胞外观。见图 1(插页四)。
|
| A: Control group; B: 10×10-6g·L-1 TGF-β1 group. 图 1 倒置显微镜下2组胶质瘤U87细胞形态表现(×100) Figure 1 Morphology of glioma U87 cells in two groups under inverted microscope(×100) |
|
|
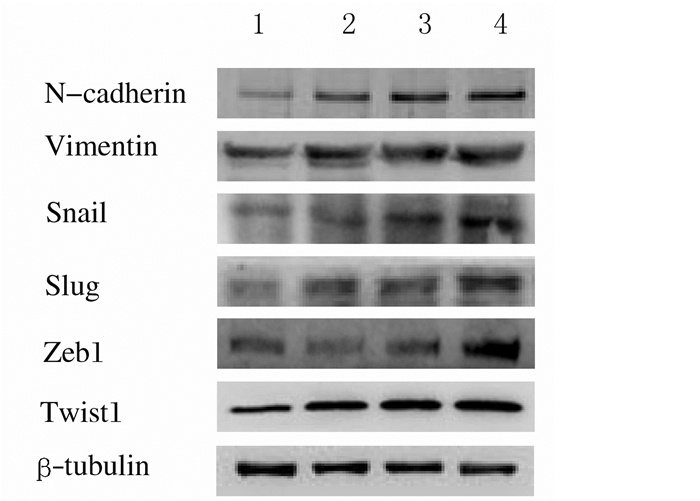
随着诱导剂TGF-β1浓度的升高,间质标志物N-cadherin和Vimentin表达水平逐渐升高(图 2和表 1),诱导EMT的转录因子Snail、Slug、Zeb1和Twist1蛋白表达水平也明显升高(图 2和表 2)。10×10-6g·L-1(10 μg·L-1)TGF-β1即能明显诱导胶质瘤U87细胞发生EMT,因此在后续实验中采用10×10-6g·L-1 TGF-β1作为诱导EMT的浓度。
|
| Lane 1: Controlgroup; Lane 2: 5×10-6g·L-1 TGF-β1 group; Lane 3: 10×10-6 g·L-1 TGF-β1 group; Lane 4: 20×10-6 g·L-1 TGF-β1 group. 图 2 胶质瘤U87细胞中间质标志物和诱导EMT转录因子表达的电泳图 Figure 2 Electrophoregram of expressions of mesenchymal markers and EMT-inducing transcription factors in glioma U87 cells |
|
|
| (n=3, x±s) | ||
| Group | N-cadherin | Vimentin |
| Control | 0.99±0.06 | 0.98±0.06 |
| TGF-β1(×10-6g·L-1) | ||
| 5 | 1.29±0.05* | 1.20±0.08* |
| 10 | 1.47±0.04** | 1.29±0.06** |
| 20 | 1.50±0.05** | 1.36±0.06** |
| * P<0.05, * * P<0.01 vs control group. | ||
| (n=3, x±s) | ||||
| Group | Snail | Slug | Zeb1 | Twist1 |
| Control | 1.00±0.06 | 0.99±0.03 | 0.99±0.07 | 1.00±0.05 |
| TGF-β1(×10-6g·L-1) | ||||
| 5 | 1.24±0.05** | 1.37±0.04** | 1.03±0.06 | 1.46±0.05** |
| 10 | 1.71±0.07** | 1.40±0.04** | 1.14±0.03* | 1.64±0.05** |
| 20 | 1.78±0.05** | 1.63±0.05** | 1.37±0.07** | 1.73±0.04** |
| * P<0.05, * * P<0.01 vs control group. | ||||
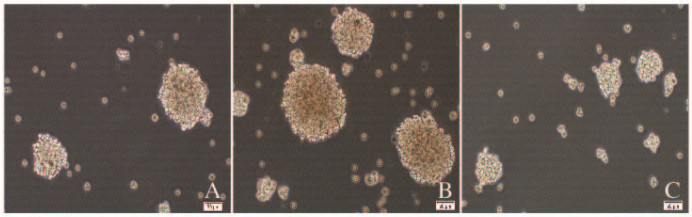
EMT组二代胶质球的形成数[(100±6)个]明显多于对照组[(70±5)个](P<0.01),胶质球的体积较大;Res处理组二代胶质球的形成数[(35±4)个]明显少于EMT组[(100±6)个](P<0.01),胶质球的体积缩小。见图 3(插页四)。
|
| A: Control group; B: EMT group; C: Res treatment group. 图 3 各组胶质瘤U87细胞中二代胶质球形态表现(×100) Figure 3 Morphology of second-generation gliospheres in glioma U87 cells in various groups(×100) |
|
|
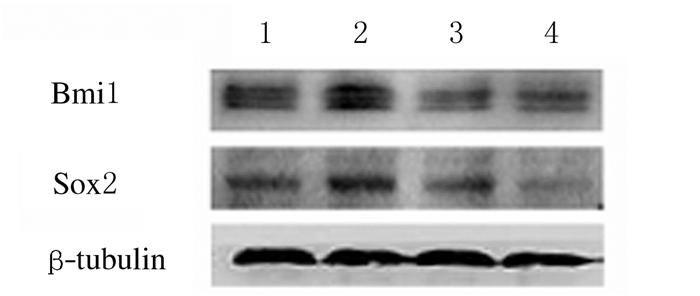
与对照组比较,EMT组胶质瘤细胞中干细胞标志物Bmi1和Sox2表达水平明显升高(P<0.05或P<0.01)。与EMT组比较,Res处理组胶质瘤细胞中干细胞标志物Bmi1和Sox2表达水平明显降低(P<0.01)。见图 4和表 3。
|
| Lane 1: Control group; Lane 2: EMT group; Lane 3: Res treatment group (20 μmol·L-1Res); Lane 4: Res treatment group (40 μmol·L-1Res). 图 4 各组胶质瘤U87细胞中干细胞标志物Bmi1和Sox2表达电泳图 Figure 4 Electrophoregram of expressions of stem cell markers Bmi1 and Sox2 in glioma cells in various groups |
|
|
| (n=3, x±s) | ||
| Group | Bmi1 | Sox2 |
| Control | 1.01±0.05 | 1.01±0.03 |
| EMT | 1.26±0.04** | 1.17±0.03* |
| Res treatment (20 μmol·L-1) | 0.92±0.04△ | 0.98±0.04△ |
| Res treatment (40 μmol·L-1) | 0.91±0.04△ | 0.87±0.06△ |
| * P<0.05, * * P<0.01 vs control group; △ P<0.01 vs EMT group. | ||
本研究结果显示:与对照组比较,暴露于不同浓度TGF-β1的EMT组胶质瘤U87细胞中间质标志物N-cadherin和Vimentin表达水平明显升高;诱导EMT的转录因子Snail、Slug、Zeb1和Twist1蛋白表达水平也明显升高;倒置显微镜观察到细胞呈分散状、拉长,类似成纤维细胞外观。上述结果表明:TGF-β1诱导胶质瘤U87细胞发生了EMT,这与本课题组之前的研究[7]结果一致。
Mani等[9]最早发现:经历EMT的永生化人乳腺上皮细胞产生具有干细胞样特性的细胞。这一发现此后相继在肺癌、结直肠癌和肾癌等实体瘤[10-12]中被证实。然而,经历EMT的胶质瘤细胞能否产生干细胞样特性的细胞目前尚未见报道。研究[13]表明:干细胞的重要特性之一是具有自我更新能力。在无血清和悬浮培养条件下CSCs能形成肿瘤球,这是干细胞的一个特性。肿瘤球形成分析是检测CSCs自我更新能力的重要体外功能性实验,是确定CSCs的有用技术,二代肿瘤球形成更能说明干细胞的自我更新能力[14-15]。本研究结果显示:经历EMT的胶质瘤U87细胞二代胶质球形成数较对照组明显增多,胶质球的体积也增大,表明经历EMT的胶质瘤细胞呈现出干细胞的特征之一,即自我更新能力。而Res处理能明显减少二代胶质球形成数,胶质球的体积也缩小,表明Res可以抑制发生EMT胶质瘤细胞的自我更新能力,即抑制干细胞的一个重要特征。
Bmi1和Sox2均是干细胞标志物,是维持CSCs干细胞样特征的重要因子[16]。研究[17]显示:Bmi1在维持干细胞样特性和自我更新中起重要作用。Song等[18]的研究证明:转录因子Sox2在胶质瘤干细胞样特性维持中起主导作用,是调控细胞自我更新的关键因子[19]。本研究结果显示:诱导胶质瘤EMT后干细胞标志物Bmi1和Sox2表达水平明显升高,表明诱导胶质瘤EMT能产生具有干细胞性能的细胞,而Res处理能抑制Bmi1和Sox2表达水平,进一步证明Res能抑制发生EMT的胶质瘤细胞呈现的干细胞样特性。
目前,关于单独靶向抑制或根除CSCs药物的研发很多,但关于靶向抑制肿瘤细胞EMT所获得干细胞的药物研究很少。本研究结果证明:Res能抑制胶质瘤细胞EMT呈现的干细胞样特性。这一研究结果提示:抑制EMT具有更深层的意义,这是因为抑制EMT一方面能抑制肿瘤细胞的侵袭和转移,另一方面能抑制EMT生成的CSCs,而CSCs在肿瘤发生、进展、耐药和复发中起根本作用。因此,靶向抑制EMT已成为当前抗肿瘤药物研发的热点[20],具有良好的临床应用前景。
| [1] | Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459–466. DOI:10.1016/S1470-2045(09)70025-7 |
| [2] | Liu X, Fan D. The epithelial-mesenchymal transition and cancer stem cells:functional and mechanistic links[J]. Curr Pharm Des, 2015, 21(10): 1279–1291. DOI:10.2174/1381612821666141211115611 |
| [3] | Sato R, Semba T, Saya H, et al. Concise review:Stem cells and epithelial-mesenchymal transition in cancer:Biological implications and therapeutic targets[J]. Stem Cells, 2016, 34(8): 1997–2007. DOI:10.1002/stem.2406 |
| [4] | Dragu DL, Necula LG, Bleotu C, et al. Therapies targeting cancer stem cells:Current trends and future challenges[J]. World J Stem Cells, 2015, 7(9): 1185–1201. |
| [5] | Mladinich M, Ruan D, Chan CH. Tackling cancer stem cells via inhibition of EMT transcription factors[J]. Stem Cells Int, 2016, 2016: 5285892. |
| [6] | Prieto-García E, Díaz-García CV, García-Ruiz I, et al. Epithelial-to-mesenchymal transition in tumor progression[J]. Med Oncol, 2017, 34(7): 122. DOI:10.1007/s12032-017-0980-8 |
| [7] | 宋扬, 赵丽艳, 陈勇, 等. TGFβ1对胶质瘤U87细胞上皮-间质转化的诱导作用[J]. 吉林大学学报:医学版, 2016, 42(6): 1087–1091. |
| [8] | Song Y, Chen Y, Li Y, et al. Metformin inhibits TGF-β1-induced epithelial-to-mesenchymal transition-like process and stem-like properties in GBM via AKT/mTOR/ZEB1 pathway[J]. Oncotarget, 2018, 9(6): 7023–7035. |
| [9] | Mani SA, Guo W, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133(4): 704–715. DOI:10.1016/j.cell.2008.03.027 |
| [10] | Pirozzi G, Tirino V, Camerlingo R, et al. Epithelial to mesenchymal transition by TGFβ-1 induction increases stemness characteristics in primary non small cell lung cancer cell line[J]. PLoS One, 2011, 6(6): e21548. DOI:10.1371/journal.pone.0021548 |
| [11] | Fan F, Samuel S, Evans KW, et al. Overexpression of snail induces epithelial-mesenchymal transition and a cancer stem cell-like phenotype in human colorectal cancer cells[J]. Cancer Med, 2012, 1(1): 5–16. DOI:10.1002/cam4.4 |
| [12] | Singla M, Kumar A, Bal A, et al. Epithelial to mesenchymal transition induces stem cell like phenotype in renal cell carcinoma cells[J]. Cancer Cell Int, 2018, 18: 57. DOI:10.1186/s12935-018-0555-6 |
| [13] | Gürsel DB, Shin BJ, Burkhardt JK, et al. Glioblastoma stem-like cells-Biology and therapeutic implications[J]. Cancers (Basel), 2011, 3(2): 2655–2666. DOI:10.3390/cancers3022655 |
| [14] | Pastrana E, Silva-Vargas V, Doetsch F. Eyes wide open:A critical review of sphere-formation as an assay for stem cells[J]. Cell Stem Cell, 2011, 8(5): 486–498. DOI:10.1016/j.stem.2011.04.007 |
| [15] | Lombardo Y, de Giorgio A, Coombes CR, et al. Mammosphere formation assay from human breast cancer tissues and cell lines[J]. J Vis Exp, 2015, 97: e52671–e52675. |
| [16] | Ota I, Masui T, Kurihara M, et al. Snail-induced EMT promotes cancer stem cell-like properties in head and neck cancer cells[J]. Oncol Rep, 2016, 35(1): 261–266. DOI:10.3892/or.2015.4348 |
| [17] | Bhattacharya R, Mustafi SB, Street M, et al. Bmi-1:At the crossroads of physiological and pathological biology[J]. Genes Dis, 2015, 2(3): 225–239. DOI:10.1016/j.gendis.2015.04.001 |
| [18] | Song WS, Yang YP, Huang CS, et al. Sox2, a stemness gene, regulates tumor-initiating and drug-resistant properties in CD133-positive glioblastoma stem cells[J]. J Chin Med Assoc, 2016, 79(10): 538–545. DOI:10.1016/j.jcma.2016.03.010 |
| [19] | Mao DD, Gujar AD, Mahlokozera T, et al. A CDC20-APC/SOX2 signaling axis regulates human glioblastoma stem-like cells[J]. Cell Rep, 2015, 11(11): 1809–1821. DOI:10.1016/j.celrep.2015.05.027 |
| [20] | 王莹, 宋凡. 富亮氨酸胶质瘤失活1蛋白抗体相关自身免疫性脑炎6例临床分析[J]. 中国实用内科杂志, 2018, 38(8): 749–752. |
 2018, Vol. 44
2018, Vol. 44


